Роль белка в питании
Пищевые белки нельзя на длительное время исключить из питания человека. Опыты на растущих экспериментальных животных показали, что безбелковое питание приводит к остановке роста и гибели животных. В дальнейшем было установлено, что белок может быть заменен эквивалентной смесью аминокислот и что из 20 содержащихся в белках аминокислот незаменимыми являются только восемь: триптофан, фенилаланин, метионин, лизин, треонин, валин, лейцин и изолейцин. На потребность в метионине влияет цистин, а на потребность в фенилаланине - тирозин, так как эти аминокислоты связаны попарно взаимными превращениями. Биологическая ценность белка различна, что зависит от содержания и соотношения в них незаменимых аминокислот. Незаменимые аминокислоты пищевых белков используются в организме для синтеза тканевых белков и ферментов, т. е. на пластические нужды организма, для синтеза активных небелковых соединений, являющихся промежуточными продуктами обмена отдельных аминокислот, а также в качестве источников энергии. Главным из перечисленных трех путей является первый.
Установлено, что наибольшей биологической (пищевой) ценностью по сравнению с растительными белками обладают белки куриных яиц, молока и некоторых других продуктов.
Аминокислоты в организме подвергаются ряду превращений. К общим процессам обмена аминокислот в организме человека относятся переаминирование и декарбоксилирование, т. е. процессы, затрагивающие две основные функциональные группы аминокислот: аминную и карбоксильную. Схематически природную аминокислоту можно изобразить следующим образом:
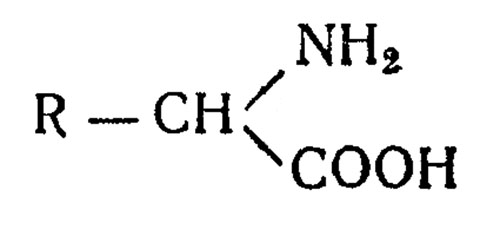
где к α-углеродному атому присоединены водород, аминная группа, карбоксильная группа и R -радикал, строение которого специфично для каждой аминокислоты. Межуточный обмен аминокислот затрагивает превращение радикала аминокислоты, что и определяет особенности в обмене индивидуальных аминокислот.
Все природные аминокислоты подвергаются трансамииированию, которое осуществляется с различной скоростью. Этот процесс по своему значению является главным в обмене аминокислот и кетокислот. Незаменимые аминокислоты в пище можно заменить соответствующими кетокислотами, из которых в организме экспериментальных животных образовались незаменимые аминокислоты. Аминокислоты подвергаются в тканях распаду, связанному с отщеплением карбоксильной группы в виде CO2 при сохранении аминогруппы, т. е. декарбоксилированию. В результате этой реакции аминокислоты превращаются в соответствующие амины:
R - CH - (NH2) - COOH → R - CH2 - NH2 + CO2
Эти реакции катализируются специфическими декарбоксилазами, коферментом которых является фосфопиридоксаль. Образующиеся амины (гистамин, тирамин, 5-окситриптамин, серотонин) обладают большой фармакологической активностью, действуя на тонус и проницаемость сосудов.
Метионин превращается в организме в цистеин. При недостатке в белке цистеина он синтезируется из незаменимой аминокислоты - метионина, поэтому при оценке пищевой ценности белков по содержанию незаменимых аминокислот, помимо метионина, учитывают и содержание цистеина. Метионин и цистеин относятся к аминокислотам, содержащим серу, и играющим большую роль в деятельности нервной системы. Метионин обеспечивает нормальное транспортирование жира из печени и ее антитоксическую функцию.
Фенилаланин превращается в тирозин и адреналин. Тироксин, образующийся из тирозина, играет большую роль в деятельности щитовидной железы, повышая ее функциональную способность. Тирозин в организме испытывает трансформацию в нор- адреналин, адреналин и пигменты (меланины).
Триптофан в организме является источником ряда метаболитов. Среди промежуточных продуктов обмена триптофана наиболее известны кинуренин, кинуреновая, ксантуреновая и никотиновая кислоты, пигменты, серотонин, индолуксуеная кислота, являющаяся гормоном роста у растений, и др.
При декарбоксилировании 5-окситриптофана образуется серотонин (5-окситриптамин), который обладает активным прессорным, депрессорным и антидиуретическим действием.
Треонин как аминокислота хотя и не принимает участия в общем кругообороте азота аминокислот, т. е. не участвует в реакции трансметилирования, в организме млекопитающих, но является незаменимой. Треонин метаболизирует двумя путями. В первом случае он подвергается дегидратированию и дезаминированию с образованием α-кетомасляной кислоты. Другой путь приводит к образованию ацетальдегида и глицина.
Лизин является относительно метаболически инертной аминокислотой и не принимает активного участия в обратимых процессах переаминирования или дезаминирования, но играет важную роль в образовании гемоглобина и повышает проницаемость капилляров. Дефицит лизина способствует развитию кариеса зубов. В организме животных и растений лизин может превращаться в пипеколиновую кислоту.
К аминокислотам с разветвленной углеродной цепью относятся валин, лейцин и изолейцин. Все они являются незаменимыми и в организме испытывают близкие превращения, подвергаясь переаминированию с образованием соответствующих α-кетокислот, а также необратимому окислительному декарбоксилированию с превращением остатка углеродного скелета в соответствующие ацилпроизводные коэнзима А. Дефицит валина приводит к потере аппетита, нарушению деятельности центральной нервной системы, а дефицит лейцина - к быстрой потере веса.
| Аминокислота | Цельное коровье молоко | Казеин из коровьего молока | Мышцы млекопитающих | Мышцы рыб | Мышцы домашней птицы | Мышцы ракообразных | Белки печени | Белки сердца | Белки цельного куриного яйца | Белки куриного желтка | Белки цельной пшеницы | Белки овсяной муки | Белки кукурузной муки | Белки гороха и фасоли | Белки соевой муки | Белки дрожжей |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Метионин | 2,1 | 2,4 | 2,5 | 2,8 | 2,4 | 2,7 | 2,3 | 2,3 | 3,3 | 2,4 | 1,2 | 1,5 | 1,8 | 1,1 | 1,1 | 1,4 |
| Цистин | 1,5 | 0,9 | 1,4 | 1,2 | 1,0 | 1,9 | 1,7 | 2,2 | 2,3 | 1,3 | 3,3 | 1,2 | 1,6 | 1,2 | 1,2 | 1,1 |
| Фенилаланин | 4,7 | 5,1 | 4,5 | 3,8 | 4,1 | 4,0 | 5,1 | 5,0 | 5,6 | 4,9 | 4,4 | 4,8 | 4,5 | 5,2 | 4,8 | 4,0 |
| Тирозин | 4,9 | 4,9 | 3,1 | 2,4 | 2,7 | 4,0 | 3,6 | 3,2 | 4,1 | 4,7 | 3,6 | 3,9 | 4,6 | 4,6 | 3,4 | 3,5 |
| Триптофан | 1,5 | 1,3 | 1,1 | 0,9 | 1,0 | 1,0 | 1,6 | 1,4 | 1,6 | 1,6 | 1,2 | 1,2 | 0,7 | 0,9 | 1,2 | 1,4 |
| Треонин | 4,6 | 4,7 | 4,6 | 4,5 | 4,0 | 4,3 | 4,7 | 4,9 | 5,0 | 5,7 | 3,9 | 3,7 | 4,1 | 4,0 | 3,9 | 5,3 |
| Лизин | 7,4 | 8,0 | 8,5 | 10,1 | 7,7 | 11,1 | 7,5 | 8,1 | 6,9 | 7,1 | 2,5 | 4,4 | 2,7 | 6,1 | 6,6 | 6,7 |
| Валин | 6,5 | 6,7 | 5,5 | 5,5 | 4,1 | 4,3 | 6,1 | 6,0 | 7,4 | 6,8 | 4,5 | 5,3 | 5,3 | 5,3 | 5,2 | 6,0 |
| Лейцин | 9,7 | 9,9 | 8,0 | 7,9 | 8,2 | 9,6 | 9,1 | 9,0 | 9,4 | 9,3 | 6,9 | 7,2 | 12,7 | 8,1 | 7,6 | 6,5 |
| Изолейцин | 6,4 | 6,5 | 4,7 | 5,2 | 4,2 | 4,6 | 5,0 | 4,8 | 6,9 | 6,2 | 4,4 | 4,9 | 4,0 | 5,3 | 5,8 | 5,3 |
| Гистидин | 2,6 | 2,7 | 2,8 | 2,9 | 2,0 | 2,0 | 2,6 | 2,5 | 2,4 | 2,5 | 1,8 | 2,2 | 2,4 | 2,7 | 2,5 | 2,3 |
| Аргинин | 4,0 | 3,5 | 6,6 | 6,6 | 6,7 | 7,6 | 5,7 | 5,6 | 6,7 | 7,4 | 4,3 | 6,9 | 4,4 | 7,1 | 7,0 | 4,4 |
| Глицин | 2,1 | 2,1 | 5,0 | 5,4 | 5,7 | 6,8 | 4,6 | 5,2 | 3,6 | 3,5 | 3,4 | 3,6 | 3,5 | 4,6 | 3,8 | 4,1 |
| Алании | 3,6 | 3,6 | 6,5 | 6,1 | - | 5,8 | 6,7 | 7,8 | - | - | 3,0 | 5,2 | 10,0 | 4,1 | 4,5 | 8,5 |
| Серин | 4,9 | 5,2 | 3,1 | 3,5 | - | - | 5,4 | 6,2 | 7,8 | 6,9 | 3,8 | 3,7 | 4,4 | 5,4 | 5,6 | 5,6 |
| Пролин | 8,9 | 9,2 | 5,0 | 5,1 | - | - | 5,0 | 6,1 | 4,5 | - | 10,3 | 4,9 | 7,2 | 3,8 | 5,4 | 4,2 |
| Аспарагиновая | 7,7 | 7,5 | 8,0 | 8,6 | 10-11 | 9,3 | 8,0 | 8,4 | 8,2 | 5,6 | 3,8 | 4,1 | 12,3 | 8,1 | 8,3 | 8,3 |
| Глютаминовая | 19,4 | 21,7 | 14,6 | 12,0 | 16-18 | 15,5 | 11,8 | 13,9 | 12,6 | 12,0 | 31,4 | 14,3 | 18,4 | 18,5 | 18,5 | 11,7 |
Гистидин - аминокислота, являющаяся источником ряда биологически активных соединений: гистамина, карнозина, ансерина, эрготионина и некоторых других. Основной путь катаболизма гистидина осуществляется через образование уроканиновой кислоты с последующим превращением в глютаминовую и муравьиную кислоты.
Аминокислотный состав пищевых белков. Не существует пищевых белков, идеальных по соотношению незаменимых аминокислот, которые одинаково хорошо удовлетворяли бы все живые организмы. Можно думать, что белки птичьих яиц идеально удовлетворяют потребности растущего эмбриона, белки молока - новорожденных данного вида. В этом случае незаменимые аминокислоты используются наиболее продуктивно. Биологическая ценность белков находится в прямой зависимости от их аминокислотного состава (табл. 1). Однако в яичном белке недостаточно лизина для удовлетворения потребностей организма млекопитающих (дефицит лизина равен примерно 6%). Добавление этой аминокислоты ускоряет рост животных. Белки коровьего молока содержат избыток лизина, лейцина, триптофана, гистидина и треонина. Пищевая ценность этих белков ограничивается дефицитом содержащих серу аминокислот, примерно равным 20%. Белки кукурузы значительно беднее первых двух групп пищевых белков. Они дефицитны по многим аминокислотам: лизину (60% нормы), триптофану, аминокислотам, содержащим серу, валину, изолейцину и треонину. В этих белках содержится избыток лейцина, гистидина, фенилаланина (тирозина). Биологическую ценность растительных белков можно значительно увеличить, сочетая их с белками молока. Так, смесь 60% белков кукурузы и 40% белков молока по биологической ценности почти эквивалентна белкам молока. Сочетание растительных и животных белков обеспечивает наилучшую регенерацию составных частей гемоглобина.
Потребность человека в белках, аминокислотах и других веществах находится в прямой зависимости от его мышечной деятельности. В настоящее время взрослое трудоспособное население нашей страны разбито в отношении норм питания на четыре группы по интенсивности физического труда: I группа - лица, работа которых не связана с затратой физического труда или требует несущественных физических усилий; II группа - работники механизированного труда и сферы обслуживания, труд которых не требует большого физического напряжения (швейники, кондукторы, продавцы, медицинские сестры и др.); III группа - работники механизированного труда и сферы обслуживания, труд которых связан со значительными физическими усилиями (станочники, текстильщики, обувщики, водители поездов, почтальоны и др.); IV группа - работники немеханизированного или частично механизированного труда средней и большой тяжести (горнорабочие, шахтеры, строительные рабочие, водители грузовых машин, металлурги, кузнецы и др.).
| Группа населения | Пол | Возраст в годах | Белки (в том числе животные) | Жиры (в том числе растительные) | Углеводы |
|---|---|---|---|---|---|
| I | М. Ж. |
18-40 40-60 18-40 40-60 |
96(58) 89(53) 82(49) 75(45) |
90(27) 84(25) 77(23) 70(21) |
382 355 329 303 |
| II | М. Ж. |
18-40 40-60 18-40 40-60 |
99(54) 92(50) 84(46) 77(43) |
97(29) 91(27) 82(25) 76(23) |
413 385 352 324 |
| III | М. Ж. |
18-40 40-60 18-40 40-60 |
102(56) 93(51) 86(47) 79(44) |
103(31) 94(28) 87(26) 81(25) |
445 401 375 347 |
| IV | М. Ж. |
18-40 40-60 18-40 40-60 |
108(54) 100(50) 92(46) 85(43) |
120(36) 110(33) 102(30) 94(28) |
522 480 444 409 |
| Старший возраст | М. Ж. |
60-70 Свыше 70 60-70 Свыше 70 |
80(48) 75(45) 71(43) 68(41) |
76(27) 71(25) 67(23) 63(22) |
320 300 288 277 |
| Студенты | М. Ж. |
113(68) 96(58) |
106(32) 90(27) |
451 383 |
|
| Очень тяжелый труд | М. | 132(66) 154(77) |
145(43) 145(44) |
637 615-683 |
|
| Спортсмены на соревнованиях и тренировках | М. Ж. |
171(86) 120(60) 137(69) |
161(48) 113(34) 129(39) |
477-546 |
(Примечания. 1. Потребность в белках женщин на V-IX месяце беременности увеличивается до 109 г день (в том числе 65 г животных белков).
2. Потребность в белках кормящих матерей составляет 120 г (в том числе 72 г животных белков).)
В зависимости от интенсивности труда установлена и физиологическая потребность населения в белке, жире и углеводах (табл. 2 и 3).
Менее разработан вопрос о нормах незаменимых аминокислот. Потребность в аминокислотах, как и оптимальное соотношение их, легко вычислить из аминокислотного состава некоторых пищевых белков, обладающих наибольшей биологической ценностью. Такими белками могут быть белки молока и яйца. Некоторые данные по этому вопросу представлены в табл. 4.
При сравнительном исследовании пищевой ценности белков и эквивалентных им смесей аминокислот или гидролизатов лучшие результаты были получены с белками.
В опытах на животных было показано, что массивные дозы любой аминокислоты могут давать токсический эффект. Изучаемые аминокислоты добавлялись в диеты, содержащие различные количества белка. Так, на растущих крысах, получавших диету с 12% казеина, было доказано, что добавление 1% тирозина приводит к задержке роста и другим аномалиям. Взрослые крысы более устойчивы к тирозину, чем молодые. Тирамин, добавленный к диете в количествах свыше 1%, не вызывал подобных явлений. Применение диеты, содержавшей 6% казеина, показало, что токсический эффект тирозина, вызываемый его 3% добавкой, может быть снят одновременным введением 0,8% треонина. Добавление к диете 6-12% ι-метионина приводило к высокой смертности, снижению поедаемости корма, потере веса, атрофии печени и селезенки. Токсическое действие метионина возрастало при диетах с недостаточным содержанием витамина B6. Добавление глицина снижало токсический эффект метионина. В то же время увеличение белка в диете всегда давало защитный эффект в отношении токсического действия отдельных аминокислот.
| Группа | Пол | Возраст в годах | Белки (в том числе животные) | Жиры (в том числе растительные) | Углеводы |
|---|---|---|---|---|---|
| Дети | 1/2-11 1-11/2 11/2-2 3-4 5-6 7-10 11-13 |
25(20-25) 48(36) 53(40) 63(44) 72(47) 80(48) 96(58) |
25 48 53(5) 63(8) 72(11) 80(15) 96(18) |
113 160 192 233 252 324 382 |
|
| Подростки | М. Ж. |
14-17 14-17 |
106(64) 93(56) |
106(20) 93(20) |
422 367 |
| При активных формах отдыха | М. Ж. |
18-40 40-60 60-70 18-40 40-60 60-70 |
9(6) 6(3) 5(3) 6(3) 5(3) 3(2) |
9(3) 6(2) 5(1,5) 6(2) 5(1,5) 3(1) |
44 29 20 29 20 15 |
| При проживании в городах и селах с менее развитым коммунальным обслуживанием | М. Ж. |
18-60 60-70 18-60 60-70 |
6(3) 5(3) 6(3) 3(2) |
6(2) 5(1,5) 6(2) 3(1) |
29 20 29 15 |
(За исключением белков, жиров и углеводов материнского молока.)
Как показатель пищевой ценности белков используют коэффициент белковой эффективности (КБЭ). В практической работе принято определять КБЭ при определенном уровне белка в диете, чаще всего при 10%.
Некоторые исследователи считают, что максимальная величина биологической ценности получается при уровне белка в диете, покрывающем эндогенную потребность человека, т. е. от 15 до 33 г белка в сутки. Получаемые в этом случае величины биологической ценности предложено называть абсолютными (АБЦ).
Предложен также метод определения пищевой ценности белков по усвоению отдельных аминокислот и их балансу. Определяются обычно незаменимые аминокислоты в крови через различное время после приема пищи.
Пищевая ценность белков определяется также их перевариваемостью протеазами желудочно-кишечного тракта, в который выделяется значительное количество протеиназ и пептидаз, обеспечивающих распад всех белков химуса до свободных аминокислот, которые сравнительно быстро всасываются в кишечнике. Протеазы желудочно-кишечного тракта обладают высокой удельной активностью и вырабатываются пищеварительными железами в больших количествах, чем другие ферменты. В панкреатическом соке крупного рогатого скота на долю протеаз приходится 72% всего ферментного состава. И это важно, так как они лизируют белок не только пищи, но и всех других пищеварительных ферментов, а также подвергаются самоперевариванию, сводя до минимума потери эндогенных белков. Уже давно известно, что пищеварительные железы адаптируются к составу пищи: при изменении соотношения белков, жиров и углеводов в пище адекватно изменяется состав панкреатического сока. Особенно хорошо выявляется адаптационная зависимость у таких ферментов, как энтерокиназа, щелочная фосфатаза в кишечном соке, липаза и протеазы панкреатического сока. Перевариваемость пищевых белков зависит от присутствия в некоторых продуктах питания особых белков-ингибиторов протеолитических ферментов, а также от условий кулинарной обработки пищевых продуктов.
| Аминокислота | По Блоку | По Роузу | По Шошу | По данным ФАО( |
|
|---|---|---|---|---|---|
| минимальные | оптимальные | мг/день | на 1 кг веса | ||
| г/день | |||||
| Триптофан | 1,0-1,25 | 0,25 | 1,2 | 10 | 1,0 |
| Треонин | 3,0-5,0 | 0,50 | 3,6 | 30 | 2,0 |
| Лизин | 5-6 | 0,80 | 6,0 | 50 | 2,9 |
| Метионин | 3,5-4,0 | 1,10 | 3,6 | 40 | 1,5 |
| Цистин | - | - | - | 50 | 1,4 |
| Фенилаланин | 4,0-4,5 | 1,10 | 4,2 | 40 | 2,0 |
| Тирозин | - | - | - | 60 | 2,0 |
| Валин | 4,0-4,5 | 0,80 | 4,2 | 45 | 2,9 |
| Лейцин | 10,0 | 1,10 | 5,4 | 60 | 3,4 |
| Изолейцин | 3,0-3,5 | 0,70 | 3,0 | 40 | 2,9 |
| Гистидин | 2,0 | - | 2,4 | 25 | - |
| Аргинин | 4,5 | - | 1,2 | 60 | - |
Ингибиторы протеаз в значительном количестве содержатся в бобовых и злаковых растениях, а также в клубнях картофеля. Они угнетают протеолитическую активность трипсина и химотрипсина, осуществляющих свое действие в тонкой кишке. Многие из ингибиторов протеаз обладают высокой устойчивостью к различного рода воздействиям. Они не разрушаются при кратковременном кипячении и резистентны к протеолитическому действию пепсина.
Инактивации ингибиторов способствует щелочная среда. Автоклавирование семян сои увеличивает биологическую активность белков с 59 до 75%. В опытах с фасолью было установлено, что разрушение ингибиторов приводит к увеличению биологической ценности белков фасоли на 20-23%. Большое значение в перевариваемости белков имеет тепловая обработка продуктов питания. Глобулярные белки при этом подвергаются денатурационным изменениям, которые приводят к значительному увеличению скорости их расщепления протеолитическими ферментами. Кулинарная обработка значительно увеличивает перевариваемость, а вместе с ней и биологическую ценность белков. Однако казенны молока не нуждаются в такой подготовке, они самой природой приспособлены служить лучшим поставщиком аминокислот для растущего организма млекопитающих, что ставит эти белки на одно из первых мест по пищевой ценности.
Всасывание аминокислот. В крови животных и человека после употребления в пищу белка довольно быстро увеличивается содержание свободных аминокислот. Это нарастание отображает аминокислотный состав съеденного белка. Система пищеварительных протеаз обладает потенциальной способностью расщеплять все пищевые белки до свободных аминокислот. Можно поэтому думать, что пищевые белки всасываются в тонкой кишке в виде свободных аминокислот, которые могут проникать через клеточные мембраны, путем простой диффузии и активного всасывания. В результате активного процесса идет накопление свободных аминокислот сначала в крови, а затем и в тканях. Концентрации свободных аминокислот в тканях значительно выше, чем в крови. Установлена взаимосвязь процесса всасывания аминокислот с тканевым дыханием. Возможно, что активное всасывание аминокислот связано с их фосфорилированием и участием производных витамина B6.
Проявления недостатка белка в питании. Дефицит белка в питании в первую очередь проявляется в снижении его содержания в тканях организма, особенно в печени, а затем и в плазме. Уровень альбумина плазмы наиболее четко отражает белковую недостаточность, уровень же глобулинов, наоборот, может оставаться нормальным и даже увеличиваться.
Примером патологии, обусловленной белковой недостаточностью, служат такие заболевания, как квашиоркор, детский маразм, или кахектическая форма белковой недостаточности. Эти заболевания распространены в колониальных и зависимых странах среди детского населения. Квашиоркор связан с качественным и количественным недостатком белка в питании. Типичными симптомами являются отечность, остановка роста и изменения кожного покрова (гиперпигментация и гиперкератоз, шелушение кожи), нарушение процессов костеобразования (остеопороз), мышечная слабость, потеря аппетита, полиурия и поносы. При квашиоркоре обнаруживаются глубокие изменения в поджелудочной железе и печени. Особенно быстро реагирует на белковую недостаточность поджелудочная железа. Изменения в поджелудочной железе уже в начальной стадии белковой недостаточности приводят к резкому нарушению экскреторной функции этого органа. В печени происходит жировое перерождение. В печени и поджелудочной железе при белковой недостаточности, а также при нарушении баланса незаменимых аминокислот наблюдаются заметные изменения ферментного спектра. Особенно сильно уменьшается активность метилбутириназы и трибутириназы, т. е. ферментов, действие которых в какой-то степени может быть связано с мобилизацией жира из печени. Снижение их активности способствует отложению жира в печени. Снижается активность этих ферментов и в сыворотке крови. Увеличивается активность альдолазы 1-фруктозомонофосфата в крови - характерного печеночного фермента. Следовательно, на возникновение холинобелковой недостаточности организм отвечает специфическим изменением ферментных соотношений как в печени, так и в крови.
При детском маразме, или кахектической форме белковой не-достаточности, наблюдается сильнейшее исхудание и полное отсутствие отечности. Эта форма алиментарной недостаточности связана с дефицитом белка в питании и с общей нехваткой калорий. Кахектическая форма пищевой недостаточности чаще встречается у детей на 1-2-м году жизни, а квашиоркор наибольшего развития достигает в возрасте 3-4 лет. Дефицит веса у детей при квашиоркоре составляет 20-25%, а при маразме - 50-70%.
Белковая недостаточность имеет огромное значение и в патогенезе алиментарной дистрофии, а также ряда заболеваний, связанных с нарушением всасывания при повышенной потере белка (хронический энтерит, нефротический синдром и др.).
|
ПОИСК:
|
© Анна Козлова подборка материалов; Алексей Злыгостев оформление, разработка ПО 2001–2019
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'