Синдром Штейна-Левенталя (гиперандрогенная дисфункция яичников, синдром поликистозных яичников, склерокистоз яичников)
В 1935 г. американские ученые Н. Штейн и М. Левенталь описали синдром, включающий гирсутизм, аменорею, ожирение на фоне двустороннего поликистоза яичников.
Этиология и патогенез. Данному синдрому посвящено множество публикаций, но его патогенез остается неясным. Исследования последних лет выявили большую гетерогенность гормональных и морфологических дефектов на различных уровнях: церебральном, гипоталамо-гипофизарном, овариальном и надпочечниковом.
Трудность выделения первичного патологического звена в развитии данного синдрома привела к возникновению множества теорий, объясняющих патогенез заболевания. Ни одна из них в настоящее время не считается исчерпывающей.
Не вызывает сомнений, что центральным звеном в патогенезе синдрома Штейна-Левенталя является гиперплазия стероидпродуцирующих элементов яичников, секретирующих андрогены в повышенных количествах. Высокий уровень внутри-овариальных андрогенов ведет к нарушению нормального созревания фолликула, к быстрой кистозной атрезии фолликулов.
В периферической крови часть овариальных андрогенов (главным образом андростендион) трансформируется в активный тестостерон, чем объясняется развитие гирсутизма и других симптомов вирилизации при данном синдроме. Значительно повышено содержание свободной, не связанной с белками фракции тестостерона. Это обусловлено снижением концентрации глобулина, связывающего половые гормоны. Синтез этого белка, как уже указывалось, резко снижается при избытке андрогенов.
Кроме того, высокий уровень овариальных андрогенов ведет к повышению концентрации эстрогенов, главным образом эстрона - продукта периферического превращения андростендиона. Постоянное ациклическое воздействие эстрогенов на гипоталамо-гипофизарную систему приводит к повышению чувствительности гипофиза к стимулирующему воздействию люлиберина (ГТ-РГ). Секреция ЛГ становится неадекватной, ациклической, повышается соотношение ЛГ/ФСГ.
Длительная неадекватная лютеинизирующая стимуляция яичников вызывает гиперплазию стероидпродуцирующих овариальных элементов, гиперпродукцию андрогенов. Относительная недостаточность ФСГ приводит к снижению ароматазной активности гранулезы, уменьшая выработку эстрогенов. Внутри- овариальная гиперандрогения и гипоэстрогения делают невозможным нормальное созревание фолликулов, ускоряя их кистозную атрезию. Патогенетический круг замыкается. Остается невыясненным пусковой момент, заставляющий изменять, нарушать взаимодействие основных звеньев в цепи гормональной регуляции физиологического менструального цикла. В работах последних лет доказана сохранная способность гипоталамо-гипофизарной системы адекватно реагировать на половые стероиды в системе отрицательной и положительной обратной связи [Зеленецкая В. С. и др., 1978; Зеленецкая В. С., Добрачева А. Д,. 1979; Rebar R. et al., 1976; Baird D., 1977]. Исследование овариальной ткани in vitro позволяет также исключить первичный ферментный дефект ароматазной активности яичников как причину заболевания [Erickson G., 1979]. Интересна в этом плане работа А. Д. Добрачевой с соавт. (1981), выявившая изменения взаимодействия ЛГ с рецепторами стероидпродуцирующих структур в яичниках женщин с синдромом Штейна-Левенталя.
Множество работ посвящено участию надпочечников в генезе синдрома Штейна-Левенталя. Предполагают, что первичной причиной гиперандрогении являются надпочечники, имеющие скрытый ферментный дефект биосинтеза стероидов (дефект 21-гидроксилазы, 3-α-в-дегидрогеназы, 11-β-гидроксилазы). Эта точка зрения имеет в настоящее время достаточно сторонников [Rivarola M., 1967; Kirshner M. et al., 1971; Judd H. et al., 1977; Lachelin J. et al., 1979], хотя до сих пор нет ни одной работы? доказывающей первичность адреналовых нарушений в патогенезе синдрома Штейна-Левенталя (рис. 58).
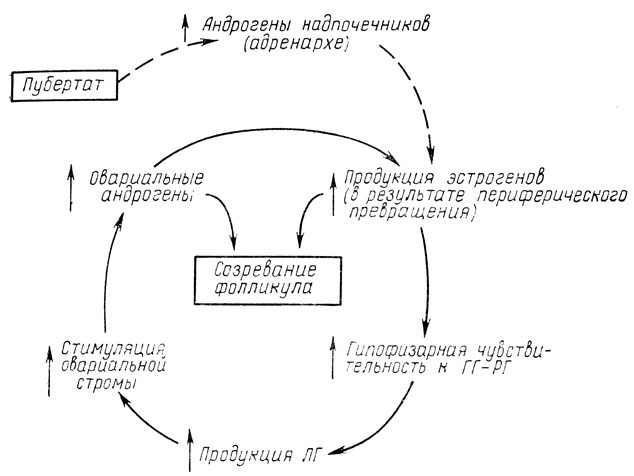
Рис. 58. Схема возможного патогенеза гиперандрогении и ановуляции при синдроме Штейна - Левенталя
Наиболее увлекательна для педиатра гипотеза, предложенная C. Jen с соавт. в 1976 г. и трактующая пусковую роль усиленного адренархе в патогенезе синдрома Штейна-Левенталя. Эта гипотеза основывается прежде всего на том, что начало заболевания, как правило, совпадает с возрастом раннего пубертата, которому предшествует стадия адренархе - повышенной секреции андрогенов надпочечниками. Патологическое, усиленное адренархе, вызванное либо скрытым ферментным дефектом синтеза кортизола, либо гиперстимуляцией андрогенпродуцирующих структур надпочечника неизвестным гипофизарным фактором, приводит к значительному повышению концентрации адреналовых андрогенов в крови, их трансформации в эстрогены, которые в свою очередь ведут к повышению уровня ЛГ, изменяющего овариальную функцию. Подобная гипотеза требует дальнейших тщательных исследований.
Клиническая картина. Начало заболевания, как правило, совпадает с возрастом менархе и соответствует 12-13 годам. Наиболее постоянным симптомом заболевания, вызывающим первые жалобы у больной, является гирсутизм - рост волос по мужскому типу. Выраженность гирсутизма может быть различной: от легких форм (оволосение над верхней губой, вокруг ареол, по белой линии живота) до выраженного генерализованного гирсутизма с обильным ростом волос на лице, груди, животе, бедрах. У большинства больных гирсутизм сочетается с другими андрогензависимыми изменениями кожи: обильные acne vulgaris, усиление деятельности сальных желез на волосистой части головы, повышение потоотделения. Других признаков вирилизации - изменения голоса, развития скелетной мускулатуры, гипертрофии клитора - при синдроме Штейна-Левенталя, как правило, не наблюдается.
Явления гирсутизма сопровождаются нарушениями менструального цикла от первичной аменореи до опсоменореи (редкие менструации). Довольно часто в первые годы заболевания менструации нормальные, хотя циклы ановуляторные, затем менструальный цикл удлиняется и становится нерегулярным, а в дальнейшем переходит во вторичную аменорею.
Более половины больных с синдромом Штейна-Левенталя имеют избыточную массу тела. Этот симптом нередко предшествует другим проявлениям заболевания. Жировая ткань служит органом-мишенью для эстрогенов и возможно, что длительная периферическая гиперэстрогения при синдроме Штейна-Левенталя приводит к усиленному развитию жировой ткани.
Патогномоничным симптомом заболевания является двустороннее поликистозное увеличение яичников с характерной гистологической картиной. Белочная оболочка утолщена и склерозирована, много фиброзно и кистозно атрезированных фолликулов, окруженных гиперплазированной и гипертрофированной тканью theca interna. Межуточная ткань гиперплазирована, с очагами атрофических изменений [Бронштейн М. Э., Заратьянц В. Б., 1971].
Диагностика и дифференциальная диагностика. Диагностика синдрома Штейна-Левенталя основывается прежде всего на данных анамнеза. Пубертатный возраст начала заболевания, развитие основных симптомов после менархе, нерезкая вирилизация при постепенных нарушениях менструального цикла, избыточная масса тела больной из-за избытка жировой ткани могут свидетельствовать в пользу синдрома Штейна-Левенталя. Патогномоничным симптомом является двустороннее увеличение яичников, определенное методом пневмопельвиографии или ультразвукового сканирования.
Гормональные исследования с определением экскреции 17-КС в диагностике данного синдрома малоинформативны, так как отражают прежде всего уровень адреналовых андрогенов,, а при синдроме Штейна-Левенталя он может не отличаться от нормы. Более информативно определение уровня тестостерона в сыворотке крови, но зачастую выраженность вирилизации не соответствует концентрации тестостерона в периферической крови, поскольку тестостерон при данном заболевании является лишь продуктом .периферического превращения овариальных андрогенов (андростендиона).
Большую ценность для диагностики имеют функциональные пробы, позволяющие подтвердить овариальное происхождение гиперандрогении при этом заболевании. Наибольшее распространение получила разработаннная в ИЭЭиХГ АМН СССР А. А. Пищулиным и И. В. Голубевой сочетанная проба с декса- метазоном и ХГ. Дексаметазон назначают с целью подавления возможной надпочечниковой гиперандрогении, стимуляция ХГ на этом фоне позволяет подтвердить овариальное происхождение андрогенов. Проба основана на определении суточной экскреции 17-КС и уровня тестостерона в сыворотке крови. Дексаметазон назначают по 4 мг/сут в течение 4-8 дней, в последние Два дня приема дексаметазона внутримышечно вводят ХГ па 1500 ЕД. Суточную мочу для определения 17-КС или кровь для определения тестостерона берут перед пробой, на 2-й и 4-й день пробы. При синдроме Штейна-Левенталя снижается уровень тестостерона (или 17-КС) на фоне приема дексаметазона не более чем на 25 % и значительно повышаются эти показатели после стимуляции ХГ.
Следует проводить дифференциальную диагностику синдрома Штейна-Левенталя с врожденной дисфункцией коры надпочечников, вирилизирующими опухолями надпочечников и яичников. Опорными пунктами в диагностике считают функциональную пробу с дексаметазоном и ХГ и рентгенологическое или ультразвуковое исследование яичников и надпочечников.
Лечение синдрома Штейна-Левенталя преследует две основные цели: нормализацию менструального цикла и ликвидацию гирсутизма. Отсутствие четких представлений о патогенезе заболевания затрудняет выбор адекватной патогенетической терапии. Существующие методы лечения обычно направлены лишь на одно из предполагаемых звеньев патогенеза, что делает их недостаточно эффективными.
Наиболее известна и применяется еще с 1906 г. клиновидная резекция овариальной ткани. Механизм терапевтического воздействия клиновидной резекции окончательно не выявлен. Возможно, что быстрая ликвидиация значительной части яичника ведет к резкому снижению уровня внутриовариальных и периферических андрогенов. Это нормализует процессы созревания фолликулов и гипофизарно-овариальные взаимоотношения. Эффективность клиновидной резекции (восстановление овуляторных менструальных циклов), по данным А. А. Пищулина, составляет 69,3%. Однако многие авторы указывают на временный эффект этого лечебного воздействия.
Спорным остается и вопрос о времени проведения операции. Ранее существовало мнение о целесообразности клиновидной резекции лишь у взрослых женщин с целью восстановления детородной функции. В настоящее время принята активная хирургическая тактика в более раннем возрасте, в первые годы заболевания, когда морфологические изменения яичников не выражены слишком резко, сохранен фолликулярный аппарат и возможна нормализация гипофизарно-овариальных взаимоотношений.
Достижение нормальных гипофизарно-овариальных взаимоотношений при синдроме Штейна-Левенталя возможно применением медикаментозных средств, в частности кломифена. Этот препарат имеет свойства слабого эстрогена и способен стимулировать секрецию ФСГ и ЛГ, тем самым нормализуя процессы стероидогенеза в яичниках, способствуя нормальному созреванию фолликула с последующей овуляцией. Препарат назначают с 5-го по 9-й день цикла в дозе 50-100 мг.
Не во всех случаях заболевания следует начинать лечение с кломифена, так как он может привести к гиперстимуляции яичников с последующей апоплексией. Если размеры яичников значительно превышают норму, то предпочтительнее предварительно провести 2-3 курса лечения синтетическими прогестинами (нон-овлоном, инфекундином) по 1 таблетке с 5-го по 26-й день цикла. Антигонадотропная активность этих препаратов снижает уровень собственного ЛГ и тем самым подавляет гормонообразовательную деятельность яичника. Снижение внутриовариального уровня андрогенов способствует нормальному созреванию фолликулов, и последующее назначение кломифена нормализует двухфазный овуляторный цикл. Так как основная цель назначения кломифена - достижение двухфазного овуляторного цикла, его применяют главным образом у взрослых женщин с целью восстановления фертильности.
Наилучшим способом лечения синдрома Штейна-Левенталя у девушек-подростков в настоящее время следует признать применение ципротерона ацетата (ЦПА) - антиандрогенного препарата стероидной природы с прогестагенной активностью. Этот препарат оказывает мощное антигонадотропное действие, препятствуя неадекватной лютеинизирующей стимуляции стероидогенеза в яичниках. Кроме того, его антиандрогенное действие, обусловленное конкуренцией с эндогенными андрогенами на уровне цитоплазматических рецепторов в клетке, в значительной степени подавляет развитие гирсутизма и другие кожные проявления андрогенизации. Препарат назначают в дозе 50- 100 мг/сут с 5-го по 14-й день цикла. Назначение препарата только в первой половине цикла объясняется его высокой кумулятивной способностью. Кроме того, прогестагенная активность ЦПА может привести к выраженным пролиферативным изменениям эндометрия с последующими метроррагиями. Обычна ЦПА сочетают с эстрогенным препаратом - микрофоллином в дозе 0,05 мг с 5-го по 26-й день цикла. Менструальноподобная реакция возникает, как правило, на 3-7-е сутки после последнего приема микрофоллина.
В легких случаях заболевания с небольшими проявлениями гирсутизма ЦПА назначают в низких дозах. В подобных случаях удобен комбинированный препарат "Diane", содержащий 2 мг ЦПА и 50 мг этинилэстрадиола. Препарат принимают с 5-го по 26-й день цикла, менструальноподобная реакция отмечается на 2-4-е сутки после приема последней таблетки.
Эффективность ЦПА следует оценивать не ранее чем через 10-12 мее непрерывного лечения. По данным Джеффкоута, успешность терапии зависит от продолжительности заболевания: чем оно длительнее, тем меньше регресс гирсутизма. Подобная точка зрения оправдывает назначение ЦПА у девочек в начале заболевания.
В литературе в настоящее время обсуждается возможная роль надпочечниковых андрогенов в патогенезе синдрома Штейна-Левенталя, и многие авторы предлагают в качестве патогенетической терапии использовать препараты глюкокортикоидов - преднизолон, дексаметазон [Мануйлова И. А. и др., 1973; Abraham G., 1976; Rodriguez-Rigau F. et al., 1979]. По нашему мнению, в связи с возможными серьезными последствиями терапия глюкокортикоидами должна проводиться обоснованно, при получении неопровержимых доказательств надпочечникового генеза заболевания.
В последние годы появились сообщения о применении препаратов тиреоидных гормонов в лечении синдрома Штейна-Левенталя [Szamatowicz М., 1983]. Принцип терапии основан на способности тиреоидных гормонов повышать концентрацию ПГСГ. Это приводит к снижению уровня свободного тестостерона в плазме, который обеспечивает основные андрогензависимые периферические проявления заболевания. Естественно, основная причина - гиперпродукция андрогенов - сохраняется, и лечение тиреоидными гормонами необходимо проводить в комплексе с другими методами терапии, в частности, в сочетании с ЦПА.
|
ПОИСК:
|
© Анна Козлова подборка материалов; Алексей Злыгостев оформление, разработка ПО 2001–2019
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'