Иммунитет - трансплантация - рак
Иммунитет - трансплантация - рак
Ни одна вещь не возникает беспричинно, но все возникает на какой-нибудь основе или в силу необходимости.
Пересадка почки - вчера мечта, сегодня - будни хирургии. В. П. Демихов - зачинатель эры пересадки сердца, а К. Барнард ее удачливый продолжатель в клинике, 77. Мед авар проводит чистые опыты на чистолинейных мышах. Иммунологические барьеры на пути восстановительной медицины. Экскурс иммунолога в онкологию. Древние верили - "Per aspera ad astra" - "через трудности к звездам".
Возможны ли в наши дни революции в медицине? Отвечая на вопрос, с чего начинаются научные революции, известный науковед Т. Кун писал, что во многом их причиной является то, "что существующая парадигма перестает адекватно функционировать при исследовании того аспекта природы, к которому сама эта парадигма раньше проложила путь" (Кун Т. Структура научных революций. М., Прогресс, 1977, с. 107 и 128). У этого же автора мы находим справедливое замечание о том, что "в каждом случае новая теория возникла только после резко выраженных неудач в деятельности по нормальному решению проблемы.
В середине 60-х годов казалось, что революционные события назревают в области восстановительной хирургии, называемой трансплантацией органов. Судите сами, в 1958 г. в США хирургом Хьюмом была выполнена первая успешная пересадка почки от генетически отличающегося донора больному с полностью бездействующими собственными почками. В медицине известен парадокс, в силу которого первый опыт часто оказывается успешным, но повторить его в дальнейшем бывает делом нелегким (Строго говоря, первую пересадку почки человеку в мире сделал киевский хирург Ю. Ю. Вороной в 1934 г. Девушке 26 лет с ртутным отравлением, вызвавшим острую почечную недостаточность, на бедро была подсажена почка от трупа. После соединения кровеносных сосудов больной с группой крови 0 и пересаженной почки от донора группы крови В трансплантат начал выделять мочу. Больная умерла через 48 часов после операции от того, что ей было сделано переливание крови группы А. Медицина того времени еще не знала причин отторжения чужеродных тканей и законов соблюдения совместимости крови и тканей при пересадках. Указанная операция, являвшаяся для своего времени редкой по смелости и техническому мастерству, еще не открыла эры пересадки органов).
По каким-то до сих пор неясным причинам у оперированного больного, а им оказался врач-терапевт Дж. У., генетически отличающаяся почка проработала неожиданно долго - 175 дней. В данном случае после операции хирурги не применяли каких-либо препаратов, подавляющих реакцию отторжения (иммунодепрессантов). В последующем для ослабления иммунологических реакций, развивающихся на антигены трансплантата, стали использовать рентгеновское облучение реципиента, а начиная с 1961 г. все чаще стали назначать синтезированные к тому времени химические препараты, приостанавливающие размножение лимфоцитов (цитостатики). Целесообразность лекарственного подавления иммунитета при трансплантациях предсказали англичане Дамешек и Шварц, а в эксперименте на животных их действие проверил английский врач- экспериментатор Р. А. Калн. Хирурги - специалисты по пересадке органов стали даже шутливо называть себя "иммунохирургами", как бы подчеркивая этим иммунологическую перестройку своего сознания.
Иммунодепрессивная терапия оказывалась ненужной лишь при пересадке почки между однояйцевыми близнецами, являющимися полными генетическими копиями друг друга. Первая такая успешная пересадка была сделана в 1954 г. в США. Следует, однако, сказать, что через несколько лет после пересадки почки и у таких реципиентов в ряде случаев развивалась смертельная болезнь пересаженного органа, что не было связано с иммунологической реакцией, но отражало некоторые общие трудности замены своего органа донорским, о чем речь пойдет ниже.
Первые годы эры пересадки органов (по преимуществу почки) были ознаменованы стремлением хирургов использовать в качестве донора близкого родственника больного - мать, отца, сестру, брата, так как при этом возрастала вероятность частичного совпадения антигенов тканевой совместимости. Однако постепенно стало очевидным, что нет жесткой необходимости подвергать живого донора-добровольца опасности, пусть даже и незначительной (а парные органы незримо связаны друг с другом организменными рефлексами); все чаще для изъятия почки, пригодной для клинической пересадки, стали использовать умерших людей. Несмотря на то, что система трансплантационных антигенов у людей была открыта несколько позже, уже с середины 60-х годов в разных клиниках мира стали использовать некоторые косвенные пробы для подбора наиболее подходящего по тканевой совместимости донора. Улучшились и методы послеоперационного лечения оперированных больных, из иммунодепрессивных препаратов лучше других зарекомендовало себя сочетание антиметаболита имурана с гормоном преднизолоном.
Для иллюстрации "трансплантационной лихорадки", которая охватила медицинский мир, приведем несколько цифр. К 1963 г. в мире было сделано 244 операции по пересадке почки, к марту 1964 г. - 374, к марту 1965 г. - 719, к январю 1967 г. - 1200, к январю 1968 г. - 1741, к январю 1971 г. - 4683, а к 1978 г. - более 15 ООО операций. Поистине разительными были успехи пересадки этого органа, результаты исходов операций по пересаде почки за сравнительно короткий срок претерпели такие изменения, которых не знала никакая другая область медицины. В 1963 г. из 244 оперированных больных больше одного года жило только 26 человек, из которых лишь у 8 почка была пересажена от генетически отличающегося донора (не однояйцевого близнеца) и ни в одном случае от трупа. В 1965 г. больше года жил уже 121 больной, причем особенно важно, что в 98 случаях почка им была пересажена от генетически иного донора. В 1967 г. в мире жило 282 человека с донорской почкой, из которых 168 получили орган от трупа (9 человек жили более двух лет). В 1971 г. максимальная продолжительность жизни больного с пересаженной почкой составляла 10, а в 1978 г. - 15 лет.
Еще несколько лет назад у хирургов в ходу был шутливый диапозитив, на котором был изображен ученый над обрывом огромной скалы со скромными рудиментами крыльев на руках. Надпись гласила: "Эта работа, конечно, не по мне, но кто-то все-таки должен начать!" Дело было начато, а его последствия обещали революцию в хирургии. Сбывалась "золотая мечта", когда, казалось, найдены запасные части для человеческого организма, а остальное в прямом смысле - дело техники (хирургической).
Несколько слов о том, почему именно почка стала первым органом, который воодушевил трансплантологов на клинические испытания. Во-первых, это парный орган, который можно взять из организма донора, не нанося ему непоправимого ущерба. Во-вторых, потому, что именно почка стала первой экспериментальной моделью, на которой у животных отрабатывался сосудистый шов и проверялась функция органа, перенесенного из одного участка тела в другой и из одного тела в иной организм. Так, еще в 1905 г. 32-летний доктор медицины Алексис Каррель, работавший в США, опубликовал результаты успешной пересадки у собаки собственной ее почки на шею, где та продолжала выделять мочу. Вслед за этим Каррель удалил у животного собственные почки и пересадил ему почку от другой собаки. Уже через 5 дней он послал в журнал другую статью, которая начиналась словами "Успешная пересадка...", но на 10-й день единственная оперированная собака скончалась... В 1910 г. неудовлетворенный Каррель, понявший, что секреты неуспеха объясняются не хирургической техникой, занялся иными вопросами экспериментальной медицины, но пересадку почки на животных стали исследовать другие искатели. Наконец, клинический выход пересадки почки был подготовлен и тем, что инженерами и биологами был сконструирован диализатор - искусственная почка (впервые использованная в клинике для лечения почечной недостаточности в 1950 г.), позволяющий очистить на время кровь от белковых шлаков, а за отпущенный срок подобрать подходящего донора. Сеанс подключения больного к аппарату искусственной почки называется гемодиализом, иногда в ожидании пересадки его приходится проводить не раз и не десять, а больше. Первая пересадка почки в клинике нашей страны была сделана академиком Б. В. Петровским в 1965 г., за что позже ему совместно с Н. А. Лопаткиным, В. И. Шумаковым и Г. М. Соловьевым была присуждена Государственная премия.
Вслед за пересадкой почки в клинике пробил час пересадки сердца. Трудным и долгим был путь хирурга к операциям на этом органе. Еще в прошлом веке все попытки зашить раненое сердце кончались смертью больных. Лишь в 1896 г. немецкий хирург Рен впервые удачно наложил на сердце шелковые швы. В 1905 г. русский врач В. Г. Мантейфель первым извлек из сердца пулю, больная выздоровела. В 1944 г. американец А. Блелок выполнил первую успешную операцию по устранению у ребенка врожденного порока сердца. При этом даже его коллеги по клинике отказались ему ассистировать. Вместе с Блелоком к операционному столу стала педиатр Елена Тауссиг, продумавшая анатомическое решение задачи. Операция так и вошла в учебники под названием "Операция Блелока-Тауссиг". В Советском Союзе операции на сердце были начаты школой академика А. Н. Бакулева в 1948 г.
Длительные операции на выключенном из кровообращения, как говорят хирурги - открытом, сердце стали возможными также благодаря технической подмоге - аппарату искусственного кровообращения - сокращенно АПК. Аппарат на нужный срок берет на себя роль нагнетающего насоса, в то время как руки хирургов ювелирно устраняют внутрисердечные неполадки. Автором метода искусственного кровообращения явился изобретатель и доктор медицины С. С. Брюхоненко, который еще в 1924 г. сконструировал свой "автожектор" - первый прообраз АИКа. Именно с помощью автожектора в 1928 г. на Всесоюзном съезде физиологов в Москве был продемонстрирован удивительный опыт: на блюде, отделенная от туловища и лишь связанная резиновыми трубочками с аппаратом, лежала голова собаки, которая моргала, скалила зубы и даже облизывалась...
В 1949 г. в тесных и мало для того приспособленных лабораторных комнатках проблему пересадки сердца стал изучать фанатически упорный экспериментатор, доктор В. П. Демихов. В опытах на собаках он разработал множество моделей пересадки сердца - ив едином комплексе с легкими, и в виде второго дополнительного к своему сердца. Собаки жили три, шесть, десять дней. Животных для опытов не хватало, тогда экспериментатор с помощниками выходили на московские улицы и сами ловили их во дворах. В 1962 г. медицинские журналы всего мира обошли фотографии пса по кличке Гришка, у которого сердце другой собаки, пересаженное Демиховым, билось в груди 141 день. В числе других иностранных гостей, а их много прошло через демиховскую лабораторию, результаты и схемы опытов тщательно изучал и молодой хирург из далекой Южной Африки Кристиан Нейтлинг Барнард.
В начале декабря 1967 г. в хирургической клинике Нью- Йорка профессор Андриан Кантровиц готовился к пересадке сердца человеку. 9-летнему ребенку со сложным врожденным пороком сердца грозила смерть, Кантровиц искал "подходящее" детское сердце. Кантровиц замешкался, пересадку сердца он сделал 5 декабря (она оказалась неудачной, ребенок умер через несколько часов после нее), но первооткрывателем эры пересадки сердца стал уже другой хирург.
3 декабря 1967 г. в клинике Хрооте-Схюр в г. Кейптауне Кристиан Барнард пересадил умирающему от инфаркта миокарда 56-летнему Луи Вашканскому сердце погибшей в автокатастрофе 25-летней Дениз Дарваль. Операция происходила ночью. Отец погибшей дал свое согласие на пересадку ее сердца. Иммунолог клиники Хрооте-Схюр определил, что по группам крови и тканей серьезных препятствий для пересадки нет. Следующим днем Барнард, ранее известный лишь как отец 17-летней чемпионки мира по водным лыжам, неожиданно для самого себя стал всесветной знаменитостью. Через 12 суток после операции Вашканский в интервью журналистам заявил, что он счастлив. Через 17 суток он погиб от послеоперационного (и связанного с трансплантацией) воспаления легких.
2 января 1968 г. Барнард решился на вторую свою пересадку сердца. На этот раз реципиентом стал 58-летний дантист Филип Блайберг. "Команда Барнарда", включавшая около 20 врачей, пересадила ему сердце молодого метиса Клайва Хаупта, погибшего на пляже от солнечного удара. Перед операцией Блайберга подвергли рентгеновскому облучению, после операции ему назначили иммунодепрессивные препараты и антибиотики для профилактики воспаления легких. Несмотря на это, в первые месяцы больной перенес несколько приступов отторжения донорского сердца, когда жизнь его висела на волоске. Врачи смело шли на увеличение дозы иммунодепрессоров. После второго криза отторжения, когда Барнард готовился повторить Блайбергу пересадку сердца от другого донора, дело спасла лишь специальная сыворотка против иммунных лимфоцитов (антилимфоцитарная сыворотка АЛС). Триумф для хирургов обернулся терзаниями для иммунологов...
В больнице и позже дома Блайбергу были созданы специальные стерильные условия, жизнь его после пересадки больше походила на жизнь отшельника. Умер он в той же больнице, где ранее был воскрешен, прожив с донорским сердцем 19 месяцев и 15 дней. На вскрытии Блайберга молодое сердце Хаупта выглядело старым и изношенным. Патологоанатом, проводивший вскрытие, признавался, что такого дряхлого сердца он не видел за всю свою практику. И до сего времени остается неясным - есть ли смысл в пересадке сердца больным с сердечной недостаточностью вследствие атеросклероза. Впрочем, сенсационный успех первых пересадок сердца породил не только эту проблему...
* * *
Прежде чем продолжить рассказ о развитии проблемы трансплантации органов, нужно сделать необходимое отступление. Ничего не возникает из ничего, побудителями научных открытий бывают либо насущные потребности практики, либо соревнование между исследователями. Что предшествовало небывалому расцвету инфекционной иммунологии в последней четверти XIX в.? Развитие техники микроскопирования и беспомощность медицины перед лицом эпидемий заразных заболеваний. Этот славный период взлёта научной иммунологии породил таких выдающихся исследователей, как Л. Пастер и И. И. Мечников, П. Эрлих и Р. Кох, Э. Беринг и Э. Ру, Р. Пфейфер и Н. Ф. Гамалея. Могучая когорта борцов с микробами всего за 10-15 лет подготовила арсенал иммунологического оружия (живые и убитые вакцины, антимикробные сыворотки), который потом с успехом использовался медициной на протяжении следующих десятилетий. Для современного врача многие грозные болезни стали историческими реликтами.
Природа так щедро одарила иммунологию талантами в конце XIX - начале XX в., что, казалось, дальше она несколько десятилетий отдыхала. Вторая волна иммунологических идей и дерзаний возникла уже после того, как на повестку дня выдвинулись потребности хирургии в пересадке тканей. Так же как первую историческую страницу иммунологии мы вправе называть инфекционной, вторая страница имеет основания считаться трансплантационной как по сути исследуемых вопросов, так и по побудительной причине.
Зоолог Питер Медавар, получивший образование в Оксфордском университете, был выходцем из Бразилии. Позже королева Великобритании пожаловала Медавару, ставшему к тому времени лауреатом Нобелевской премии, почетное звание "сэра", но во время войны Медавара занимали вопросы пересадки кожи обожженным английским летчикам. Проведя серию экспериментальных наблюдений, в 1944 г. в статье "Поведение и судьба кожных трансплантатов у кроликов" Медавар сформулировал вывод, который стал ведущим для всех последующих поисков: "Механизм, посредством которого элиминируется чужеродная кожа, принадлежит к общей категории активно приобретенных иммунных реакций".
Наблюдения были сделаны на людях, проверочные опыты - на кроликах, но можно думать, что решающие эксперименты заняли бы еще не одно десятилетие, если бы к "столу" иммунологов не подоспело бы "лакомое блюдо". В 20-х годах генетики начали выведение специальных пород мышей, которые получили название чистых, или инбредных линий (от англ. Inbreeding - родственное спаривание). Смысл его заключался в получении абсолютно тождественных в генетическом отношении организмов, таких, как однояйцевые близнецы. Техника состояла в получении потомства от однопометных братьев и сестер (в полном смысле единокровные браки, поэтому для защиты потомства принимались специальные мероприятия). Для получения чистой линии, т. е. одинакового состава хромосом у всех животных данной породы, нужно было провести около 90 последовательных скрещиваний брат - сестра, брат - сестра и т. д.
Можно себе представить, какой срок заняло бы выведение чистых линий крупных и долгоживущих лабораторных животных. Но у мышей беременность длится три недели, в трехмесячном возрасте их уже можно скрещивать, то есть получать по три поколения в году; следовательно, работа по выведению инбредных линий мышей заняла всего... 30 лет.
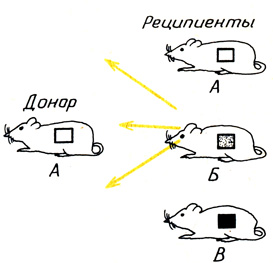
Рис. 14. Схема состояния чужеродного кожного трансплантата через 10 дней после пересадки от мыши линии А. У реципиента линии А он прижился, у реципиента линии Б (отличие по одному Н-антигену) он частично прижился, у реципиента линии В (различие по многим Н-антигенам) он разрушился
Но зато какие удивительные возможности предоставил такой мир искусственных животных иммунологам! Мыши одной линии отличались от мышей другой линии по строго вычисленным участкам хромосомы и, следовательно, антигенам - по одному, двум, четырем, по слабым и сильным антигенам тканевой совместимости, по одному только сексуальному антигену (связанному с полом, т. е. имеющемуся у самцов и отсутствующему у самок). Во второй половине 40-х годов инбредные мыши стали "Пегасом" трансплантационных иммунологов, а эксперимент, возведенный до высот математической точности, родил биологические законы трансплантации.
Оказалось, что различия по одному-единственному антигену тканевой совместимости (у мышей они определяются Н-локусом от англ. Histcompatibility) достаточно, чтобы донорская кожа не прижилась у реципиента. Однако в одних случаях такое минимальное различие ведет к разрушению трансплантата через 20-25 дней, в других - через 8-10 суток. Именно поэтому белки первого порядка, вызывающие замедленную ответную реакцию реципиента, были названы слабыми антигенами тканевой совместимости, а белки второго порядка - сильными антигенами. Законы пересадки на линейных мышах были сформулированы первыми представителями новой дисциплины - иммуногенетики П. Горером и Г. Снеллом. Они в равной мере относились как к трансплантации кожи, так и к искусственной перевивке опухолевых тканей, несущих все те же Н-антигены (рис. 14).
Первые дни после пересадки донорская кожа испытывает резкую нехватку питательных веществ и кислорода, отдельные клетки ее начинают погибать. Но уже к третьему дню в нее врастают кровеносные сосуды реципиента, и все идет как нельзя лучше. В это время донорскую кожу (ее называют аллотрансплантатом, прежнее название - гомотрансплантат) не отличить от своей собственной, хирургически удаленной, а затем пришитой на прежнее место. Но вот по тем же кровеносным сосудам и межклеточным щелям к трансплантату устремляются лимфоциты реципиента. Кровоток прекращается из-за обилия сгустков в сосудах, трансплантат отекает, иммунные лимфоциты пронизывают всю его толщу. Между пересаженной кожей и подлежащим тканевым ложем образуется мертвая зона, и вскоре сам трансплантат представляет собой скопище погибших клеток. Завершается криз отторжения, хотя сам трансплантат в виде сухой корки еще некоторое время удерживается на теле.
Принципиально такое же чередование событий имеет место и при пересадках органов, когда кровеносные сосуды реципиента соединяют с сосудами трансплантата, и срок кислородного голодания тканей донора минимален. Информация о чуждых антигенах достигает лимфоидного аппарата реципиента молниеносно, уже через сутки - двое в ближайших к месту пересадки лимфатических узлах начинается мобилизация иммунных лимфоцитов, затем в эту реакцию вовлекаются и определенные лимфатические центры. Ткани донорской почки, взятые под микроскоп, уже через 3-5 суток после пересадки оказываются нафаршированными лимфоцитами хозяина. Если не применять иммунодепрессивных препаратов, трансплантат в организме реципиентов не выживет более двух недель (хотя, как мы видели, изредка бывают парадоксальные исключения).
Ведущую роль в отторжении аллотрансплантатов играют не сывороточные антитела, как думали раньше, а иммунные лимфоциты, в частности Т-киллеры. Естественные, предсуществующие киллеры не имеют при трансплантации сколько-нибудь важного значения. Для воспитания искусственного клеточного иммунитета необходимо некоторое время, вот в течение этого срока и создается иллюзия приживления донорской ткани. Если лимфоциты-убийцы уже воспитаны, то трансплантат разрушается быстрее; такое положение легко доказывается повторной пересадкой кожи от первоначального донора. Срок приживления вторичного трансплантата вдвое короче, чем первичного. Ускоренная реакция разрушения аллотрансплантата имеет место и тогда, когда организм до пересадки встречался с антигенами, похожими на донорские, например, если реципиенту переливали кровь (а в эксперименте вводили отдельные лимфоциты) будущего донора ткани.
Однако из этого экспериментально выверенного закона трансплантации имеется ряд исключений, парадоксальность которых подарила клиническая практика. К числу таких относится следующее:
а) в части случаев повторно пересаженные больным почки (естественно, от иного донора) после гибели первого трансплантата функционируют лучше и более долгий срок;
б) после неоднократных переливаний крови больным с почечной недостаточностью (от 5 до 15 раз до операции) исходы пересадок почки лучше, чем без гемотрансфузий.
Но, если эти частные вопросы еще как-то можно объяснить, то основной парадокс трансплантации пока не имеет никакого объяснения: мы знаем, почему аллотрансплантаты не приживаются, но мы не знаем, почему они приживаются.
Выше уже говорилось, что первый реципиент доктора Хьюма, получивший почку от генетически неидентичного донора и не знакомый с иммунодепрессивной терапией, прожил после пересадки целых 175 дней. Иногда тщательный иммунологический подбор донора почки не оказывает на печальный исход пересадки никакого значения, но в других случаях реципиенты с частично совместимой почкой живут с такими же иммунодепрессивными лекарствами годами. В части случаев через несколько месяцев лекарственную терапию, убивающую иммунитет, удается отменить или значительно ослабить, но трансплантат функционирует долгие годы. Наибольший срок прожил больной, которому почку пересадили 19 (!) лет назад.
Газеты всего мира писали, что для второго пациента Барнарда Филиппа Блайберга был подобран иммунологически идеально подходящий донор. Несмотря на героические усилия всей мировой науки, Блайберг не прожил с донорским сердцем и двух лет. Но 27 ноября 1968 г. во французском городе Марселе хирург Эдмон Анри пересадил сердце 48-летнему Эммануэлю Витриа от 20-летнего донора Пьера Понсе, который был неполностью совместим с ним по трансплантационным антигенам. За прошедшее время сам Анри умер от сердечного приступа, но в 1979 г. Витриа праздновал 11-летний срок своей новой жизни с чужим сердцем. Сразу после пересадки сердца Витриа заявил осторожному хирургу: "Жизнь без шампанского и велосипеда для меня не жизнь", а на собственном юбилее он же философски изрек: "За жизнь нужно цепляться, никогда не думая о прошлом".
Показательна кривая числа сделанных пересадок сердца в клиниках мира. После громких операций Барнарда в Кейптауне с марта по август 1968 г. в мире было сделано 37 пересадок, с сентября по ноябрь того же года - 60, с декабря 1968 г. по февраль 1969 г. - 18. Всего в 1968 г. хирурги 101 раз пересаживали сердце, в 1969 г. - 33 раза, за три последующих года (1970-1973) было выполнено 50 пересадок, а в последние годы число таких операций часто не превышает 10.
* * *
С пересадкой почки дело обстоит несколько лучше. Всего за три десятилетия клинической трансплантологии в мире выполнено около 40 000 пересадок почки. Но специалисты подсчитали, что потребность в таких операциях в мире составляет как минимум 10000 за год.
Что же сдерживает дальнейший прогресс восстановительной хирургии?
Прежде всего это необходимость решения проблем, связанных с иммунологическим отторжением органа. Как ни парадоксально, но схемы лекарственного подавления иммунитета за прошедшие десятилетия существенно не изменились, по-прежнему упор делается на уже упомянутые азатиоприн и преднизолон (эти лекарства давали больным еще в 60-х годах, именно они позволили пересадке почки вместо операции отчаяния стать плановой операцией). Большие надежды возлагали специалисты на антилимфоцитарную сыворотку, однако и она не внесла коренного поворота в решение проблемы. В большинстве случаев причиной гибели оперированных больных становятся не расстройства деятельности трансплантата, а осложнения, связанные с ослаблением защитных свойств организма. Становится все более очевидным, что путь химического подавления иммунитета - эта "ампутационная терапия" - не прямая дорога к цели, а боковая колея.
"Тотальная война" против трансплантационного иммунитета, очевидно, должна уступить место налаживанию с ним вежливых "дипломатических отношений". При этом у исследователей есть два рычага, взявшись за которые они могут поменять лицо проблемы. Первым инструментом является донорский трансплантационный антиген, против которого так непримиримо воюет организм реципиента. Обработка этого антигена (то есть перевод из клеточного состояния в растворимое) и введение его реципиенту до пересадки органа с целью воспитания лимфоцитов-супрессоров (вместо непримиримых киллеров) - это ли не увлекательная задача для Каррелей и Медаваров завтрашнего дня?
Второй инструмент - это антитела, которые вырабатываются организмом на введение донорского антигена. Поскольку при пересадках организм встречается с неизвестным ему доселе чужеродным антигеном донора, то и антитела к нему - такая конструкция, которую организм вырабатывает впервые. Активный участок этих антител, нейтрализующий чужеродный антиген, называют идиотипическим (от англ. Idiotype - индивидуальный генотип). Такие идиотипические молекулы антител циркулируют как в плазме крови, так и на поверхности лимфоцитов реципиента (свободные и клеточные антитела). Если заставить сам организм реципиента вырабатывать "антиидиотипы", то есть диаметрально противоположные по специфичности иммунные продукты (а это в определенных обстоятельствах осуществимая задача), или ввести такие антиидиотипические антитела (по сути анти-антитела) извне, то можно добиться биологического самоограничения иммунитета. При этом блокированным окажется не весь защитный аппарат, а лишь тот его фронт, который воюет с трансплантатом. Клинические исключения из экспериментально выведенных законов трансплантации все более побуждают исследователей отказаться от тактики тотальной химической войны с трансплантационным иммунитетом для поиска иных биологических решений.
И, наконец, еще одно наблюдение немалой важности, озадачившее трансплантологов. После того как больные с пересаженными органами стали выписываться из хирургических стационаров домой и среди них появились своеобразные "долгожители", были учреждены Отделы по регистрации отдаленных исходов пересадки органов. Уже первые их статистические подсчеты внесли некоторую тревогу; у больных с хорошо функционирующими донорскими органами чаще возникали злокачественные новообразования.
Частота возникновения рака среди здоровой популяции (выборка лиц, ранее не бывших на онкологическом учете) составляет 0,4%, т. е. злокачественная опухоль в среднем диагносцируется у одного из 250 людей. В 1951-1971 гг. в клиниках 30 стран мира было проведено 6297 пересадок почки. У 90 реципиентов почки, как сообщает "Журнал клинической хирургии Америки" (1974, т. 54), были обнаружены злокачественные опухоли, возникающие в среднем через 30 месяцев после операции и начала проведения иммунодепрессионной терапии.
К 1972 г. число пересадок почки возросло до 9131, а пересадок сердца к тому времени было сделано 189. Злокачественные опухоли были выявлены у 98 реципиентов почки и у 2 реципиентов сердца (данные опубликованы в швейцарском сборнике "Трансплантация печени", Баден - Брюссель, 1974 г.). Таким образом, частота возникновения опухолей у реципиентов, живущих с донорскими органами, повышается в десятки раз. Журнал "Хирургия" (1978, т. 83, № 5), издаваемый в США, называет даже цифру 100. Группа авторов американского "Урологического журнала" (1979, т. 122, № 3) считает, что риск увеличивается в 30-40 раз.
Опухоли развиваются не только в отдаленные после операции сроки; из 124 больных, перенесших в 1969-1977 гг. пересадку сердца, в первые три месяца умерли 35 человек, на секционном вскрытии опухоли были найдены у 4 из них ("Британский медицинский журнал", 1979, № 6162).
Чаще после пересадки органов развиваются опухоли лимфоидной ткани - лимфомы. Это и понятно, так как принимаемые больными иммунодепрессивные лекарства нарушают нормальное размножение лимфоцитов, создают для них искусственные заторы, когда у существовавших или заново возникших опухолевых клеток появляется большая возможность выжить. Кроме того, такие препараты сами могут действовать как канцерогены (то есть как вещества, ускоряющие опухолевый рост). Средний срок развития лимфом составляет 22 месяца после пересадки. Однако еще через несколько месяцев среди оперированных больных резко возрастает число лиц, у которых диагностируются опухоли эпителиальной природы, то есть раки. Такие опухоли поражают кишечник, печень, мочевой пузырь, легкие. В ряде случаев наблюдают одновременный рост нескольких опухолей сразу. В журнале "Ланцет" (1971, т. 2) был описан больной с трансплантированной почкой, у которого опухоли возникли в семи (!) разных местах.
Некоторые онкологи закрывают глаза на угрозу, которую несет в себе трансплантация, и связывают повышение онкогенного риска только с лекарственной иммунодепрессией, да и то при некоторой предрасположенности пациентов к опухолевому росту. Один весьма эрудированный и уважаемый онколог-хирург пишет, "что в условиях иммунодепрессии у людей чаще всего развиваются злокачественные заболевания неэпителиальной природы, которые здесь оказались чувствительными к иммунотерапии" (Грицман Ю. Я. Послесловие к книге Р. Зюсса, В. Кинцеля и Дж. Скрибнера "Рак: эксперименты и гипотезы". М., Мир, 1977, с. 348). Слов нет, это угроза номер один, поскольку даже у больных, леченных иммунодепрессорными препаратами по поводу внутренних или кожных заболеваний (ревматизм, нефрит, псориаз), риск развития опухолей заметно повышается. Но, как уже было сказано, кроме лимфом, трансплантация чревата и развитием эпителиальных опухолей, только они возникают несколько позже (не через 22, а в среднем через 30 месяцев после операции) и чаще наблюдаются у лиц относительно более зрелого возраста (средний возраст лиц с послеоперационными лимфомами - 32 года, а с вторично возникшим раком - 36,5 лет) (Впервые это было описано в издании "Трансплантация сегодня". (Нью-Йорк - Лондон, 1973, т. 2, с. 943-947), а потом многократно подтверждено).
Для анализа отношения опухолей с трансплантацией важно иметь в виду и следующие наблюдения. У реципиентов, имевших опухоли до пересадки органа (рак почки, печени, гортани), в послеоперационном периоде опухоли возникали в другом месте и по своей микроскопической картине отличались от первоначальных опухолей (журнал "Канцер", 1976, т. 37, № 2). Боязнь того, что опухоль может быть занесена вместе с донорским органом, не подтвердилась, так как во всех странах доноры с малейшим подозрением на онкологическую опасность из числа таковых немедленно исключались.
Вторая группа наблюдений связана с тем, что сама по себе трансплантация чужеродной ткани может сопровождаться повышенной чувствительностью к опухолям. Шведские исследователи Стил и Сьёрген поставили такой опыт: сначала крысам пересаживали кожный аллотрансплантат, а через 7 дней им же перевивали под кожу опухоль кишечника, которая в обычных условиях прививается у крыс плохо. У неоперированных животных опухоль привилась лишь в двух случаях из 17, а среди крыс с пересаженной кожей она поразила 11 животных из 18 и росла у них необычайно быстро. Никакой иммунодепрессии в этом опыте не проводили.
Особую опасность представляет помещение нормальной ткани в ненормальное место. Так, яичники можно пересадить в селезенку, в таких "селезеночных яичниках" сначала наблюдается бурный рост клеток, а затем и опухоли яичников.
В чем разгадка этих невеселых наблюдений? Некоторые исследователи считают, что в отрезанной и вновь пришитой ткани процессы деления клеток не регулируются организмом, так как нарушены все нервные и гормональные связи, поэтому такой автономный клеточный рост может искривиться в опухолевом направлении. Но это объясняет до некоторой степени лишь механизм появления опухолевых клеток в самом трансплантате. А если опухоли растут в отдаленных от места пересадки участках тела? Видимо, сам трансплантат, как источник антигенной стимуляции в организме, также может быть подозреваем в роли побудителя опухолевой болезни. Вещества, поступающие из него, усиливают клеточное размножение и в иных тканях. Очевидно, что решающим фактором роста опухолей при пересадках органов и тканей все же является лекарственное подавление иммунитета, но нельзя сбрасывать со счетов и близость иммунодепрессорных препаратов к химическим канцерогенам, и действие хронической антигенной нагрузки на организм, и неясное пока значение реакции отторжения. Известно также, что 90% больных после пересадки почки оказываются инфицированными вирусом герпеса (эти вирусы относят к категории онкогенных), поэтому ко всему присоединяется еще и инфекционный фактор.
Значит ли все сказанное, что программа трансплантации органов зашла в тупик, из которого нет реального выхода? Нисколько! Конечно, опухоли после пересадки органов появляются чаще, чем у людей, не перенесших подобных операций. Но какие цифры мы сравниваем: 0,4% среди ранее не болевших людей и 1-2% среди реципиентов с донорским сердцем или почкой. Медики имеют право быть обеспокоенными, ведь пересадки органов в первую очередь готовились способствовать лечению именно онкологических больных, и вдруг онкологические проблемы стали на пути дальнейшего развития восстановительных операций. Но этот парадокс не имеет никакого драматического оттенка. На пересадку органов хирурги идут тогда, когда других путей для спасения больного человека уже нет, когда все иные возможности медицины исчерпаны. Во всех случаях пересадка почки, сердца, печени - это единственный шанс продлить жизнь погибающего человека. А потому - это всегда гуманный акт и даже медицинское подвижничество. И если мы сегодня знаем людей, проживших с донорским сердцем более 11 лет, с единственной донорской почкой - свыше 19 лет, с печенью другого человека - свыше 9 лет, то это великая дерзость воображения, ставшая поразительной реальностью.
Взлёты и падения - неотъемлемое качество каждой науки. Но "для того, кто привык к крушению гипотез, кто научился находить им замену в виде новых, более убедительных обобщений, даже провалившаяся теория - на серый пепел дискредитированного настоящего, а предвестник нового и более оптимистичного будущего". Так говорил в своих размышлениях об истории науки американский писатель-фантаст Айзек Азимов.
Конечно, сокращение числа операций по пересадке сердца в клинике было оправдано удручающе медленным увеличением сроков жизни оперированных пациентов. Андриан Канторович, сделавший вторую в мире пересадку сердца через 4 дня после пересадки Барнарда, отказался от таких операций после третьей же попытки. Тогда он говорил журналистам: "Я прежде всего хирург. Хирургия - это то, что я хорошо знаю. Однако при пересадке сердца возникают проблемы другого рода, проблемы совместимости тканей. Ни я, ни мои помощники так и не смогли разрешить их". Другие были упорнее. Кристиан Барнард не раз сообщал в печати, что оставляет медицинскую практику ради организаторской и писательской деятельности, но через некоторое время, продумав новую схему пересадки сердца, вновь брался за скальпель.
Хирургические задачи способствовали рождению трансплантационной иммунологии, успехи иммунологии помогли хирургии получить первые ободряющие результаты. Теперь новые иммунологические поиски - главная, если не единственная, надежда научной хирургии, переживающей вынужденную остановку в своем нелегком пути.
|
ПОИСК:
|
© Анна Козлова подборка материалов; Алексей Злыгостев оформление, разработка ПО 2001–2019
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'