Синдром дисгенезии яичек
Синдром дисгенезии яичек называют также смешанной дисгенезией гонад, асимметричной дисгенезией гонад, атипичной дисгенезией гонад, синдромом эмбриональных яичек, синдромом рудиментарных яичек, смешанной дисгенезией яичек.
С 1962 г. И. В. Голубева, М. А. Жуковский наблюдают и описывают больных с синдромом дисгенезии яичек. В 1963 г. был впервые предложен термин "смешанная дисгенезия гонад" (A. Sohval), а в 1965 г.- "синдром рудиментарных яичек" (I. Boczkowski, J. Teter). Э. П. Касаткина считает более целесообразным вместо обозначения "смешанная дисгенезия гонад" употреблять термин "смешанная дисгенезия яичек" (1979).
Синдром дисгенезии яичек -довольно редкая патология, хотя статистических данных о его частоте в популяции и среди лиц с эндокринными заболеваниями нет, что, видимо, связано с описанием этих больных под самыми разными названиями и отсутствием четкой классификации нарушений формирования пола. Тем не менее у больных с так называемым ложным мужским гермафродитизмом синдром дисгенезии яичек встречается наиболее часто.
Этиология, патогенез. Причиной недоразвития фетального- яичка могут быть количественные и структурные хромосомные аберрации. Иногда определяется мозаичный кариотип 45X/46XY, реже - XXY, XY/XXY, XY/XYY. В большинстве случаев определяют нормальный мужской кариотип 46XY, что затрудняет выявление причины эмбриональной дисгенезии яичка. При этом не исключена генная мутация. Несомненное значение имеют различные повреждающие факторы, действующие в критический период полового формирования - период эмбриональной дифференцировки яичка. Дисгенетичные яички, видимо, не способные выделять в достаточном количестве активный антимюллеров фактор и адрогены, не обеспечивают регресс парамезонефральных (мюллеровых) протоков и нормальную маскулинизацию наружных гениталий в эмбриональном периоде, что вызывает неправильное формирование как внутренних, так и наружных половых органов. Развиваются дериваты парамезонефральных протоков (рудиментарная матка, маточные трубы, влагалище) наряду с придатками яичка, семявыносящим протоком. Наружные гениталии имеют более или менее незавершенную эмбриональную маскулинизацию. Степень маскулинизации урогенитального синуса, а также размеры полового члена ребенка могут служить своеобразным критерием в прогнозировании функциональной (андрогенной) активности дисгенетичных яичек. Однако довольно часто встречаются случаи несоответствия маскулинизации урогенитального синуса и полового члена, что, возможно, связано с более медленным нарастанием функциональной активности яичек по сравнению с нормой. Андрогенная активность гонад в период маскулинизации урогенитального синуса значительно слабее, чем в период увеличения полового члена [Голубева И. В., 1980].
Развитие вторичных половых признаков также отображает функциональную активность дисгенетичных яичек в пубертатном и юношеском возрасте. Появление мужских вторичных половых признаков (низкий тембр голоса, половое оволосение, мужская архитектоника скелета, увеличение полового члена) в нормальные сроки или немного позже указывает на безусловную андрогенную активность дисгенетичных гонад.
Представляют интерес морфологические особенности тестикулярной ткани при данной патологии. Преобладают нарушения герминативного компонента яичка, вследствие чего страдает его генеративная функция. Элементы гонад, осуществляющие эндокринную функцию, более сохранны и функционально достаточно активны [Юрьева Н. П., 1978]. Эти особенности тестикулярной ткани свойственны как билатеральным, так и унилатеральным яичкам [Юрьева Н. П., 1978].
Опухолевые изменения дисгенетичных яичек развиваются часто. Большинство исследователей считают источником этих опухолей герминативный компонент гонад. Опухоли дисгенетичных яичек в большинстве случаев являются гоноцитомами, чаще обнаруживаются при абдоминальном и билатеральном расположении яичек [Юрьева Н. П., 1978]. При опухоли в дисгенетичных яичках маскулинизация выражена мало. Опухолевые процессы в дисгенетичных яичках чаще доброкачественны [Юрьева Н. П., 1978; Murie N.. 1975]. Одним из факторов, влияющих на формирование опухоли в дисгенетичных гонадах, считают повышенную гонадотропную активность гипофиза, что подтверждается высоким уровнем гонадотропных гормонов у больных. Опухоли дисгенетичных яичек чаще возникают в пубертатном и юношеском возрасте. Не исключены и биологическое детерминирование опухолей дисгенетичных гонад, а также нарушение нисхождения дисгенетичных яичек.
Большинство исследователей считают, что дисгенетичные яички в любом случае нужно удалять. Однако в связи с достаточно высокой активностью гонад при дисгенезии яичек в период полового созревания следует более дифференцированно подходить к удалению гонад [Жуковский М. А., 1971; Юрьева Н. П., 1978; Голубева И. В., 1980].
Поскольку никогда и никакой гормональный препарат не может обладать тем диапазоном биологического действия, каким обладает живая ткань половой железы в обеспечении гомеостаза, выделяющая всю гамму промежуточных продуктов синтеза андрогенов, отношение к удалению дисгенетичного яичка при выборе пола должно быть максимально щадящим и обоснованным [Голубева И. В., 1980].
Клиническая симптоматика. Больной имеет дисгенетичное яичко, производные парамезонефральных протоков (влагалище, матка, маточные трубы), мезонефральных (придаток яичка) протоков, бисексуальное строение наружных гениталий. Неправильное строение наружных половых органов выявляется при рождении ребенка как большая или меньшая незавершенность внутриутробной маскулинизации: половой член недоразвит, иногда имеет вид гипертрофированного клитора, мошонка расщеплена, в некоторых случаях похожа на большие половые губы, имеется урогенитальный синус либо есть плоская промежность, на которой раздельно открываются вход во влагалище и наружное отверстие уретры.
Выделяют два варианта синдрома: монотестикулярный, с одним дисгенетичным яичком, битестикулярный, с билатеральным развитием дисгенетических яичек [Голубева И. В., 1980]. Монотестикулярный вариант часто описывается в литературе как "синдром смешанной дисгенезии гонад". С одной стороны есть дисгенетичное яичко, а с другой - соединительнотканный тяж (стрек), реже полностью отсутствуют признаки гонады. Предложено не разделять эти формы, а объединить их в синдром дисгенезии яичек, так как при моно- и битестикулярных формах не выявлены достоверные различия ни в кариотипе, ни в андрогенной активности, ни в особенностях роста [Юрьева Н. П., 1978; Голубева И. В., 1980].
При синдроме дисгенезии яичек проявляется выраженная андрогенная активность дисгенетичного яичка в пубертатном периоде, наступающем в обычные сроки, что в ряде случаев вынуждает ставить вопрос о смене гражданского пола с женского, определенного при рождении, на мужской. В пубертатном периоде у многих больных появляются мужские вторичные половые признаки: увеличивается и вирилизируется половой член, снижается тембр голоса, телосложение приобретает маскулинные черты, усиливается оволосение по мужскому типу, формируется мужская психосексуальная ориентация. По несомненным клиническим различиям пубертатного периода у больных с синдромом дисгенезии яичек выделяют его андроидный, евнухоидный [Голубева И. В., 1980] и тернероидный варианты [Голубева И. В., 1980; Liscer R., 1978; Rousson R., 1979]. При андроидном варианте строение наружных гениталий ближе к мужским, а в пубертатном периоде выражена вирилизация фенотипа.
При евнухоидном варианте строение наружных гениталий ближе к женским, в пубертатном периоде вирилизация фенотипа незначительная, половое оволосение по женскому типу, телосложение интерсексуальное.
При тернероидном варианте синдрома отмечаются черты, характерные для синдрома Шерешевского-Тернера.
Дисгенетичные яички чаще располагаются в брюшной полости, реже по ходу пахового канала или в мошонке. Врожденная паховая грыжа с дисгенетичным яичком - патогномоничный признак синдрома дисгенезии яичек. У большинства больных с синдромом дисгенезии яичек до наступления пубертатного возраста фенотип нейтральный.
Выделение трех описанных выше вариантов синдрома дисгенезии яичек диктуется не только несомненными клиническими различиями, но и разной тактикой лечения этих больных.
Диагностика и дифференциальная диагностика. Диагноз синдрома дисгенезии яичек ставят по следующим основным признакам: отрицательный половой хроматин, мужской кариотип- 46XY (реже мозаицизм), дисгенетичные яички, расположенные чаще в брюшной полости, женские внутренние гениталии (рудиментарная матка, трубы, влагалище), бисексуальные наружные гениталии.
Анамнестические данные имеют определенное значение в диагностике синдрома. У 33 % женщин, имеющих больных детей, мы определили выраженный токсикоз первой половины беременности. Полученные данные подтверждают, что наряду с хромосомными аберрациями (структурными или количественными), генными мутациями различные формы синдрома дисгенезии яичек могут быть обусловлены и эмбриотоксическими факторами (интоксикация, инфекция), нарушениями гормонального баланса у беременных, действующими в критические по формированию полового тракта периоды эмбрионального развития (рис. 62).
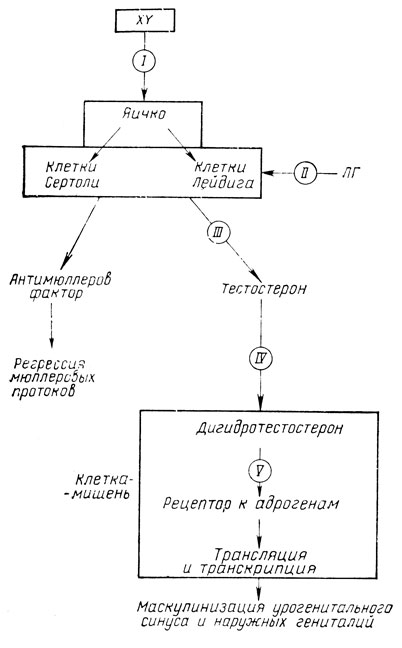
Рис. 62. Патогенетические механизмы возникновения различных форм ложного мужского гермафродитизма. I - синдром дисгенезии яичек - результат хромосомных аномалий (мозаицизм XO/XY, структурные аномалии Y-хромосомы), мутации гена, ответственного за выработку H-Y (Y-антигена); II, III - синдром неполной маскулинизации: II - нарушение чувствительности клеток Лейдига к гонадотропной (ЛГ) стимуляции; III - ферментативные нарушения биосинтеза тестостерона; IV - синдром тестикулярной феминизации (неполная форма) - результат дефицита фермента 5-α-редуктазы; V - синдром тестикулярной феминизации (полная форма) - полный качественный или количественный дефект клеточных рецепторов к андрогенам
Известно, что синдром дисгенезии яичек обусловлен недостаточным андрогенным воздействием на фенотип как в эмбриональном, так и в пубертатном периоде, что связано с функциональной несостоятельностью фетальных яичек. В связи с этим интересно, отражается ли андрогенная недостаточность в эмбриогенезе на массе тела новорожденного. A priori можно было бы предположить, что в связи с определенным недостатком андрогенов, их анаболического действия на плод масса тела уменьшается.
Однако большинство детей с синдромом дисгенезии яичек рождаются с массой и длиной тела, соответствующими средней норме. В 25 % случаев при рождении масса тела была несколько ниже, что, возможно, связано с абсолютным недостатком андрогенов в эмбриональном периоде. Нельзя исключить присущую этой патологии в определенном проценте случаев низкорослость с характерными тернероидными чертами, что могло проявиться уже при рождении уменьшением длины и массы тела.
Физическое развитие большинства больных с синдромом дисгенезии яичек находится в пределах возрастной нормы, но встречается низкорослость, особенно при тернероидных вариантах синдрома, что заметнее в пубертатном и юношеском возрасте. Дети с синдромом дисгенезии яичек после удаления гонад в допубертатном возрасте отстают в росте от детей с сохранными яичками.
Половая дифференцировка телосложения у больных с сохранными гонадами (андроидный вариант) проявляется в близком к норме возрасте. Наиболее ранняя маскулинизация телосложения отмечена нами у больного 12 лет.
Своевременное формирование фигуры по мужскому типу у больных с синдромом дисгенезии яичек говорит о сохранности генетического кода. Этот код и обеспечивает включение пубертатного развития регуляторных механизмов гонадостата.
У детей с удаленными в допубертатном возрасте гонадами до начала заместительной гормонотерапии телосложение не имеет тенденции к половой дифференцировке, а в отдельных случаях намечаются евнухоидные пропорции скелета.
Наружные гениталии у детей с синдромом дисгенезии яичек бисексуальны, с большей или меньшей маскулинизацией (рис. 63, 64).
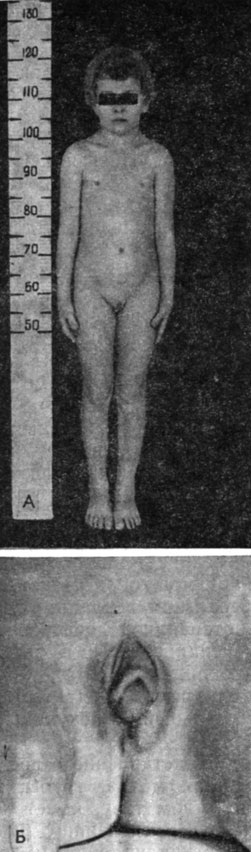
Рис. 63. Больная 10 лет. Синдром дисгенезии яичек. Наружные гениталии бисексуальны, слева яичко в большой половой губе, справа - соединительнотканный тяж; сохранены дериваты мюллеровых; протоков - матка, трубы, влагалище. А - общий вид; Б - наружные половые органы
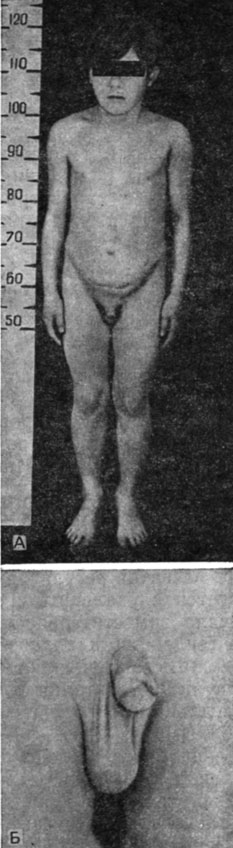
Рис. 64. Больной 13 лет. Синдром дисгенезии яичек, тернероидная форма. А - общий вид; Б - наружные половые органы
Пальпаторное исследование дает представление о состоянии внутренних гениталий (рудиментарная матка, трубы, влагалище), опухолевых образованиях в малом тазу, имеет дифференциально-диагностическое значение. Определение рудиментарной матки исключает синдром тестикулярной феминизации и неполной маскулинизации.
Таким образом, строение наружных и внутренних гениталий, физическое развитие, телосложение, выраженность вторичных половых признаков у больных с синдромом дисгенезии яичек отражают функциональное состояние дисгенетичных яичек как в эмбриональном периоде, так и в пубертатном и юношеском возрасте. Абсолютный андрогенный дефицит проявляется в пубертате длительным сохранением детских пропорций тела, отставанием длины и массы тела (в некоторых случаях тернероидного варианта синдрома дисгенезии яичек), интерсексуальным строением фигуры (евнухоидный вариант) (рис. 65).
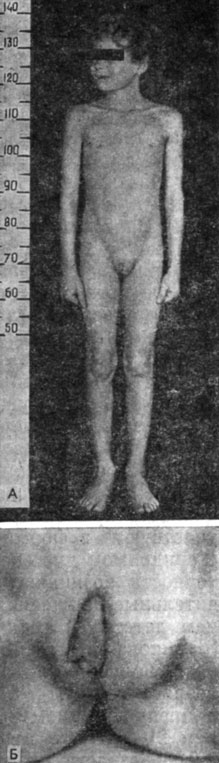
Рис. 65. Больная 7 лет. Синдром дисгенезии яичек. А - внешний вид; Б - наружные половые органы
Психосексуальная ориентация больных с синдромом дисгенезии яичек, так же как и при других формах нарушений половой дифференцировки, тщательно, осторожно уточняется в течение всего обследования. Учитывают психическую конституцию, черты поведения, интересы склонности, походку, одежду. Становление первичного полового самосознания - половая аутоидентификация - происходит в возрасте от 11/2 до 3 лет. С 3-4 лет ребенок обычно воспринимает биологические половые различия как способ мочеиспускания [Белкин А. И., 1972; Голубева И. В., 1980], В пубертатном периоде, когда у здоровых подростков появляются вторичные половые признаки, развивается психосексуальная ориентация [Muus R., 1980],
Половая аутоидентификация у детей с синдромом дисгенезии яичек тесно связана с полом воспитания. У мальчиков в этом возрасте не возникает сомнения в принадлежности к мужскому полу, несмотря на то что они мочатся сидя, а половой член иногда резко недоразвит. У детей, воспитываемых в женском поле, сомнений в принадлежности к девочкам не возникает, несмотря на неправильное строение наружных гениталий.
В пубертатном возрасте у этих детей также фиксирована психосексуальная ориентация в зависимости от пола воспитания. Ни у одного мальчика не возникает сомнения в принадлежности к мужскому полу независимо от степени маскулинизации наружных гениталий и выраженности андрогенизации в пубертатном периоде. У всех "девочек" психосексуальная ориентация женская, ни у одной не возникает сомнения в своей принадлежности к женскому полу. Большинство "девочек" хорошо успевают в школе, аккуратны, внимательны, помогают дома по хозяйству, но некоторые все же отличаются озорством и бесстрашием.
Большинство детей с синдромом дисгенезии яичек спокойно реагируют на свое состояние, охотно выполняют все назначения врача. Нельзя не отметить особую ласковость, расположенность, внимательность большинства детей с данной патологией, особенно выраженную у "девочек". Многие заботливо относятся к младшим детям, доверчивы, легко вступают в контакт. Эти же черты свойственны и больным юношеского возраста. Ни в одном случае при правильном воспитании в том или ином поле с раннего детства мы не встречали недоверчивости, негативизма, чувства собственной неполноценности. Однако мы наблюдали ребенка 57s лет, который рос с рождения в детском доме. Зарегистрированный в мужском гражданском поле, последние 6-8 мес до обследования он воспитывался как девочка. Это наложило большой отпечаток на поведение ребенка, у которого не было фиксированного полового самосознания: называл себя то девочкой, то мальчиком, речь была аграмматичной. Ребенок отличался обидчивостью, плаксивостью, раздражительностью, но в контакт вступал легко, осмотр переносил спокойно, активно играл как с девочками, так и с мальчиками, не отмечалось преимущественного выбора игрушек. Данный случай еще раз подтверждает мнение большинства исследователей о том, что половая аутоидентификация, становление психосексуальной ориентации зависят от пола воспитания.
Рентгенологические исследования имеют диагностическую ценность при синдроме дисгенезии яичек. Андрогены активно участвуют в формировании костной системы, и у больных с синдромом дисгенезии яичек вследствие андрогенной недостаточности возникают различные аномалии окостенения. Незначительные нарушения темпа окостенения происходят уже в раннем детстве и становятся заметнее в препубертатный период [Беникова Е. А., 1978].
В большинстве случаев дифференцировка скелета, костный возраст отстают от хронологического. В наших исследованиях в препубертатном возрасте это отставание составляло в среднем 2года, а в пубертатном - 3,1 года. У больных юношеского возраста после удаления в допубертатном периоде гонад отставание костного возраста было значительнее. В отдельных случаях у больных с андроидным вариантом синдрома костный возраст соответствует хронологическому. Костный возраст определяли с учетом новых данных о темпах дифференцировки скелета у здоровых детей, полученных сотрудниками рентгенологического отделения (А. И. Бухман) и детской клиникой (М. А. Жуковский) ИЭЭиХГ АМН СССР.
Андрогенная недостаточность большей или меньшей выраженности может способствовать изменениям в системе гипоталамус-гипофиз, созданию напряжения в этой системе (И. В. Голубева), в связи с чем всем больным необходимо сделать рентгенографию черепа. На краниограммах отмечаются различные изменения в виде небольшого остеопороза стенок турецкого седла, гиперлневматизации пазух основной кости, обызвествления твердой мозговой оболочки в лобно-теменной области. Эти изменения мы наблюдали лишь у больных пубертатного и юношеского возраста.
Рентгенологические исследования органов малого таза при пневмоперитонеуме проводят с целью выяснения состояния внутренних гениталий. Метод позволяет выявить производные мюллеровых (парамезонефральных) протоков (матку, трубы), а также существование и размеры гонад, расположенных интраабдоминально, дифференцировать синдром дисгенезии яичек с синдромом тестикулярной феминизации и неполной маскулинизации, при которых отсутствуют внутренние женские гениталии.
Нарушения обменных процессов при эндокринных заболеваниях вызывают изменения биоэлектрической активности мозга. Имеются сведения о сдвигах электроэнцефалографической картины у больных с инкреторной недостаточностью яичек [Гольбер М. А., 1977; Кураева Т. Л., 1978].
Исследование биоэлектрической активности мозга при синдроме дисгенезии яичек выявляет изменения на ЭЭГ уже в препубертатном возрасте у большинства больных, а в пубертатном и юношеском возрасте -во всех случаях. Отмечаются разлитые явления раздражения, повышение активности гипоталамической области, отклонение ритмов ЭЭГ в сторону высоких частот, диффузные изменения электроактивности, диэнцефальные нарушения.
Для установления правильного, этиологически и патогенетически обоснованного диагноза необходимо исследовать все ступени гонадотропной системы, поскольку существует гипоталамо-гипофизарно-гонадное функциональное единство. Синдром дисгенезии яичек представляет собой результат первичного поражения гонад, что в свою очередь вызывает более или менее выраженную недостаточность гормональной функции. Сниженный уровень половых гормонов по механизму обратной связи воздействует на гипофиз и стимулирует секрецию гонадотропных гормонов. Исследование гонадотропной функции у больных с синдромом дисгенезии яичек позволяет выявить особенности ее становления в зависимости от возраста и клинических проявлений данной патологии. При исследовании гормональной функции яичек отмечается тенденция к понижению базального уровня тестостерона при существенно не отличающемся от нормы уровне базального эстрадиола. В отдельных случаях у больных с андроидным вариантом в юношеском возрасте значения тестостерона и эстрадиола сопоставимы с нормой. При обследовании функциональной сохранности яичек у больных при проведении функциональной пробы с ХГ отмечается значительно сниженная реакция гонад.
У большинства больных независимо от клинической формы отмечается повышение гонадотропной активности, что еще раз подтверждает первичный, врожденный характер андрогенного дефицита у этих больных. В препубертатном возрасте имеется склонность к повышению уровня ЛГ по сравнению с нормой, а в пубертатном и юношеском возрасте отмечается его достоверное повышение. Уровень ФСГ существенно не отличается от нормы в препубертатном возрасте. В младшем пубертатном возрасте (11-13 лет) есть тенденция к его повышению по сравнению с нормой, а в старшем (14-15 лет) -уже определяется достоверное повышение уровня ФСГ. Уровень пролактина также обычно повышен по сравнению с нормой во всех возрастных группах.
Значительно повышенные индивидуальные значения ЛГ соответствуют наиболее сниженным значениям базального тестостерона и наоборот. Это говорит о сохранной чувствительности гипоталамических рецепторов к андрогенам у больных с синдромом дисгенезии яичек. Высокий уровень ФСГ у больных с синдромом дисгенезии яичек, видимо, связан с выраженным нарушением герминативного компонента яичек, с которым связывают выработку так называемого ингибина, регулирующего секрецию ФСГ. Повышение уровня пролактина у больных весьма показательно. Возможно, андрогенный дефицит разной выраженности, способствующий функциональным гипоталамическим нарушениям, ведет к снижению продукции пролактин- ингибирующего фактора, который является основным регулятором секреции пролактина. О частоте гипоталамических нарушений у больных с синдромом дисгенезии яичек говорят и изменения ЭЭГ.
Пубертатное повышение гонадотропной активности гипофиза у больных с синдромом дисгенезии яичек наступает в 13-14 лет, что существенно не отличается от нормы, поскольку и у здоровых детей признаки пубертата появляются в разные сроки. В 13-14 лет у больных с сохраненными гонадами начинает прогрессивно увеличиваться секреция тестостерона и эстрадиола, достигая к 16-17 годам в отдельных случаях андроидного варианта, синдрома уровня, сопоставимого с нормой.
Цитогенетические исследования начинают с определения полового хроматина. Метод исследования полового хроматина прост, информативен, позволяет провести предварительную диагностику различных форм нарушений половой дифференцировки. Однако половой хроматин - это динамичная структура, изменяющаяся в зависимости от фазы клеточного цикла, метаболизма клетки и общего состояния организма. Не рекомендуют исследовать половой хроматин в первые сутки после рождения, во время приема гормональных препаратов, антибиотиков. В настоящее время можно диагностировать мужской генетический пол по наличию флюоресцирующего Y-тельца в интерфазных ядрах культивируемых лимфоцитов и фибробластов кожи, лейкоцитов крови, клеток эпителия слизистой оболочки щеки и волосяных фолликулов.
Данные цитогенетического исследования, включающие определение кариотипа, позволяют связать патологию полового развития с нарушениями в хромосомном наборе, что, безусловно, расширяет представление об этиологии и патогенезе различных форм нарушения половой дифференцировки. Однако метод исследования кариотипа очень сложный и не всегда информативный в связи с вариабельностью данных у больных с одинаковыми формами патологии и, наоборот, с однотипными данными при различных формах нарушений половой дифференцировки. В настоящее время многие исследователи отводят методу вспомогательную, а не решающую роль. Половой хроматин у больных с синдромом дисгенезии яичек всегда отрицательный. В большинстве случаев патологии кариотип мужской - 46XY, реже отмечается мозаика 45XO/46XY. В клинической картине в таких случаях отмечаются некоторые тернероидные черты.
Биопсия гонад с гистологическим исследованием ткани обоих дисгенетичных яичек необходима в плане онкологической настороженности, а также для прогнозирования функциональной возможности гонад, что имеет большое значение для выбора пола. Для этого проводят лапароскопию или лапаротомию. Последняя предпочтительнее, так как можно детально осмотреть гонады и органы малого таза, а при необходимости провести хирургическое вмешательство [Голубева И. В., 1980].
Диагностическая лапаротомия с биопсией, вентрофиксацией или удалением яичек становится завершающим этапом обследования больных с врожденными нарушениями формирования пола.
Вопросы выбора пола. При установлении диагноза синдрома дисгенезии яичек одновременно нужно определить и гражданский пол ребенка. Выбор гражданского пола является наиболее ответственным и трудным этапом в терапии больных с данной формой врожденных нарушений. Необходимо учитывать способность больного к максимальной адаптации в выбранном поле как в социальном, так и в половом отношении. Решающими факторами в выборе гражданского пола ребенка являются размеры и строение полового члена, а также состояние и функциональная активность яичек (яичка).
Избрание мужского гражданского пола наиболее целесообразно и физиологично при достаточном развитии полового члена и удовлетворительном состоянии яичек (яичка). Следует учитывать и хорошую чувствительность тканей-мишеней (органов-мишеней) к андрогенам, что позволяет предположить потенциальную способность полового члена значительно увеличиваться в пубертатном возрасте. При избрании мужского гражданского пола во время диагностической лапаротомии, которая становится и началом хирургической коррекции пола, дисгенетичные яички (яичко) выводят из брюшной полости и производят их вентрофиксацию. Гонадальный соединительнотканный тяж (стрек) удаляют. Одновременно удаляют дериваты мюллеровых (парамезонефральных) протоков. Позднее проводят коррекцию наружных гениталий. Маскулинизирующую реконструкцию наружных гениталий делают в два этапа: выпрямление полового члена и образование пениальной уретры [Голубева И. В., 1980]. Большинство авторов рекомендуют проводить выпрямление полового члена на втором году жизни, а формирование уретры - после 6 лет.
При недостаточной маскулинизации наружных гениталий, малых размерах полового члена, а также при значительных повреждениях яичек (яичка), а тем более при их опухолевом изменении женский гражданский пол является наиболее оправданным и целесообразным. В таких случаях во время диагностической лапаротомии удаляют дисгенетичные яички (яичко и стрек) и одновременно проводят феминизирующую реконструкцию наружных гениталий. В последнее время дисгенетичные яички по возможности не удаляют, а вентрофиксируют с целью сохранения анаболического действия гонад и их взаимосвязи с гипоталамусом [Голубева И. В., 1980]. При нежелательных проявлениях андрогенной активности в пубертатном периоде вентрофиксированные яички (яичко) легко удаляют.
Необходимость ранней диагностики и соответствующей коррекции пола не подлежит сомнению. Это имеет огромное значение для правильной половой аутоидентификации и формирования личности ребенка в целом. Оптимально установление пола с коррекцией наружных гениталий не позднее 2-3 лет, иногда операцию откладывают до 3-4 лет из-за малых размеров операционного поля [Голубева И. В., 1980].
Гормональные методы лечения. В зависимости от избираемого пола гормональное лечение проводится для максимальной коррекции фенотипа в соответствии с выбранным полом. Гормональная терапия в основном заместительная, восполняющая недостаток эндогенных половых гормонов.
У больных с синдромом дисгенезии яичек заместительная терапия проводится для предотвращения евнухоидизма в пубертатном периоде, для правильного формирования фенотипа, развития вторичных половых признаков и половых органов, для предотвращения обменных нарушений и гипоталамической патологии; свойственных посткастрационному синдрому [Френкель Г. М., 1972; Зарубина Н. А. и др., 1978]. Заместительную терапию женскими половыми гормонами проводят при избрании женского гражданского пола. У больных с удаленными в допубертатном возрасте гонадами лечение начинается с учетом длины тела, дифференцировки скелета в период, соответствующий физиологическому пубертату. При высокорослости и значительном отставании дифференцировки скелета (костного возраста) заместительную терапию назначают раньше (с 10- 11 лет), при низкорослости с тернероидными чертами и незначительном отставании дифференцировки скелета - с 13-14 лет, тем самым предотвращая развитие евнухоидных пропорций в первом случае и раннее закрытие зон роста во втором. У больных старшего возраста заместительная терапия назначается с момента удаления гонад. Большинство больных с синдромом дисгенезии яичек проявляют хорошую чувствительность к женским половым гормонам, о чем свидетельствуют результаты лечения (развитие женского фенотипа, регулярные менструальноподобные кровотечения, женская психосексуальная ориентация).
Лечение начинают с эстрогенов, имитируя нарастание их уровня в пубертатном периоде. Эстрогенотерапия проводится непрерывно, до появления индуцированных менструальноподобных кровотечений, обычно синэстролом по 0,001 г (1 таблетка ежедневно) или микрофоллином по 0,05 мг (1 таблетка ежедневно). После появления индуцированных менструальноподобных кровотечений лечение в дальнейшем проводят по циклической схеме.
При избрании мужского гражданского пола в случаях недостаточной функции яичек, при опасности развития евнухоидизма больным с синдромом дисгенезии яичек с пубертатного периода дополнительно назначают андрогенотерапию. В большинстве случаев мужской гражданский пол избирают при достаточной андрогенной активности дисгенетического яичка, что позволяет считать терапию андрогенами в этих случаях не заместительной, а поддерживающей, иногда стимулирующей. Андрогенные препараты вводят в минимальных дозах и прерывистыми курсами, так как интенсивная андрогенотерапия может привести к снижению гонадотропной активности и угнетению функции не вполне состоятельных яичек [Голубева И. В., 1980].
Считают, что увеличивать дозы андрогенных препаратов следует постепенно, как бы в соответствии с физиологическим нарастанием секреции тестостерона по мере полового созревания [Скородок Л. М., Савченко О. Н., 1984]. Назначают метилтестостерон по 0,005 г (1 таблетка) 2-3 раза в день сублингвально в течение месяца, перерыв между курсами 2-4 нед [Голубева И. В., 1980]. В последнее время прием некоторых пероральных андрогенов ограничивают из-за возможности осложнений и недостаточной эффективности. Предпочтение отдают препаратам для внутримышечного введения, особенно при необходимости активной андрогенотерапии. Назначают сустанон-250 по 1 мл внутримышечно 1 раз в месяц или реже в зависимости от эффективности, постоянно (при выраженной недостаточности яичек 1 мл 10 % раствора тестэната внутримышечно 1 раз в 2-3 нед постоянно) [Голубева И. В., 1980].
Гормональное лечение, направленное на максимальное приближение фенотипа к избранному гражданскому полу, дает хорошие результаты. Осложнения ограничиваются индивидуальной непереносимостью препарата, иногда привыканием к нему. В последние годы указывают на возможность функциональных и органических изменений печени при длительном введении больших доз метилтестостерона.
Вопрос о сроках начала гормональной терапии у больных с врожденными нарушениями формирования пола до последнего времени остается спорным. Целью заместительной терапии является предотвращение евнухоидизма в пубертатном периоде, гипоталамических нарушений, вызванных дефицитом половых гормонов в критический период становления гипоталамической регуляции гонадостата. Заместительная терапия способствует развитию вторичных половых признаков, формированию фенотипа в направлении избранного пола. Своевременное начало заместительной терапии имеет огромное значение и в том смысле, что раннее ее проведение может задержать рост больного, а при позднем начале терапии можно упустить период наибольшей чувствительности тканей-мишеней к половым гормонам.
В связи с относительной низкорослостью детей с синдромом дисгенезии яичек, особенно при тернероидном варианте синдрома, рациональнее начинать заместительную гормональную терапию в возрасте 13-14 лет. Однако в каждом отдельном случае при решении вопроса о начале заместительной терапии половыми гормонами необходимо учитывать индивидуальные особенности больного, его конституцию.
Социальная реабилитация больного с синдромом дисгенезии яичек обусловлена ранней диагностикой, правильным определением гражданского пола, соответствующей хирургической и гормональной коррекцией, направленной на формирование фенотипа, не вызывающего сомнения ни у больного, ни у окружающих, возможностью половой жизни в избранном поле в дальнейшем, вступления в брак, создания семьи.
|
ПОИСК:
|
© Анна Козлова подборка материалов; Алексей Злыгостев оформление, разработка ПО 2001–2019
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'