Ложное преждевременное половое развитие
Ложное преждевременное половое развитие у девочек
Основной причиной ложного ППР у девочек являются гормональноактивные опухоли яичника. E. Reiter в 1972 г., анализируя свои наблюдения и опубликованные случаи, пришел к выводу, что в 10% всех случаев ППР у девочек причиной заболевания служат гормональноактивные опухоли яичников. Это главным образом опухоли гранулезоклеточной ткани, реже - высокодифференцированные формы тератом, обладающие гормональной активностью и секретирующие большое количество экстрогенов (рис. 52). Крайне редко встречаются опухоли яичников (тератомы, хорионэпителиомы), секретирующие в большом количестве белки с гонадотропной активностью. Опухоли яичников чаще развиваются у девочек моложе 4 лет.
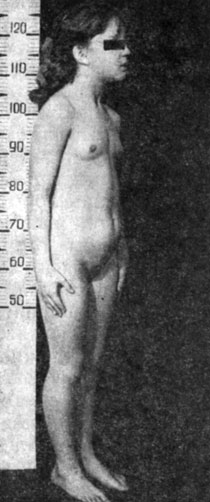
Рис. 52. Больная 5 лет. Преждевременное половое развитие. Эстрогенпродуцирующая опухоль яичников
Темпы полового развития могут быть различными, что обусловлено количеством секретируемых опухолью эстрогенов. Возможно волнообразное проявление симптоматики. Характерный клинический признак - преобладание эстрогензависимой симптоматики. Часто первым и ведущим симптомом становятся менструальноподобные выделения при отсутствии других вторичных половых признаков или их слабом развитии. Выделения никогда не бывают регулярными. Отмечается гиперпигментация ареол, половых губ. Наружные гениталии отечны, малые губы часто гипертрофированы. Андрогенозависимые вторичные половые признаки (оволосение, ускорение линейного роста и дифференцировки скелета), как правило, проявляются незначительно. Исключение составляют опухоли со смешанной эстроген- и андроген-гормональной активностью. При ректальном исследовании пальпируется увеличенная матка; при достаточных размерах опухоли возможна пальпация пораженной гонады.
Диагностика гормональноактивной опухоли основана на клинической каротине и обязательном рентгенологическом или ультразвуковом исследовании органов малого таза. При гормональном исследовании выявляется высокий уровень эстрогенов при низком, соответствующем возрасту девочки, а иногда и ниже, уровне гонадотропинов. Очень высокий уровень гонадотропинов, соответствующий посткастрационному, должен навести на мысль о хорионэпителиоме.
Лечение оперативное. Прогноз при гранулезоклеточных опухолях благоприятный. Тератомы и хорионэпителиомы склонны к злокачественному метастазированию.
Ложное преждевременное половое развитие у мальчиков
Причины ложного ППР у мальчиков более многочисленны, чем у девочек, основные из них - гормонпродуцирующие опухоли яичка, андрогенпродуцирующие опухоли надпочечников и врожденная дисфункция коры надпочечников.
Гормонпродуцирующие опухоли яичка встречаются довольно редко и составляют всего 2% всех опухолей гонад у мужчин. У мальчиков младшего возраста (до 6 лет) чаще встречаются опухоли из интерстициальной ткани (лейдигомы), обладающие исключительно андрогенной активностью. Опухоли этого типа, как правило, доброкачественные. Повышенный уровень андрогенов, секретируемых опухолью, приводит к значительному ускорению роста и дифференцировки костного скелета, маскулинизации фигуры. Развивается вторичное оволосение, грубеет голос. Увеличивается половой член, отмечаются эрекции. Пораженное яичко увеличено, при пальпации болезненное, бугристое, плотное. Второе яичко маленькое, иногда атрофичное.
Реже в детском возрасте встречаются опухоли яичек, исходящие из клеток тубулярного эпителия гонад (андробластомы). Опухоль данного типа имеет смешанную гормональную активность и секретирует как андрогены, так и эстрогены. Подобный характер имеют и опухоли, исходящие из клеток Сертоли (сертолиомы). В связи с этим в клинической картине заболевания наряду с признаками ППР у мальчиков могут появиться и эстрогензависимые симптомы (гинекомастия).
Диагноз ставится на основании клинической картины и пальпаторного исследования яичек. При гормональном обследовании у мальчиков с гормональноактивными опухолями гонад выявляется высокий уровень тестостерона, реже и эстрадиола. Уровень гонадотропных гормонов резко снижен. В сомнительных случаях показана биопсия яичек для гистологического исследования. Лечение оперативное. Прогноз в случае доброкачественного роста опухоли благоприятный.
Врожденная дисфункция коры надпочечников - наиболее частая причина ложного ППР у мальчиков. В основе заболевания лежит врожденный дефект ферментных систем, участвующих в биосинтезе глюкокортикоидных гормонов коры надпочечников. В результате снижения уровня основного глюкокортикоидного гормона кортизола резко повышается уровень гипофизарного АКТГ. Гиперстимуляция АКТГ приводит к гиперплазии коры надпочечников и усилению продукции гормонов, синтез которых не нарушен (надпочечниковые андрогены). Гиперандрогения надпочечникового генеза приводит к развитию вирильного синдрома у девочек (см.) и ложному ППР у мальчиков.
Существуют различные дефекты ферментных систем синтеза не только кортизола, но и минералокортикоидов, что приводит не только к андрогенизации, но и к нарушению водно-солевого обмена, гипертонии и др. В таких случаях ведущими в клинической картине заболевания будут именно эти нарушения. В настоящем разделе мы коснемся только вирильной, неосложненной формы заболевания.
Клиническая картина. Ферментный дефект синтеза глюкокортикоидов проявляется с 10-11-й недели внутриутробного развития. В связи с этим гиперандрогенизация отмечается уже при рождении ребенка. Дети нередко имеют большую массу тела (более 4 кг), наружные гениталии увеличены, пигментированы. Наиболее отчетливо признаки ППР отмечаются с 2-3-летнего возраста. Мальчики опережают сверстников в длине тела, имеют хорошо развитую мускулатуру. Развивается вторичное оволосение, грубеет голос, появляются оволосение лица, обильные acne vulgaris. Половой член значительно увеличен, возникают эрекции. Яички, как правило, по размерам и консистенции соответствуют хронологическому возрасту ребенка, так как развитие тестикулярной ткани зависит главным образом от гонадотропных гормонов гипофиза, уровень которых при данном заболевании остается допубертатным. Под влиянием повышенной концентрации андрогенов быстро прогрессирует дифференцировка костного скелета. Без соответствующей терапии зоны роста закрываются к 6-7 годам. Конечная длина тела детей с врожденной дисфункцией коры надпочечников без лечения составляет 121 - 160 см [Жуковский М. А. и др., 1977].
Диагностика врожденной дисфункции коры надпочечников у мальчиков основана на особенностях клинической картины и характерных лабораторных показателях. Наиболее распространенным и доступным является определение уровня суммарных 17-КС - основных мочевых метаболитов надпочечниковых андрогенов. При врожденной дисфункции коры надпочечников этот показатель значительно превышает норму. После назначения дексаметазона, аналога кортизола, по 2-4 мг/сут (в зависимости от возраста) в течение 2 дней уровень 17-КС снижается на 50% и более. Эта проба служит основным дифференциально-диагностическим критерием для разделения врожденной дисфункции коры надпочечников и андростеромы - андрогенпродуцирующей опухоли коры надпочечников.
В последние годы для диагностики врожденной дисфункции коры надпочечников определяют 17-а-гидроксипрогестерон в сыворотке крови. Это соединение, являясь предшественником на пути синтеза кортизола до основного ферментного дефекта, накапливается в крови в большом количестве. Повышение уровня 17-а-гидроксипрогестерона - наиболее достоверный критерий в диагностике данного заболевания.
Из параклинических методов для диагностики можно использовать рентгенологическое (пневмосупраренография) и ультразвуковое исследование надпочечников, которые при данной патологии умеренно гиперплазированы.
Лечение. Единственным методом лечения врожденной дисфункции коры надпочечников остается заместительная терапия препаратами кортизола. Чаще применяют преднизолон. Дозу препарата подбирают индивидуально, в среднем 5-10 мг/сут. Адекватная терапия преднизолоном, начатая в раннем возрасте" предотвращает патологическую андрогенизацию организма, обеспечивает нормальное развитие ребенка, своевременное начало п правильное течение пубертатного периода.
Андростерома - опухоль надпочечников, секретирующая андрогены. Встречается у мальчиков редко. Чаще опухоли бывают злокачественными.
Клиническая картина заболевания имеет общие черты с проявлениями врожденной дисфункции коры надпочечников. У мальчиков ускоряются рост и дифференцировка костного скелета, появляется половое оволосение, изменяется голос. Увеличивается половой член, а яички остаются маленькими и плотными, появляются обильные acne vulgaris на коже лица и туловища (рис. 53).
Диагностика основана на значительном (в десятки раз) повышении уровня экскреции суммарных 17-КС с мочой. Назначение дексаметазона не приводит к их снижению вследствие автономной секреции гормонов опухолью. Уровень 17-оксипрогестерона соответствует норме, уровень тестостерона резко повышен. Показатели гонадотропных гормонов остаются на допубертатных значениях. На пневмосупраренограммах в месте локализации опухоли определяется округлая тень, второй надпочечник может быть атрофирован. Для определения места опухоли можно использовать также ультразвуковые, радиологические (с холестеролом, меченным 131I) методы исследования, компьютерную томографию надпочечников.
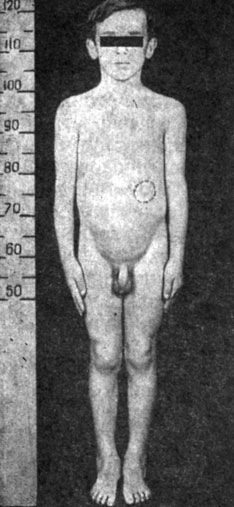
Рис. 53. Больной 5 лет. Синдром преждевременного полового развития. Андрогенпродуцирующая опухоль левого надпочечника (андростерома)
Лечение оперативное. Прогноз при отсутствии метастазов благоприятный. При метастазах показана терапия препаратами, вызывающими некроз ткани надпочечников (хлодитен, ортопара-ДДД).
|
ПОИСК:
|
© Анна Козлова подборка материалов; Алексей Злыгостев оформление, разработка ПО 2001–2019
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'