Глава 2. Гормональная регуляция полового развития
Анатомо-физиологическая характеристика основных звеньев гормональной регуляции
Регуляция полового развития обеспечивается взаимодействием ряда систем, реализующих свой эффект на различных уровнях. Условно систематизируя звенья гормональной регуляции, можно выделить 3 основных уровня: а) центральный уровень, включающий кору головного мозга, подкорковые образования, ядра гипоталамуса, эпифиз, аденогипофиз; б) периферический уровень, включающий половые железы, надпочечники и секретируемые ими гормоны и их метаболиты; в) тканевый уровень, включающий специфические рецепторы в органах-мишенях, с которыми взаимодействуют половые гормоны и их активные метаболиты. Система регуляции половой функции организма подчинена единому принципу, основанному на координировании процессов положительных и отрицательных обратных связей между гипоталамо-гипофизарной системой и периферическими железами внутренней секреции.
Центральный уровень регуляции
Основным координирующим звеном гормональной регуляции являются подкорковые образования и гипоталамус, который осуществляет взаимосвязь между центральной нервной системой, с одной стороны, и гипофизом и половыми железами - с другой. Роль гипоталамуса обусловлена его тесной взаимосвязью с вышележащими отделами центральной нервной системы. В ядрах гипоталамуса найдено высокое содержание биогенных аминов и нейропептидов, играющих роль нейротрансмиттеров и нейромодуляторов в трансформации нервного импульса в гуморальный. Кроме того, гипоталамус содержит большое количество рецепторов к половым стероидам, что подтверждает его непосредственную взаимосвязь с половыми железами. Внешние импульсы, действуя через афферентные проводящие пути на кору головного мозга, суммируются в подкорковых образованиях, где осуществляется трансформация нервного импульса в гуморальный. Предполагают, что основные подкорковые центры, модулирующие деятельность половых желез, локализуются в структурах лимбической системы, миндалины и гиппокампа. Ядра миндалины оказывают как стимулирующее, так и ингибирующее воздействие на гонадотропную функцию гипофиза, что зависит от локализации импульса. Предполагается, что стимулирующее влияние реализуется через медиальные и кортикальные ядра миндалины, а ингибирующее - через базальные и латеральные ядра. Взаимосвязь ядер миндалины с гонадотропной функцией может быть обусловлена включением этих образований в систему положительных и отрицательных обратных связей, так как в ядрах миндалины найдены рецепторы к половым стероидам. Гиппокамп оказывает ингибирующее влияние на гонадотропную функцию гипоталамуса. Ингибирующие импульсы достигают аркуатных ядер гипоталамуса через кортико-гипоталамический тракт [Raisman G., Field P., 1971].
Кроме стимулирующего и ингибирующего влияния подкорковых образований, большую роль в осуществлении передачи нервного импульса в гуморальный на уровне гипоталамуса играют адренергические медиаторы - биогенные амины. В настоящее время они рассматриваются как регуляторы синтеза и секреции рилизинг-гормонов гипоталамуса. В ЦНС выделяют 3 типа волокон, содержащих различные моноамины. Все они оказывают разнонаправленное действие на гипоталамус.
Норадренергическая система осуществляет связь гипоталамуса со структурами продолговатого мозга и гиппокампа. Высокая концентрация норадреналина найдена в паравентрикулярном, дорсомедиальном ядрах гипоталамуса и в срединном возвышении. Большинство исследователей связывают действие норадреналина с активацией системы гипоталамус - гипофиз-гонады [Ojeda S., McCann S., 1978]. Интенсивность воздействия норадреналина на нейроны гипоталамуса зависит от уровня половых стероидов, главным образом эстрогенов [Бабичев В. Н., Игнатков В. Я., 1980].
Взаимосвязь подкорковых ядер и гипоталамуса наиболее широко реализуется через дофаминергическую систему. Дофаминергические нейроны локализуются главным образом в ядрах медиобазального гипоталамуса. Пока не выяснено, какую роль - активирующую или подавляющую - играет дофамин в отношении гонадотропинрегулирующей функции гипоталамуса. В многочисленных экспериментальных и клинических работах приводятся данные об ингибирующем влиянии дофаминергической системы на выработку и секрецию гонадотропных гормонов, главным образом лютеинизирующего гормона - ЛГ [Fuxe К., 1976; Judd Н., 1978]. В то же время имеются экспериментальные работы, свидетельствующие о стимулирующей роли дофамина в секреции ЛГ, особенно в регуляции его овуляторного выброса. Такие противоречия, вероятно, объясняются тем, что то или иное воздействие дофамина опосредовано уровнем эстрогенов [Бабичев В. Н., 1980; Ojeda S., 1979; Owens R., 1980]. Кроме того, имеется мнение о существовании двух типов дофаминергических рецепторов: стимулирующих и ингибирующих выработку ЛГ. Активация рецепторов того или иного вида зависит от уровня половых стероидов [Cools D., 1977].
Серотонинергическая система осуществляет связь гипоталамуса с отделами среднего и продолговатого мозга и лимбической системы. Серотонинергические волокна поступают в срединное возвышение и заканчиваются в его капиллярах. Серотонин ингибирует гонадотропинрегулирующую функцию гипоталамуса на уровне аркуатных ядер. Не исключено его опосредованное влияние через эпифиз.
Кроме биогенных аминов, в качестве нейромедиаторов, регулирующих гонадотропинрегулирующую функцию гипоталамуса, могут выступать опиоидные пептиды - вещества белковой природы, обладающие морфиноподобным действием. К ним относятся метионин- и лейцин-энкефалины, α-, β-, γ-уэндорфины. Основная масса опиоидов представлена энкефалинами. Они обнаружены во всех отделах ЦНС. Опиоиды изменяют содержание биогенных аминов в гипоталамусе, конкурируя с ними за рецепторные места [Бабичев В. Н., Игнатков В. Я., 1980;' Klee N., 1977]. Опиоиды оказывают ингибирующее воздействие на гонадотропную функцию гипоталамуса.
Роль нейротрансмиттеров и нейромодуляторов в ЦНС могут исполнять различные нейропептиды, найденные в большом количестве в различных отделах ЦНС. К ним относятся нейротензин, гистамин, субстанция Р, холецистокинин, вазоактивный кишечный пептид. Эти вещества оказывают преимущественно ингибирующее воздействие на продукцию люлиберина. Синтез гонадотропин-рилизинг-гормона (ГТ-РГ) стимулируют простагландины из группы Е и F2α [Ojeda S., McCann S., 1975].
Эпифиз - шишковидная железа - расположен в каудальной части III желудочка. Эпифиз имеет дольчатое строение и разделяется на паренхиму и соединительнотканную строму. Паренхима представлена клетками двух типов: пинеальными и глиальными. С возрастом количество клеток паренхимы уменьшается, увеличивается стромальная прослойка. К 8-9 годам в эпифизе появляются очаги обызвествления. Возрастную эволюцию претерпевает и сосудистая сеть, питающая эпифиз.
Вопрос об инкреторной функции эпифиза остается нерешенным. Из веществ, обнаруженных в эпифизе, наибольший интерес в плане регуляции гонадотропной функции представляют индольные соединения - мелатонин и серотонин. Эпифиз считают единственным местом синтеза мелатонина - производного серотонина, так как только в эпифизе найден специфический фермент гидроксииндол-о-метил-трансфераза, осуществляющий конечный этап его образования.
Ингибирующее влияние эпифиза на половую функцию доказано в многочисленных экспериментальных работах. Предполагается, что свою антигонадотропную функцию мелатонин реализует на уровне гипоталамуса, блокируя синтез и секрецию люлиберина. Кроме того, в эпифизе обнаружены и другие вещества пептидной природы с выраженным антигонадотропным действием, превышающим активность мелатонина в 60-70 раз [Benson S., 1972]. Функция эпифиза зависит от освещенности. В связи с этим не исключена роль эпифиза в регуляции суточных ритмов организма, в первую очередь ритмов тропных гормонов гипофиза.
Гипоталамус (подбугорье) - отдел промежуточного мозга, образует часть дна и боковые стенки III желудочка. Гипоталамус представляет собой скопление ядер нервных клеток. Многочисленные нервные пути связывают гипоталамус с другими частями мозга. Топографически выделяют ядра переднего, среднего и заднего гипоталамуса. В ядрах среднего и отчасти заднего гипоталамуса образуются рилизинг-гормоны (от англ. releasing - высвобождающийся)-вещества, регулирующие все тропные функции аденогипофиза. Одни из этих веществ играют стимулирующую роль (либерины), другие - ингибирующую (статины). Рилизинг-гормоны являются своеобразными универсальными химическими факторами, опосредующими передачу импульсов на эндокринную систему [Юдаев Н. А., 1976].
Гипоталамус осуществляет регуляцию половой (гонадотропной) функции посредством синтеза и секреции ГТ-РГ. Этот гормон впервые выделил из гипоталамуса свиней в 1971 г. A. Schally.
По структуре это декапептид. В настоящее время осуществлен синтез ГТ-РГ (люлиберина), который нашел широкое применение в диагностике и лечебной практике. В литературе существуют две точки зрения на природу ГТ-РГ. Так, по данным Н. А. Юдаева (1976), A. Arimura с соавт. (1973), существует один гипоталамический фактор, регулирующий выработку как ЛГ, так и фолликулостимулирующего (ФСГ) гормона, а в основе преобладающей чувствительности одного из них (ЛГ) к ГТ-РГ лежит различная чувствительность клеток аденогипофиза. В. Н. Бабичев (1981) предполагает, что кратковременное действие ГТ-РГ стимулирует выброс ЛГ, а для секреции ФСГ необходимо длительное воздействие ГТ-РГ в сочетании с половыми стероидами.
N. Bowers с соавт. (1973) выделили из гипоталамуса свиньи субстанцию, обладающую только ФСГ-РГ-активностью. Экспериментальные работы L. Dufy-Barbe с соавт. (1973) также свидетельствуют о существовании двух гипоталамических гормонов. В настоящее время большинство исследователей признают существование в гипоталамусе одного ГТ-РГ, стимулирующего выделение как ЛГ, так и ФСГ. Это подтверждается иммунологическими исследованиями и применением синтетического ГТ-РГ, способного стимулировать секрецию обоих гонадотропинов. Различие в сроках секреции этих гормонов модулируется концентрацией половых гормонов, главным образом эстрогенов, в гипоталамусе. Максимальная концентрация ГТ-РГ обнаружена в ядрах переднего гипоталамуса и срединного возвышения.
В гипоталамусе выделяют центры, осуществляющие тоническую секрецию гонадотропинов (к ним относятся нейроны аркуатной области), и центры, регулирующие циклическую секрецию гонадотропинов, расположенные в преоптической области гипоталамуса. Тонический центр секреции ГТ-РГ функционирует как в женском, так и в мужском организме, обеспечивая постоянное выделение гонадотропных гормонов, а циклический центр функционирует только в женском организме и обеспечивает ритмичный выброс гонадотропинов.
Дифференцировка типов регуляции гипоталамуса происходит в ранний период онтогенеза. Присутствие андрогенов является необходимым условием для развития регуляции по мужскому типу [Forest М., 1976; Faiman С., 1976]. Механизм влияния андрогенов на выключение преоптической области, возможно, связан с активацией рецепторов андрогенов до полного их насыщения [Kato J., 1974; Flerko В., 1974].
Половые стероиды заметно влияют на функцию гипоталамуса на всех этапах полового развития. Исследования последних лет показали, что половым стероидам (главным образом эстрогенам) принадлежит модулирующая роль в гипоталамо-гипофизарно-гонадном взаимодействии [Franchimont В., 1972; Stumpf W., Sar M., 1977]. Они осуществляют свое действие двумя путями\ при высоких концентрациях усиливая образование ГТ-РГ и сенсибилизируя гипофизарные клетки к стимулирующему действию ГТ-РГ [Бабичев В. Н., 1981], а при незначительных концентрациях - угнетая его синтез и секрецию [Ajika К., 1972]. Кроме того, половые стероиды изменяют чувствительность тонического центра к биогенным аминам. В итоге половые стероиды ритмически меняют уровень секреции ГТ-РГ нейронами гипоталамуса [Бабичев В. Н., Адамская Е. И., 1976].
В ядрах гипоталамуса имеется большое количество рецепт, торов к половым стероидам, главным образом к эстрадиолу. Кроме того, в гипоталамусе функционирует высокоактивная ферментная система, осуществляющая ароматизацию андрогенов и превращающая их в эстрогены. Таким образом, не только в женском, но и в мужском организме модулирующее действие половых стероидов на гипоталамус реализуется посредством эстрогенов.
Стимуляцию эндокринной функции половых желез гипоталамус осуществляет на уровне гипофиза, увеличивая синтез и секрецию его гонадотропных гормонов. Действие ГТ-РГ, как и всех пептидных гормонов, опосредовано активацией системы аденилатциклаза - цАМФ. цАМФ и цАМФ-зависимые протеинкиназы стимулируют синтез тропных гормонов гипофиза на уровне трансляции.
Гипофиз расположен в турецком седле и ножкой соединен с гипоталамусом и другими отделами ЦНС. Гипофиз имеет своеобразную портальную систему кровоснабжения, обеспечивающую непосредственную связь отделов гипофиза и ядер гипоталамуса. В плане регуляции половой функции наибольший интерес представляет передняя доля гипофиза, где вырабатываются гонадотропные гормоны, осуществляющие непосредственный контроль за функцией половых желез.
Непосредственно в регуляции половой системы принимают участие три тропных гормона гипофиза: ЛГ, ФСГ и пролактин. Несомненно, что и другие гипофизарные гормоны - тиреотропный (ТТГ), соматотропный (СТГ), адренокортикотропный, (АКТГ) также участвуют в регуляции половой функции, но их влияние в достаточной степени косвенно и мало изучено. В данной главе мы коснемся только трех тропных гормонов, в основном регулирующих функцию половых желез.
Синтез гонадотропных гормонов, ЛГ и ФСГ, осуществляется в базофильных клетках гипофиза ("дельта-базофилы"). По химическому строению гонадотропные гормоны являются гликопротеидами - сложными белками, содержащими около 200 аминокислотных остатков. Как ЛГ, так и ФСГ состоит из двух частей: α- и β-субъединиц; α-субъединицы идентичны в гонадотропных гормонах и, видимо, защищают их от разрушающего действия протеолитических ферментов [Панков Ю. А., 1976]. β-Субъединицы различны по структуре. Эта часть белковой молекулы имеет центры, связывающиеся с рецепторами органов-мишеней, и, следовательно, она определяет биологическую активность гормона. Действие гонадотропинов на половую систему сложно и разнонаправленно.
В женском организме ФСГ в процессе полового созревания вызывает рост и созревание фолликулов. Специфическое воздействие ФСГ на яичники заключается в стимуляции митоза фолликулярных клеток и синтеза ДНК в ядрах клеток. Кроме того, ФСГ индуцирует чувствительность гонад к воздействию ЛГ, обеспечивает нормальную секрецию эстрогенов. В половозрелом организме ЛГ служит основным стимулятором овуляции, обеспечивая разрыв фолликула, выход яйцеклетки и ее имплантацию в эндометрий. Физиологическое воздействие обоих гонадотропинов потенцируется и модулируется уровнем эстрогенов.
В мужском организме в период полового созревания ФСГ стимулирует рост и развитие гормонопродуцирующих интерстициальных клеток Лейдига. В подростковом и половозрелом возрасте ФСГ принадлежит основная роль в стимуляции сперматогенеза. Наряду с этим он обеспечивает рост и функционирование клеток Сертоли, предназначенных в основном для поддержания нормальных условий сперматогенеза. Секреция ФСГ в физиологических условиях подавляется ингибином - веществом белковой природы. Предполагают, что ингибин продуцирует клетки Сертоли.
ЛГ является основным гормоном, обеспечивающим стероидогенез. Под воздействием ЛГ в интерстициальных клетках Лейдига стимулируется синтез основного андрогена - тестостерона. Этот же гормон в физиологических условиях является основным ингибитором секреции ЛГ.
Синтез пролактина осуществляется базофильными клетками аденогипофиза. По химической структуре пролактин представляет собой простой белок, имеющий 198 аминокислотных остатков, а по строению и биологическим свойствам сходен с СТГ и соматомамматропином [Панков Ю. А., 1976]. Предполагают, что пролактин филогенетически более древний гормон, обеспечивающий рост и дифференцировку тканей у всех низших животных, а СТГ и соматомамматропин - новые гормоны, имеющие более локальный спектр действия у высших животных. Предшественником этих гормонов филогенетически является пролактин.
Физиологическое действие пролактина в женском организме чрезвычайно многогранно. В первую очередь пролактин участвует в сохранении и развитии желтого тела. Совместно с эстрогенами пролактин обеспечивает рост молочных желез, участвует в механизмах лактации. В растущем организме пролактин совместно с СТГ и тиреоидными гормонами обеспечивает рост и развитие тканей. В настоящее время обсуждается роль пролактина в становлении андрогенной функции адреналовой системы. Кроме того, предполагается, что в пубертате пролактин способствует увеличению концентрации рецепторов к ЛГ и ФСГ на мембранах клеток гонад. Пролактин является физиологическим ингибитором секреции гонадотропных гормонов в женском организме. В соответствии с этим любые проявления гиперпролактинемии в клинической практике сопровождаются гипогонадотропным гипогонадизмом.
Роль пролактина в мужском организме мало изучена. Единственным доказательством его эффекта является увеличение количества рецепторов к ЛГ под воздействием физиологических доз пролактина. В то же время установлено, что большие дозы пролактина уменьшают количество рецепторов к ЛГ [Purvis К., Honson V., 1978].
Механизм действия гонадотропных гормонов и пролактина заключается в связывании с рецепторами клеточных мембран с последующей цепью реакций, включающих активацию аденилатциклазы, образование цАМФ, активацию протеинкиназ с дальнейшим фосфорилированием ядерных белков на уровне транскрипции, заканчивающихся синтезом необходимых белков, в клетках органов-мишеней.
Периферический и тканевый уровни регуляции
Яичники являются основным источником половых гормонов в женском организме. Анатомически в яичнике выделяют два, слоя: корковый и мозговой. Корковая часть играет основную роль в гормонопродуцирующей и репродуктивной функции, мозговая часть содержит сосуды, питающие яичник. Корковый слой представлен клетками стромы и фолликулами. Необходимо отметить, что к моменту рождения яичники девочки имеют развитый корковый слой, который к половозрелому возрасту меняется незначительно. При рождении в яичнике девочки насчитывается от 300 ООО до 400 ООО примордиальных фолликулов, к пубертату число примордиальных фолликулов уменьшается до 40 000-60 000. Это связано с физиологической атрезией, рассасыванием части фолликулов в детском возрасте.
Примордиальный фолликул содержит яйцеклетку, окруженную одним рядом клеток фолликулярного эпителия (рис. 4). Рост примордиального фолликула выражается в увеличении рядов клеток фолликулярного эпителия (формирование так называемой зернистой оболочки - zona granulosa). Установлено, что первоначальные стадии роста примордиального фолликула (до 4 слоев эпителиальных клеток) автономны, гонадотропные гормоны в них не участвуют. Дальнейшее созревание фолликула требует участия ФСГ. Под воздействием этого гормона происходит дальнейшее увеличение слоев зернистой оболочки. Клетки зернистого эпителия вырабатывают жидкость, которая формирует полость фолликула. С этого момента гранулезные клетки начинают усиленно вырабатывать эстрогены. Фолликул на этой стадии зрелости носит название граафова пузырька. Вокруг него клетки стромы формируют внутреннюю и внешнюю оболочки (theca interna и theca externa). Клетки внешней оболочки, так же как и клетки стромы, являются источником андрогенов в женском организме.
![Рис. 4. Схематическое изображение различных стадий созревания фоликула в яичнике [DeGroot L. et al, 1979]. 1 - примордиальный фолликул; 2 - зернистая оболочка фолликула; 3 - внутренняя оболочка фолликула; 4 - граафов пузырек; 5 - белое тело; 6 - атретический фолликул; 7 - интерстициальная ткань; 8 - разорвавшийся фолликул; 9 - желтое тело; 10 - зародышевый эпителий; 11 - регрессирующее желтое тело; 12 - ворота яичника](pic/000004.jpg)
Рис. 4. Схематическое изображение различных стадий созревания фоликула в яичнике [DeGroot L. et al, 1979]. 1 - примордиальный фолликул; 2 - зернистая оболочка фолликула; 3 - внутренняя оболочка фолликула; 4 - граафов пузырек; 5 - белое тело; 6 - атретический фолликул; 7 - интерстициальная ткань; 8 - разорвавшийся фолликул; 9 - желтое тело; 10 - зародышевый эпителий; 11 - регрессирующее желтое тело; 12 - ворота яичника
В середине менструального цикла под воздействием гипофизарных гормонов, главным образом ЛГ, и эстрогенов граафов пузырек разрывается и яйцеклетка выходит в брюшную полость. На месте фолликула образуется желтое тело. Клетки зернистой оболочки гиперплазируются, накапливают желтый пигмент лютеин. При этом происходит не только их структурная деформация, но и изменение функции - они начинают сек- ретировать прогестерон. В течение 7-12 дней желтое тело претерпевает дегенеративные изменения, на его месте образуется рубцовое белое тело. В течение одного менструального цикла, как правило, созревает один фолликул, а все остальные фолликулы претерпевают атрезию. У младших девочек атрезия фолликула происходит без кистозных изменений, фолликулярная жидкость малых фолликулов рассасывается, полость фолликула зарастает соединительной тканью. Процесс кистозной атрезии фолликулов заключается в гиперплазии тека-лютеиновых клеток, обладающих гормональной активностью. В дальнейшем происходит облитерация фолликула. Процесс кистозной атрезии физиологичен для девочек пубертатного возраста, пока не происходит полноценного созревания фолликула.
В яичниках секретируются стероидные гормоны 3 групп: производные С-18-стероидов - эстрогены, производные С-19-стероидов - андрогены и производное С-21-стероидов - прогестерон. Гормонообразовательную функцию в яичниках обеспечивают различные клеточные элементы.
Эстрогены секретируются клетками внутренней оболочки и клетками гранулезного слоя фолликулов. Основным источником образования эстрогенов, как и всех стероидных гормонов, является холестерин. Под влиянием ЛГ происходит активация фермента 20а-гидроксилазы, способствующего отщеплению боковой цепи холестерина и образованию прегненолона. Дальнейшие этапы стероидогенеза в клетках внутренней оболочки протекают преимущественно через прегненолон (Δ5-путь), в клетках гранулезы - через прогестерон (Δ4-путь). Промежуточными продуктами синтеза эстрогенов в яичниках являются андрогены. Один из них - андростендион - обладает слабой андрогенной активностью, является источником эстрона (Э1), другой, тестостерон, обладает выраженной андрогенной активностью и является источником эстрадиола (Э2) (рис. 5). Полноценный синтез эстрогенов в яичниках осуществляется поэтапно. Андрогены синтезируются преимущественно клетками theca interna с высокой активностью 17а-гидроксилазы, обеспечивающей переход С-21-стероидов (прегненолон, прогестерон) в С-19- стероиды (андрогены). Дальнейший процесс синтеза эстрогенов-ароматизация С-19-стероидов и превращение их в С-18-стероиды (эстрогены) - происходит в клетках гранулезы, содержащих высокоактивную ароматазу. Процесс ароматизации С-19-стероидов контролируется ФСГ.
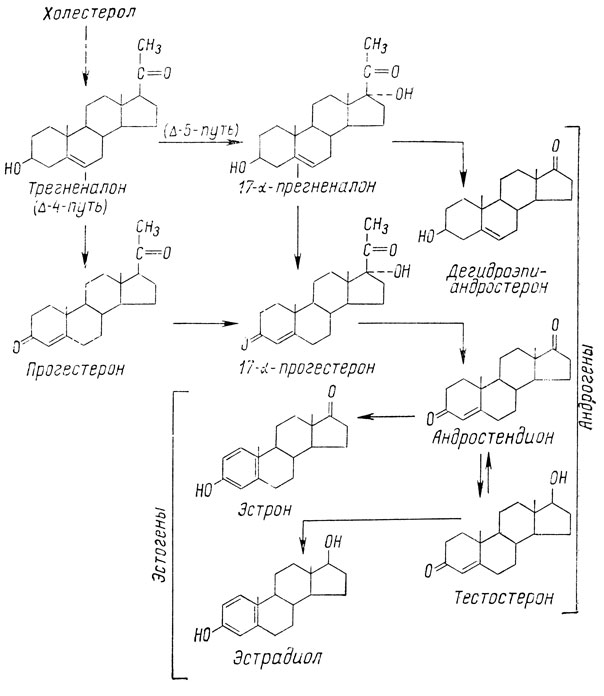
Рис. 5. Основные пути биосинтеза стероидных гормонов в яичниках
В физиологических условиях из яичников в кровь, кроме высокоактивных эстрогенов (Э2), поступает и незначительное количество андрогенов (андростендион, тестостерон). При патологии, когда нормальное взаимодействие двух этапов синтеза эстрогенов в яичниках нарушено, в кровь может поступать избыточное количество андрогенов. Кроме внутренней оболочки фолликула, синтезировать андрогены способны и другие клеточные элементы яичника: стромальные и интерстициальные клетки и тека-ткань коркового слоя, гилюсные клетки, расположенные у входа сосудов в яичник и по строению напоминающие клетки Лейдига в яичках. В физиологических условиях гормональная активность этих клеточных элементов невелика. Патологическая гиперплазия этих клеток может привести к резкой вирилизации организма.
Биосинтез прогестерона - С-21-стероида - осуществляется главным образом тека-лютеиновыми клетками желтого тела. В небольших количествах прогестерон могут синтезировать и тека-клетки фолликула.
В женском организме циркулируют 3 вида эстрогенов с различной биологической активностью. Максимальной активностью обладает эстрадиол, который обеспечивает основные биологические эффекты эстрогенов в организме. Эстрон, активность которого незначительна, вырабатывается в меньших количествах. Наименьшей активностью обладает эстриол. Этот гормон является продуктом превращения эстрона как в яичниках, так и в периферической крови. Около 90% эстрогенов циркулирует в кровяном русле в связанной с белками форме. Эта форма эстрогенов является своеобразным гормональным депо, предохраняя гормоны от преждевременного разрушения. Белки осуществляют также транспорт гормонов к органам-мишеням. Эстрогены связываются белком из класса β-глобулинов. Этот же белок является переносчиком тестостерона, поэтому в литературе он носит название "эстрадиол-тестостерон-связывающий глобулин" (ЭТСГ) или "половые стероиды связывающий глобулин" (ПССГ). Эстрогены стимулируют синтез этого белка, а андрогены подавляют, и концентрация ПССГ у женщин выше, чем у мужчин. Однако, кроме половых стероидов, синтез ПССГ стимулируется тиреоидными гормонами. Высокий уровень ПССГ наблюдается при таких патологических состояниях, как гипогонадизм, тиреотоксикоз, цирроз печени, тестикулярная феминизация. Эстрогены разрушаются в печени. Основным путем инактивации является гидроксилирование с последовательным образованием эстрогена с меньшей активностью (последовательность: эстрадиол→эстрон→эстриол). Установлено, что эстриол является основным метаболитом эстрогенов, выделяющимся с мочой.
Взаимодействие с клетками органов-мишеней эстрогены осуществляют путем непосредственного проникновения в клетку, связываясь со специфическими цитоплазматическими рецепторами. Активный гормон-рецепторный комплекс проникает в ядро, взаимодействует с определенными локусами хроматина и обеспечивает реализацию необходимой информации посредством синтеза специфических белков.
Биологическое действие стероидных гормонов яичников. Влияние эстрогенов на женский организм чрезвычайно многообразно. Прежде всего эстрогены являются регулятором секреции гонадотропинов, взаимодействуя с рецепторами на уровне гипоталамуса и гипофиза по принципу отрицательных и положительных обратных связей. Стимулирующее или ингибирующее влияние эстрогенов на секрецию гонадотропинов зависит от количества эстрогенов и их взаимодействия с прогестероном. Модулирующий эффект эстрогенов в отношении гипоталамо-гипофизарной системы обеспечивает цикличность выделения гонадотропных гормонов в ходе нормального менструального цикла.
Эстрогены являются основными гормонами, обеспечивающими формирование женского фенотипа (женское строение скелета, типичное распределение подкожного жирового слоя, развитие молочных желез). Они стимулируют рост и развитие женских половых органов. Под влиянием эстрогенов улучшается кровоснабжение матки, влагалища, молочных желез. Эстрогены влияют на строение эндометрия, вызывая пролиферацию желез, изменяя ферментную активность их клеток. Эстрогены стимулируют ороговение многослойного плоского эпителия влагалища, на чем основан один из методов определения эстрогенной активности-кольпоцитология. Кроме того, эстрогены непосредственно воздействуют на рост и развитие самих яичников в плане формирования и кровоснабжения фолликулов, повышения чувствительности фолликулярного аппарата к воздействию гонадотропинов, пролактина. Эстрогены также стимулируют рост молочных желез. Под их влиянием повышается кровоснабжение желез, усиливается рост секреторного эпителия.
Кроме специфического воздействия на клетки органов-мишеней, эстрогены дают общий анаболический эффект, способствуя задержке в организме азота, натрия. В костной ткани они усиливают процессы окостенения эпифизарных хрящей, что прекращает рост костей в постпубертатном периоде.
Основное физиологическое действие прогестерона в женском организме проявляется только в половозрелом возрасте. По действию на многие органы и системы прогестерон является антагонистом, реже синергистом эстрогенов. Прогестерон тормозит синтез и секрецию ЛГ, обеспечивая таким образом нарастание активности ФСГ в течение менструального цикла. Под влиянием прогестерона тормозятся пролиферативные процессы в матке и влагалище, усиливается деятельность секреторных желез эндометрия. Действие прогестерона на молочную железу заключается в стимуляции роста альвеол, образовании долек и протоков железы.
Прогестерону свойствен слабый катаболический эффект, он вызывает выделение натрия и жидкости из организма. Хорошо известна способность прогестерона повышать температуру тела, воздействуя на ядра гипоталамуса. На этом термогенном эффекте основано определение двухфазности менструального цикла (измерение базальной температуры).
Андрогены в женском организме обусловливают вторичное оволосение. Обладая мощным анаболическим влиянием, андрогены в пубертатном возрасте совместно с эстрогенами приводят к значительному ускорению роста, созреванию костной ткани. Определенную биологическую роль играет в препубертатном периоде повышение секреции андрогенов надпочечниками. Предполагают, что адреналовые андрогены в этот период стимулируют гипоталамус и становятся пусковым моментом для пубертатной перестройки гипоталамо-гипофизарно-гонадных взаимоотношений (гонадостат).
Яички выполняют репродуктивную и гормонопродуцирующую функцию в мужском организме. Яички - парный железистый орган, имеющий дольчатое строение. Соединительнотканные прослойки разделяют паренхиму яичка на 200-400 долек. Долька состоит из извитых и прямых канальцев. Стенки канальцев выстланы клетками семяобразующего эпителия - сперматогониями. Внутри семенного канальца сперматогонии разделены крупными фолликулярными клетками Сертоли. Эти клетки выполняют защитную роль, предохраняя половые клетки от разрушающего влияния аутоиммунных процессов. Кроме того, клетки Сертоли непосредственно участвуют в сперматогенезе. У мальчиков младшего возраста (до 5 лет) семенные канальцы не имеют просвета, их стенки выстланы клетками - предшественниками сперматогониев - гоноцитами. Активация роста и дифференцировка яичка начинаются с 6-7 лет. К этому возрасту полностью исчезают гоноциты, начинается размножение сперматогоний до стадии сиерматоцитов, появляется просвет в семенных канальцах, происходит дифференцировка клеток полового эпителия в клетки Сертоли.
Полноценный сперматогенез у мальчиков начинается в пубертатном возрасте. Созревание половых клеток - сперматозоидов - проходит много этапов. Из первичных половых клеток - сперматогониев путем митотического деления образуется новая категория половых клеток - сперматоциты. Сперматоциты проходят ряд стадий митотического деления, образуя клетки с гаплоидным набором хромосом - сперматиды. Конечный этап созревания половых клеток - сперматогенез. Это сложный процесс, включающий ряд стадий, результатом которых становится образование сперматозоидов. Физиологическими регуляторами сперматогенеза являются ФСГ, тестостерон и пролактин.
Внутрисекреторная (гормональная) функция яичек обеспечивается клетками Лейдига - крупными клетками неправильной формы, расположенными в межуточной ткани, занимая 10% ?объема гонады. Клетки Лейдига обнаруживаются в интерстициальной ткани в незначительном количестве сразу после рождения. К концу первого года жизни ребенка они почти полностью дегенерируют. Их количество вновь начинает нарастать у мальчиков 8-10 лет, к началу пубертата.
Индукция стероидогенеза в клетках Лейдига обусловлена oстимулирующим воздействием ЛГ. Под влиянием ЛГ происходит активация фермента 20а-гидроксилазы, обеспечивающего переход холестерина в прегненолон. В дальнейшем биосинтез андрогенов может идти двумя путями: прегненолон→оксипрегненолон дегидроэпиандростерон андростендион→тестостерон (Δ5-путь) и прегненолон→прогестерон 17-оксипрогестерон→андростендион→тестостерон (Δ4-путь). В семенниках тестостерон синтезируется главным образом через Δ4-путь, а синтез андрогенов в надпочечниках осуществляется в основном по Δ5-пути (рис. 6).
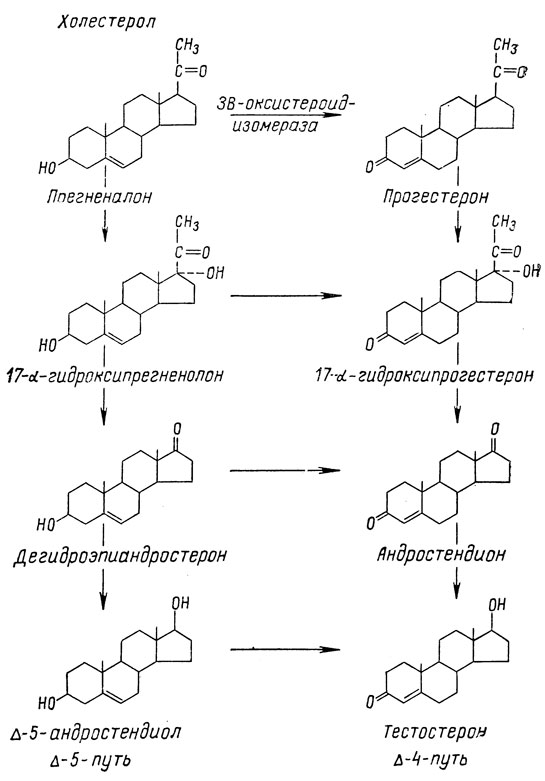
Рис. 6. Основные пути биосинтеза стероидных гормонов в яичках
Основным андрогеном в мужском организме является тестостерон. Он обладает наибольшей биологической активностью и обеспечивает основные андрогензависимые эффекты. Кроме тестостерона, в клетках Лейдига вырабатываются андрогены с меньшей биологической активностью: дегидроэпиандростерон и Δ4-андростендион. Однако основное количество этих слабых андрогенов образуется в сетчатой зоне надпочечников или служит продуктом периферического превращения тестостерона.
Кроме андрогенов, в яичках синтезируется и небольшое количество эстрогенов, хотя значительная часть эстрогенов в мужском организме образуется в результате периферического превращения андрогенов. Существует мнение об эстрогенпро- дуцирующей функции клеток Сертоли, особенно у мальчиков в препубертате и раннем пубертате. Возможность синтеза эстрогенов в клетках Сертоли обусловлена присутствием в них высокоактивной ароматазы. Секреторную активность клеток Сертоли стимулирует ФСГ.
В периферическом кровообращении тестостерон, так же как и эстрогены, оказывается связанным с белком из класса β-глобулинов (ПССГ). Связанные с белком андрогены неактивны. Такая форма транспорта и депонирования предохраняет андрогены от преждевременного разрушения в результате катаболических процессов в печени и других органах. В свободном состоянии оказывается около 2-4% андрогенов, которые и обеспечивают их основной биологический эффект. Инактивация тестостерона осуществляется в печени путем окисления группы ОН в положении 17 и восстановления кетогруппы в положении 3. При этом образуются неактивные соединения из группы 17-КС, выводящиеся с мочой.
Главными метаболитами тестикулярного тестостерона являются этиохоланолон, андростерон и эпиандростерон. Они составляют 1/3 общего количества выделяемых 17-КС. Основной метаболит андрогенов надпочечникового происхождения - дегидроэпиандростерон составляет около 2/3 общего количества выделенных 17-КС
Биологическое действие андрогенов. Механизм действия андрогенов на клетку органов-мишеней связан с образованием активного метаболита тестостерона - дигидро-тестостерона. Тестостерон превращается в активную фракцию непосредственно в клетке под воздействием фермента 5α-редуктазы. Дигидроформа способна связываться с белками-рецепторами в цитоплазме. Гормон-рецепторный комплекс проникает в ядро клетки, стимулируя в нем процессы транскрипции. Этим обеспечивается активация ферментных систем, биосинтез белков в клетке, что и обусловливает в конечном итоге влияние андрогенов на организм (рис. 7, 8).
![Рис. 7. Механизм действия андрогенов в клетке [Мейнуоринг У., 1979]. Т - тестостерон, 5а-ДНТ - активный внутриклеточный метаболит - 5а -дигидротестостерев; Rc - цитоплазмятический рецептор к андрогенам; 5а-ДНТ~Rc андроген-рецепторный комплекс, 5а-ДНТ~Rn - активный андрогенрецепторный комплекс, в ядре](pic/000007.jpg)
Рис. 7. Механизм действия андрогенов в клетке [Мейнуоринг У., 1979]. Т - тестостерон, 5α-ДНТ - активный внутриклеточный метаболит - 5α -дигидротестостерев; Rc - цитоплазмятический рецептор к андрогенам; 5α-ДНТ~Rc андроген-рецепторный комплекс, 5α-ДНТ~Rn - активный андрогенрецепторный комплекс, в ядре
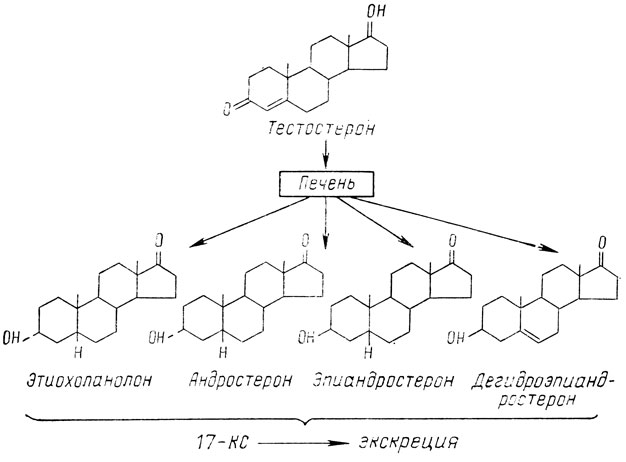
Рис. 8. Пути инактивации тестостерона в организме
Передача биологического действия андрогенов через образование дигидроформы обязательна не для всех видов клеток органов-мишеней. Так, образование 5α-дигидротестостерона не обязательно для осуществления анаболического эффекта андрогенов в скелетных мышцах, в процессах дифференцировки придатка яичка, семяпровода и семенного пузырька. В то же время дифференцировка урогенитального синуса и наружных половых органов протекает при высокой клеточной активности фермента 5α-редуктазы. С возрастом активность 5α-редуктазы снижается, и многие эффекты андрогенов могут реализоваться без образования активных дигидроформ. Эти особенности действия андрогенов делают понятными многие нарушения половой дифференцировки у мальчиков, связанные с врожденной недостаточностью 5α-редуктазы.
Биологическая роль андрогенов в формировании мужского организма чрезвычайно многообразна. В эмбриогенезе андрогены обусловливают дифферендировку внутренних и наружных гениталий по мужскому типу, формируя из вольфова протока придаток яичка, семявыносящий проток, семенные пузырьки,, из урогенитального синуса - предстательную железу, уретру и- из полового бугорка - наружные половые органы (половой член, мошонка, препуциальные железы). В период новорожденности андрогены, секретируемые в большом количестве в клетках Лейдига, возможно, продолжают начатый внутриутробно процесс половой дифференцировки гипоталамуса по мужскому типу, блокируя деятельность циклического центра.
В пубертате под влиянием андрогенов усиливаются рост и развитие половых органов, формируется вторичное оволосение по мужскому типу. Мощное анаболическое действие андрогенов. способствует развитию мускулатуры, скелета, дифференцировке костной ткани. Воздействуя на гипоталамо-гипофизарную систему, андрогены регулируют секрецию гонадотропных гормонов по принципу отрицательной обратной связи. В половозрелом возрасте тестостерон стимулирует сперматогенез, обусловливает мужской тип полового поведения.
|
ПОИСК:
|
© Анна Козлова подборка материалов; Алексей Злыгостев оформление, разработка ПО 2001–2019
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'