Глава 17. Задержки полового развития и мужской гипогонадизм (Сильницкий П.А.)
Задержки полового развития
Для оценки соответствия полового развития мальчика календарному возрасту приводим некоторые ориентировочные данные. Длина полового члена по дорсальной поверхности от корня головки без учета крайней плоти в состоянии покоя составляет в возрасте 11 лет (4±1) см, 12 лет (5±1) см, 13 лет (6± 1,5) см, 14-15 лет (7±2) см, 16 лет (8±1,5) см, 17 лет (9±2) см, 18 лет (10±2) см. Длина яичка составляет в возрасте 11 лет (1,5± ±0,5) см, 12 лет (2,0±0,5) см, 13 лет (2,5±0,5) см, 14лет (3±0,5) см, 15лет (4±0,5) см, 16-17 лет (4,5±0,5) см, 18 лет - (5±1) см. Для измерения размеров половых органов (длины, диаметра полового члена, окружности яичек) целесообразно пользоваться тестометром, предложенным А. Н. Демченко (рис. 69), или сравнивать размеры яичек путем сравнительной пальпации с соответствующим номером стандарта орхидометра (рис. 70). Размеры № 1 и 2 соответствуют яичкам детей допубертатного возраста (8 и 9-10 лет), № 3, 4 - мальчиков, вступивших в начальную стадию пубертатного периода (11-13,5 лет), № 5, 6, 7 и 8 - яичкам подростков, достигших соответственно III, IV и V стадий полового созревания.
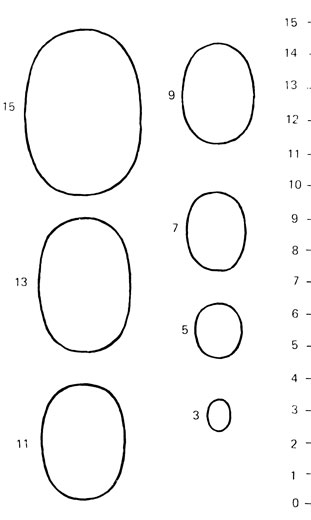
Рис. 69. Тестометр. Размеры указаны в сантиметрах
Необходимо учитывать также изменение пропорций тела. Оволосение лобка появляется с 12-летнего возраста, приобретает ромбовидную форму в возрасте 15-16 лет, а с 17 лет распространяется и на внутренние поверхности бедер. Появление волос над углами верхней губы начинается в среднем в 13-15-летнем возрасте, полное оволосение верхней губы - в возрасте 15-16 лет, оволосение щек и под нижней губой развивается в возрасте 17-18 лет.
Рис. 70. Орхидометр
Примерная схема для оценки соответствия соматополового развития мальчиков и подростков дает грубую клиническую ориентировку появления тех или иных признаков полового созревания в зависимости от возраста (табл. 2).
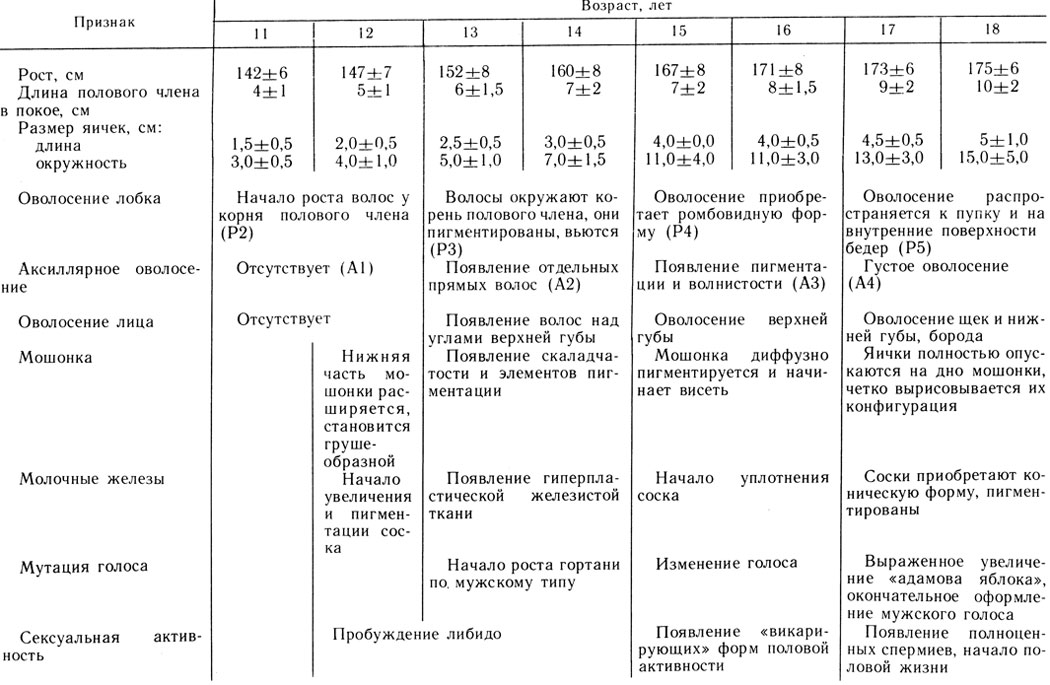
Таблица 2. Оценка соответствия соматополового развития календарному возрасту (По А. Н.Демченко, И. А. Черкасову. Диспансеризация и реабилитация лиц с задержкой мужского пубертата: Методические рекомендации Минздрава УССР и Харьковского НИИ эндокринологии и химии гормонов.-Харьков, 1978)
Запаздывание признаков полового развития на 2 года и больше рассматривается как задержка полового развития и требует также исключения гипогонадизма. Например, отсутствие увеличения яичек у мальчика старше 13,5 лет и оволосения лобка в возрасте 14,5 лет и старше может служить поводом для диагностики задержки полового развития. Она встречается у 0,8-2,5% детей и подростков [Бунак В. В., 1941; Уланова Л. Н. и др., 1981]. Ее можно рассматривать как пограничное состояние между нормальным развитием и гипогонадизмом. Несмотря на спонтанное, в более позднем возрасте, наступление пубертатного периода, многие мужчины, перенесшие задержку полового развития, страдают снижением potemtio coendi [Васильченко Г. С., 1983]. Исследования психиатров показали, что выраженное отставание в половом развитии в детском и подростковом возрасте может привести к психическим отклонениям [Лебедянская К. С., 1969; Маслов В. М., 1982]. Поэтому необходимо проводить лечение мальчиков и подростков с задержкой полового развития.
Причинами задержки полового развития могут быть конституциональные особенности полового созревания в некоторых семьях, перенесенные в прошлом асфиксия в родах, тяжелые инфекции, черепно-мозговые травмы; тяжелые токсикозы и другие заболевания и интоксикации у будущей матери во время беременности. Некоторые хронические заболевания (например, декомпенсированный сахарный диабет, порок сердца с хронической недостаточностью кровообращения), алиментарная дистрофия и, возможно, ожирение III степени могут приводить к задержке полового развития.
При этом у мальчика или подростка необходимо исследовать половой хроматин (а иногда и кариотип) и уровни ФСГ, тестостерона, пролактина (ПРЛ) в крови и экскрецию 17-КС с мочой за сутки. Среднее содержание ФСГ, ЛГ, тестостерона в сыворотке крови и 17-КС в моче у здоровых мальчиков и подростков разного возраста представлено в табл. 3. При наличии низких уровней ФСГ и ЛГ в крови для дифференцировки задержки полового развития от гипогонадизма проводится функциональная проба яичек [Скородок Л. М. и др., 1979]. После определения содержания тестостерона в сыворотке крови и экскреции 17-КС и мочой больному однократно внутримышечно вводят хорионический гонадотропин из расчета 2000 ЕД/м 2 поверхности тела. На следующий день и еще через 1 сут определяют уровень тестостерона в крови и исследуют экскрецию 17-КС с мочой за сутки. При большинстве форм задержек полового развития происходит увеличение содержания тестостерона в крови в 2-3 раза, а экскреции 17-КС с мочой - в 1,5 раза и более. В случае отсутствия подъема содержания тестостерона и 17-КС после однократного введения хорионического гонадотропина через 14-15 дней проводят пробу с внутримышечным его введением из расчета 1500 ЕД/м 2 поверхности тела в течение 3 дней подряд. У больных гипогонадотропным гипогонадизмом через 3 дня отмечается повышение уровня тестостерона в сыворотке крови на 30-50%, а у больных первичным гипогонадизмом повышения уровней тестостерона и 17-КС не происходит [Скородок Л. М. и др., 1977]. Результат функциональной пробы яичек желательно оценивать по динамике содержания тестостерона в крови, так как динамика экскреции 17-КС с мочой может быть недостаточно информативной.
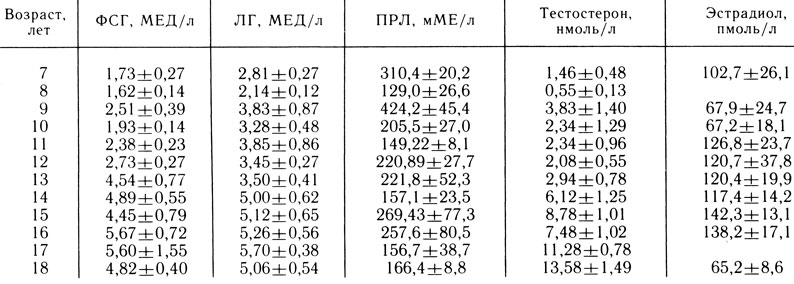
Таблица 3. Содержание гонадотропинов, пролактина, тестостерона и эстрадиола в сыворотке крови натощак у здоровых мальчиков и подростков
Л. М. Скородок и О. Н. Савченко (1984) выделили 4 основные формы задержки полового развития у мальчиков и подростков.
I форма ("конституционально-соматогенная") выражается в значительном запаздывании увеличения яичек, мошонки, полового члена, развития вторичных половых признаков, в сочетании с отставанием в физическом развитии и окостенении скелета. У таких мальчиков еще в допубертатном возрасте наружные половые органы маленькие, иногда имеется крипторхизм или псевдокрипторхизм, а после 13 лет отчетливо выявляются все признаки задержки полового развития. Выраженной диспропорциональности телосложения у этих мальчиков обычно не отмечается.
У мальчиков с задержкой полового развития I формы происходит замедленное созревание рецепторов яичек, что приводит к сниженному содержанию тестостерона при нормальных уровнях ЛГ и ФСГ (у 2/3 больных) в крови. В то же время примерно у 1/3 мальчиков с этой формой отмечается некоторое понижение уровня ЛГ в крови. Экскреция с мочой эпитестостерона преобладает над выделением тестостерона, что указывает на "инфантильный тип" стероидогенеза в яичках. Экскреция 17-КС с мочой понижена. Однако резервы стероидогенной функции семенников сохранены, однократное внутримышечное введение хорионического гонадотропина в дозе 2000 ЕД/м 2 поверхности тела приводит к значительному подъему уровня тестостерона в крови.
II форма задержки полового развития получила название ложной адипозогенитальной дистрофии, функционального адипозогенитального синдрома. Она характеризуется развитием ожирения, обычно еще в препубертатном возрасте, с феминизацией фигуры и ложной гинекомастией (отложение жира в области молочных желез) в пубертатном возрасте, выраженной задержкой полового развития (рис. 71). У подростков 15-16 лет получается гиноидно-евнухоидный тип телосложения. Нередко наблюдаются стрии розоватого цвета на коже в области груди, живота, бедер. У многих больных - нейроциркуляторная дистония гипертонического или гипотонического типа. Иногда рентгенологически выявляется гиперостоз внутренней пластинки лобной кости.
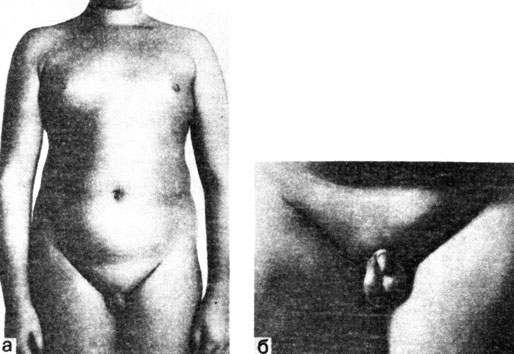
Рис. 71. Мальчик С, 14 лет, с задержкой полового развития II формы - с ложной адипозогенитальной дистрофией
В патогенезе этой формы задержки полового развития основное значение придают нарушению функции гипоталамо-гипофизарной системы. Средние уровни в крови ЛГ, ФСГ, тестостерона снижены, а содержание эстрадиола немного повышено. Однократное внутримышечное введение хорионического гонадотропина, 2000 ЕД/м 2 поверхности тела, приводит к значительному подъему уровня тестостерона в крови. Чувствительность половых желез у ЛГ у мальчиков со II формой задержки полового развития выше, чем у мальчиков с I формой.
III форма задержки полового развития (микрогенитализм, микропенис) характеризуется недоразвитием полового члена при удовлетворительных размерах яичек и почти своевременным появлением вторичных половых признаков. Размеры полового члена резко уменьшены, однако мошонка и яички - нормальных размеров и консистенции.
В патогенезе этой формы предполагается генетически детерминированное неполноценное гормонорецепторное взаимодействие тестостерона с тканями полового члена, что приводит к недостаточному развитию кавернозных тел и малым размерам полового члена. Содержание ЛГ, ФСГ, тестостерона в крови, повышение уровня тестостерона в ответ на однократное внутримышечное введение хорионического гонадотропина, 2000 ЕД/м 2 поверхности тела, экскреция 17-КС с мочой у больных с III формой задержки полового развития нормальные, а уровень пролактина в крови немного повышен.
IV форма задержки полового развития получила название синдрома неправильного (непоследовательного) пубертата [Скородок Л. М. и др., 1979]. Эта форма проявляется, с одной стороны, признаками гипаркортицизма - ускорением роста и дифференцировки скелета, ранним (в 8-10 лет) появлением полового оволосения, ожирением, нередко с розовыми стриями на коже и с другой стороны - значительным уменьшением размеров полового члена и яичек, иногда - псевдоретенцией яичек и даже крипторхизмом (рис. 72).
У этих мальчиков повышены уровни кортикотропина, кортизола и дегидроэпиандростерона в крови, однако суточный ритм секреции кортизола сохранен. Прием дексаметазона в суточной дозе 1 мг/м2 поверхности тела приводит к снижению экскреции 17-оксикортикостероидов (17-ОКС) с мочой ниже 2 мг/сут, что свидетельствует о функциональном характере гиперкортицизма, отличающегося от такового при болезни Иценко - Кушинга. У больных с IV формой задержки полового развития имеются значительное снижение уровня тестостерона, повышение ЛГ и снижение ФСГ в сыворотке крови при нормальном содержании пролактина. Коэффициент Л Г/тестостерон повышен, что указывает на снижение чувствительности половых желез к ЛГ. Однократное внутримышечное введение хорионического гонадотропина, 2000 ЕД/м2 поверхности тела, приводит к менее выраженному, чем при II форме задержки полового развития, подъему уровня тестостерона в крови. Факторами, снижающими чувствительность половых желез к стимуляции ЛГ, по-видимому, являются повышенные уровни дегидроэпиандростерона и кортизола в крови. Таким образом, при IV форме задержки полового развития (синдроме неправильного пубертата) у мальчиков имеются гиперфункция гипофизарноадреналовой системы и, по-видимому, связанная с ней дискорреляция в системе гипоталамус - гипофиз - половые железы. Избыток адреналовых стероидов может снижать чувствительность половых желез к ЛГ, с уменьшением синтеза тестостерона и реципрокным повышением уровня ЛГ. Однако возможен и центральный механизм действия дегидроэпиандростерона на уровне гипоталамуса или гипофиза с нарушением секреции ФСГ, у ¾ мальчиков с IV формой задержки полового развития к 17-18 годам происходят нормализация функций гипофизарно-адреналовой системы и половое созревание с установлением полноценной гормональной и гаметогенной функции яичек.
Лечение мальчиков и подростков с задержками полового развития. При наличии хронического истощающего заболевания необходимо адекватное его лечение (например, компенсация сахарного диабета, хронической недостаточности кровообращения и т. д.). Диета должна быть богата белками и витаминами, особенно А и Е, что усиливает эффекты эндогенных гонадотропинов и тестостерона. А. Н. Демченко рекомендует следующие схемы лечения. Аевит по 1 мл внутримышечно через день № 15, витамин Bi-5% раствор по 1 мл внутримышечно через день № 15, цинка сульфата 0,005 г с кальция глицерофосфатом, 0,2 г, в порошках 3 раза в день в течение 2 мес. Второй курс лечения: АТФ по 1 мл внутримышечно через день № 15, витамин Вб, 5% раствор, по 1 мл внутримышечно через день № 15, метил-андростендиол (0,01 г) с теофиллином (0,1 г) и глутаминовой кислотой (0,25 г) 2 раза в день в течение 30 дней.
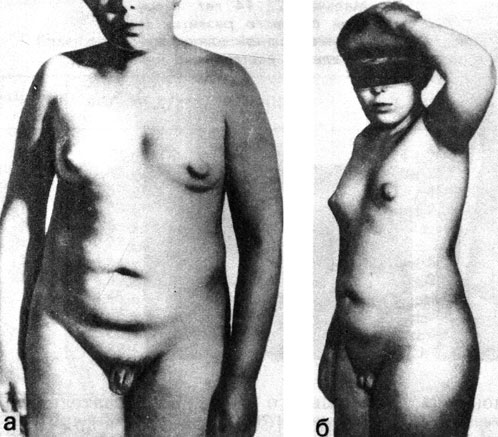
Рис. 72. Мальчик Н., 14 лет, с IV формой задержки развития - с синдромом неправильного пубертата
Если нет крипторхизма, то применение гонадотропных препаратов начинается обычно в возрасте старше 12 лет после достижения роста не менее 150 см. Лечение должно проводиться дифференцированно - в зависимости от формы задержки полового развития.
При I форме (с отставанием физического развития) необходимы питание с повышенным количеством белка, по ливитаминотерапия (ундевит и другие витаминные препараты), особенно витамины Е, А, В1, В12, нестероидные анаболические препараты, калия оротат. Проводятся курсы лечения анаболическими стероидными препаратами, например, ретаболилом по 25-50 мг внутримышечно 1 раз в 2 нед № 4-6 или метандростенолоном по 0,005 г 2 раза в день сублингвально после еды в течение 2 мес с 2-3-месячными перерывами между курсами.
Хорионический гонадотропин может применяться у подростков 15 лет и старше в небольших дозах - 1000-1500 ЕД внутримышечно 3 раза в неделю в течение 1 - 1½ мес. Продолжительное беспрерывное введение высоких доз хорионического гонадотропина больным с задержкой полового развития не рекомендуется, так как при этом может развиться гиалиноз семенных канальцев. При обнаружении увеличения щитовидной железы, сочетающегося с тенденцией к гиперхолестеринемии (более 5 ммоль/л) при нормальной пробе на толерантность к глюкозе, в комплекс лечения включают небольшие дозы тиреоидина (порядка 0,025-0,05 г/сут), подбор которых проводится под наблюдением эндокринолога.
При II форме задержки полового развития ("ложной адипозогенитальной дистрофии") обязательны диетическое лечение ожирения, при необходимости - с кратковременными курсами анорексигенных препаратов (фепранона, дезопимона), поливитаминотерапия. Необходимо добиться снижения массы тела до нормы. В возрасте 13-14 лет у старше проводится лечение хорионическим гонадотропином по 1500 ЕД внутримышечно 3 раза в неделю 1-2-месячными курсами с перерывами по 3-4 мес.
У подростков с III формой задержки полового развития (микропенисом) проводится курсовое лечение анаболическими стероидными препаратами в сочетании с поливйтаминотерапией, теофиллином (см. выше). Назначается ретаболил по 50 мг внутримышечно 1 раз в 2-3 нед № 4-6 или ментандростенолол (неробол) по 0,005 г 2 раза в день сублингвально в течение 11 /2-2 мес, или силаболин по 50 мг внутримышечно 1 раз в 2 нед № 4-6 с 3-4-месячными перерывами между курсами анаболических стероидных препаратов. Это лечение приводит к увеличению полового члена без выраженного ускорения дифференцировки скелета. У лиц 17 лет и старше, при наличии нормального роста, можно проводить лечение небольшими (чтобы не нарушить сперматогенез) дозами препаратов тестостерона или анаболическими стероидными препаратами. Предпринимаются попытки лечения микропениса препаратами человеческого соматотропина. Однако это лечение еще не разработано.
При IV форме задержки полового развития (по типу "синдрома неправильного пубертата") проводятся диетическое лечение ожирения, поливитаминотерапия, лечебная гимнастика, гидропроцедуры, направленные на нормализацию массы тела. Если, несмотря на снижение массы тела в возрасте старше 15 лет не отмечается прогрессирования пубертата, то показано лечение менопаузальным гонадотропином, с преимущественными фолликулостимулирующим действием по 75 ЕД в сочетании с хорионическим гонадотропином по 1500 ЕД внутримышечно 3 раза в неделю в течение 1-1 ½ мес, при необходимости - повторный курс лечения этими препаратами после 4-5-месячного перерыва. Л. С. Скородок (1981, 1984) сообщил о хорошем эффекте лечения подростков с IV формой задержки полового развития хорионическим гонадотропином и верошпироном.
Схема лечения: хорионический гонадотропин по 1000-1500 ЕД внутримышечно 2 раза в неделю № 10, далееверошпирон по 150 мг/м2 поверхности тела в течение 10 дней, интервал в течение примерно 11 /2 мес, после чего - новый курс лечения хорионическим гонадотропином и верошпироном. В результате двух курсов лечения хорионическим гонадотропином и верошпироном отмечены прогрессирующее развитие половых органов, вторичных половых признаков, повышение уровней ФСГ и тестостерона и снижение ЛГ в крови до нормы.
Отдельного рассмотрения требует крипторхизм - аномалия развития, при которой оба или одно яичко отсутствуют в мошонке. В неопустившихся яичках развиваются дегенеративные изменения, приводящие к нарушению как сперматогенеза, так и их гормональной функции. При крипторхизме значительно чаще, чем в яичках, находящихся в мошонке, развивается злокачественная опухоль яичка. До 4-летнего возраста дегенеративные изменения в неопустившихся яичках выражены нерезко; в возрасте 4-8 лет гистологические изменения в яичках при крипторхизме часто обратимы, а после 9 лет они заходят так далеко, что даже низведение в мошонку с последующим гормональным лечением зачастую не может восстановить функцию яичек.
Причинами одностороннего крипторхизма, если второе яичко опущено в мошонку и имеет нормальные размеры, обычно являются местные анатомические изменения - фиброзные пластинки, сращения в паховом канале или у его наружного отверстия. Лечение таких больных - хирургическое.
Двусторонний крипторхизм может быть одним из проявлений гипогонадизма или задержки полового развития. В зависимости от уровней гонадотропных гормонов в крови крипторхизм чаще бывает гипогонадотропным, но может быть нормогонадотропным и в гипергонадотропным [Зеленецкая В. С., Кураева Т. Л., 1981; Скородок Л. М. и др., 1981; Жуковский М. А. и др., 1982].
У больных с гипогонадотропным и нормогонадотропным крипторхизмом лечение проводится гонадотропными препаратами. Хорионический гонадотропин вводится внутримышечно в возрасте 3-5 лет по 250-400 ЕД, в 6-7 лет - по 500 ЕД, в 8-9 лет - по 1000 ЕД, в 10 лет и старше - по 1500 ЕД внутримышечно 3 раза в неделю, всего 15-30 инъекций. После опускания яичек в мошонку рекомендуется сделать еще 5-6 инъекций хорионического гонадотропина. Если яички не опустились в мошонку, то делают 3-месячный перерыв, после которого проводят второй курс лечения хорионическим гонадотропином в несколько больших (примерное 1,5 раза) разовых дозах. У больных гипогонадотропным крипторхизмом с дефицитом ФСГ проводится лечение менопаузальным гонадотропином по 75-150 ЕД и хорионическим гонадотропином по 2000 ЕД внутримышечно 2-3 раза в неделю в течение месяца. Если эффекта от двух курсов лечения нет, то в возрасте старше 4 лет необходимо хирургическое низведение яичек в мошонку.
Другим методом лечения гипогонадотропного (а иногда и нормогонадотропного) крипторхизма является применение препаратов гонадолиберина или его синтетических аналогов - криптокура и др. Гонадолиберин вводят мальчикам интраназально в пульсирующем режиме по 200 мкг 6 раз в сутки в течение 3-4 нед. Применение гонадолиберина в таких дозах для лечения крипторхизма у мальчиков 1 года - 5 лет оказалось примерно таким же эффективным, как лечение хорионическим гонадотропином по 1000 ЕД внутримышечно 3 раза в неделю.
Лечение гипергонадотропного крипторхизма - только хирургическое.
При задержке полового развития и гипогонадизме, сочетающихся с ожирением, существенное значение имеет лечение ожирения с помощью субкалорийной диеты. Имеются данные о повышении уровня эстрогенов в крови и о возможном усилении перехода тестостерона в эстрогены у мужчин с ожирением [Zumoff В. et al., 1981], поэтому диетическое лечение ожирения, приводящее к нормализации массы тела, способствует уменьшению андрогенной недостаточности.
Мужском гипогонадизм
Среди заболеваний половых желез у мужчин ведущее место занимает гипогонадизм - функциональная недостаточность половых желез. Различают первичный, гипогонадотропный, нормогонадотропный и "коррелятивный" гипогонадизм.
Первичный гипогонадизм развивается в результате непосредственного поражения яичек патологическим процессом и обычно сопровождается высоким уровнем гонадотропных гормонов в крови и моче - это гипергонадотропный гипогонадизм.
Гипогонадотропный гипогонадизм развивается вследствие нарушения секреции гонадотропных гормонов из-за поражения гипофиза (вторичный гипогонадизм) или чаще из-за поражения гипоталамуса (третичный гипогонадизм).
В основе нормогонадотропного гипогонадизма лежит как непосредственное поражение яичек, так и недостаточность секреции гонадотропинов.
Некоторые исследователи выделяют также "коррелятивный" гипогонадизм, при котором функции системы гипоталамус - гипофиз - половые органы страдают вследствие хронического заболевания с нарушениями метаболизма (декомпенсированный сахарный диабет, порок сердца с хронической недостаточностью кровообращения и др.).
Первичный гипогонадизм
Выделяют следующие формы первичного гипогонадизма: 1) анорхизм - врожденная атрофия яичек или идиопатическая постнатальная гипоплазия семенников; 2) гипогонадизм с преимущественным поражением гландулоцитов яичка; 3) гипогонадизм с преимущественным поражением канальцев - синдром Клайнфелтера (кариотип 47ХХ) и другие варианты, "ложный синдром Клайнфелтера с кариотипом 46XY, мужской гипогонадизм с кариотипом 46ХХ; 4) синдром неполной маскулинизации (Рейфенштейна); 5) синдром Шерешевского - Тернера у мужчин; 6) синдром Нунана; 7) первичное отсутствие герминативных клеток (синдром Дель Кастильо, или Сертоли-клеточный синдром); 8) первичный гипогонадизм вследствие травматических, лучевых, воспалительных поражений яичек у детей и взрослых.
Патогенез, клиническая картина и диагностика. Врожденный анорхизм - эмбриональная аномалия, характеризующаяся отсутствием или резкой гипоплазией яичек у нормальных по генотипу и фенотипу лиц мужского пола. Этиология заболевания не выяснена. Имеют значение тяжелые болезни или интоксикации у будущей матери во время беременности. У некоторых больных обнаруживаются антитела к ткани яичек, что позволяет предполагать роль аутоагрессии в патогенезе анорхизма и гипоплазии яичек. У некоторых больных атрофия яичек наступает в результате травмы наружных половых органов при рождении в ягодичном предлежании.
Так как яички подвергаются атрофии после 20 нед внутриутробной жизни, то половые протоки и наружные половые органы сформированы по мужскому типу. В то же время нормального развития кавернозных тел не происходит, головка полового члена, мошонка недоразвиты. Яички отсутствуют в мошонке, в паховых каналах, в брюшной полости (при операции). Однако в ряде случаев в мошонке обнаруживаются резко атрофичные яички в виде "катышков". В пубертатном периоде отмечается резкое недоразвитие вторичных половых признаков. Телосложение евнухоидное, иногда имеется ожирение с формированием гиноидных пропорций тела. Кожа у больных бледная, суховатая, иногда пастозная. Волосяной покров на голове густой, но волосы бедны пигментом. Мышечная сила снижена. У многих больных отмечаются нейроциркуляторная дистония гипотонического или гипертонического типа, головные боли, утомляемость, повышенная потливость. Интеллект у большинства больных высокий. Нередко они усиленно занимаются учебой, умственной работой, чтобы как-то "компенсировать" свой физический дефект. У некоторых больных первичным гипогонадизмом может развиться депрессивное состояние. Кариотип 46XY, половой хроматин отрицательный. Низкий уровень тестостерона и повышенное содержание ФСГ и ЛГ в сыворотке крови у мальчиков с синдромом анорхизма или гипоплазии яичек отмечаются с 6-7-летнего возраста, особенно выражены отклонения этих показателей у больных старше 14 лет. При анорхизме снижены концентрации тестостеронсвязывающего глобулина и эстрадиола в крови и наблюдается достаточная, а иногда и повышенная секреция надпочечниковых андрогенов, что частично компенсирует дефицит тестостерона в организме и обеспечивает некоторое развитие полового члена и отсутствие феминизации до пубертатного периода. В дальнейшем недостаточность тестостерона клинически выражена сильнее и приводит к развитию евнухоидизма.
У некоторых больных первичным гипогонадизмом уровень тестостерона в крови не снижен, а гипогонадизм обусловлен низкой чувствительностью к андрогенам на периферии [Демченко A. H., Сердечная Л. И., 1980; Демченко В. H., Беникова Е. А., 1980].
При атрофии или резкой гипоплазии одного яичка развивается монорхизм - одна из форм "легкого" первичного гипогонадизма, характеризующаяся некоторым отставанием в половом развитии, склонностью к ожирению. Однако по типу телосложения больных с монорхизмом существенно не отличаются от здоровых лиц. Средние уровни тестостерона в крови у детей, подростков и взрослых с монорхизмом несколько ниже, чем у здоровых. В то же время повышение содержания тестостерона в ответ на однократное введение хорионического гонадотропина, 2000 ЕД/м2 поверхности тела, у больных с монорхизмом - такое же, как и у здоровых лиц. У некоторых мальчиков и подростков с монорхизмом развивается стойкая тестикулярная недостаточность.
Первичный гипогонадизм с преимущественным поражением гландулоцитов яичка, или первичная недостаточность гландулоцитов яичка, - редкое заболевание, развивающееся вследствие повреждения яичек инфекционными, токсическими агентами, проникающей радиацией или вследствие генетически обусловленного недоразвития интерстициальных клеток. Клинически отмечается синдром евнухоидизма, яички небольших размеров, нередко плотноватые, половой член и мошонка недоразвиты. Секреция тестостерона резко снижена, что приводит к повышению уровня ЛГ. Содержание ФСГ в крови остается в пределах нормы, так как канальцы повреждены мало. Введение хорионического гонадотропина, 1500 ЕД/м2 поверхности тела, в течение 3 дней не приводит к повышению уровня тестостерона в крови и экскреции 17-КС с мочой.
Наиболее частой формой первичного мужского гипогонадизма является с и ндром Клайнфелтера. В среднем на каждых 500 мужчин - 1 больной этим синдромом, а из мужчин, страдающих бесплодием, - каждый пятый. Этиология этого заболевания остается неясной. Возможно, для нерасхождения половых хромосом в гаметогенезе или при митотическом делении зиготы имеют значение возраст матери (старше 35 лет), вирусная инфекция, интоксикации. Однако у большинства больных этих причин установить не удается.
Синдром обусловлен аномалией половых хромосом. У больных обнаруживаются различные варианты кариотипа: 47XXY; 47XXY/46XY; 48XXXY; 49XXXXY; 46XY/48XXXY и др. Из-за "лишней" ("лишних") X-хромосомы в период полового созревания развивается прогрессирующая гиалинизация семенных канальцев с атрофией зародышевого эпителия, что приводит к азооспермии и мужскому бесплодию -обязательному признаку синдрома Клайнфелтера. Фенотип - мужской.
Один из "крайних вариантов" синдрома Клайнфелтера - по внешнему виду нормальный мужчина правильного телосложения, с хорошим развитием вторичного оволосения, нормальными размерами полового члена, нередко ведущий половую жизнь и считающий, что у него нормальная потенция. При осмотре обнаруживаются маленькие яички (окружность обычно не более 10-11 мм), которые иногда бывают плотной консистенции. Второй "крайний вариант" синдрома Клайнфелтера - больной евнухоидного телосложения с почти полным отсутствием вторичного оволосения, маленькими яичками и половым членом нередко с крипторхизмом и гинекомастией. Подавляющее большинство больных с синдромом Клайнфелтера клинически находятся между этими "крайними вариантами" и имеют признаки андрогенной недостаточности.
Кроме нарушения развития половых желез, наличие "лишних" Х-хромосом приводит нередко к другим генетическим изменениям. У больных наблюдаются непропорционально малые размеры кисти, высокое небо, олигофрения. Нарушения психики чаще отмечается у больных, имеющим 3 или 4 X-хромосомы. У многих больных с синдромом Клайнфелтера обнаруживается небольшое диффузное увеличение щитовидной железы и имеются лабораторные данные в пользу легкого гипотиреоза - понижение содержания связанного с белками йода, повышение уровней холестерина и тиреотропина в крови.
Для лабораторного подтверждения диагноза синдрома Клайнфелтера существенное значение имеет обнаружение полового хроматина, соответствующего кариотипа (см. выше), повышенного содержания ФСГ и ЛГ, а начиная с пубертатного периода - несколько пониженного уровня тестостерона в крови. У некоторых больных повышено содержание эстрогенов в крови. В то же время у ряда больных с этим синдромом уровень тестостерона в крови нормальный, однако действие его на периферии снижено [Добровольская Л. М., 1987].
"Ложный" синдром Клайнфелтера отличается от "классических" вариантов заболевания только по кариотипу - 46XY. Описаны также больные с клинической картиной синдрома Клайнфелтера, но с кариотипом 46XX. Маскулинизация наружных половых органов у этих больных указывает на то, что внутриутробная дифференцировка первичной половой железы и половых протоков проходила под контролем Y-хромосомы. Но в дальнейшем ее не удается определить по невыясненной пока причине.
Синдром 47XYY диагностируется редко. Больные при этом отличаются высоким ростом, нередко значительной мышечной силой и сексуальной агрессивностью. В то же время у них выявляются симптомы легкого первичного гипогонадизма: маленькие плотные яички, олигоспермия, недостаточность вторичного оволосения.
Синдром неполной маскулинизации (Рейфенштейна) - очень редкое заболевание, характеризующееся постпубертатной атрофией яичек, иногда крипторхизмом, гипоспадией, недоразвитием полового члена, нередко гинекомастией. Кариотип - 46XY. Заболевание передается по наследству: внешне "здоровые" женщины рождают почти половину сыновей с этим заболеванием.
Крайне редкая и мало изученная форма первичного гипогонадизма - синдром Шерешевского-Тернера у мужчин. Некоторые авторы отождествляют его с синдромом Бонневи - Улльриха. Кариотип у больных может быть 46XY/45X; 45Х; 45X/46XY; 47XXY. Заболевание характеризуется низкорослостью, гипоплазией яичек с выраженной картиной гипогонадизма. Кроме того, наблюдаются соматические нарушения, свойственные синдрому Шерешевского - Тернера и у женщин: короткая шея, иногда со складками по боковым поверхностям, "бочкообразная" грудная клетка, аномалии развития кистей, ушных раковин, мочевыделительной и сердечно-сосудистой систем. У некоторых больных имеется олигофрения. При исследовании эякулята, если его удается получить, выявляется азо- или олигоспермия.
Синдром Нунан наследуется аутосомно-доминантно с низкой пенетрантностью гена и характеризуется кариотипом 46XY, множественными врожденными пороками развития, с частым наличием врожденного порока сердца и олигофрении. У больных с синдромом Нунан имеются более или менее выраженные симптомы гипогонадизма с недостаточной секрецией тестостерона и повышенным уровнем ЛГ, что указывает на первичное поражение яичек. Однако, гипогонадизм у больных с синдромом Нунан может быть обусловлен не только первичным поражением половых желез с резким снижением их чувствительности к гонадотропной стимуляции, но и результатом дисфункции гипоталамо-гипофизарной системы [Скородок Л. М., Савченко О. H., 1984].
Первичная герминативная аплазия яичек (Сертоли-клеточный синдром) впервые описана Дель Кастельо и соавт. в 1947 г. Кариотип - 46XY. По внешнему виду, физическому развитию, размерам полового члена и вторичным половым признакам больные не отличаются от здоровых мужчин. Эти больные обращаются к врачу по поводу бесплодия. При исследовании эякулята у них выявляется азооспермия, а при биопсии в ткани яичек обнаруживаются семенные канальцы, выстланные только сустентоцитами без зародышевого эпителия. Уровни тестостерона и гонадотропинов в крови при этом заболевании обычно нормальные. Причина повреждения герминативного эпителия у большинства больных неясна, хотя у некоторых больных развитие этого синдрома связывают с радиационными поражениями, переломами позвоночника, костей черепа.
Первичный гипогонадизм может быть результатом орхита, орхиэпидидимита и даже везикулита. Наиболее часто к первичному гипогонадизму приводит орхит или орхиэпидидимит при эпидемическом паротите. У подростков и взрослых мужчин, заболевших эпидемическим паротитом, выше вероятность развития орхита, чем у маленьких мальчиков. Атрофия яичек может быть следствием их туберкулезного поражения, травмы яичек с кровоизлияниями и воспалительным процессом, нарушения кровообращения вследствие перекрута их сосудов. При опухолях яичек приходится прибегать к кастрации больных, в результате которой развивается один из вариантов первичного мужского гипогонадизма. После кастрации в зрелом возрасте нередко отмечается так называемый посткастрационный невроз, с "приливами", головокружениями, слабостью, периодической тахикардией, болями в области сердца.
Лечение. Для суждения об эффекте лечения больных мужским гипогонадизмом необходимо оценить динамику клинических показателей: появление либидо, эрекций или учащение и усиление эрекций, появление эякуляций, поллюций, а у некоторых больных - возможность совершить coitus. Кроме регистрации динамики роста, массы тела, строения скелета, развития мышечной системы, распределения жировой клетчатки, специальное внимание уделяется оволосению лица, подмышечных областей, лобка. Измеряются длина полового члена по дорсальной поверхности и диаметр его головки в покое, длина и окружность яичек, для чего можно пользоваться тестометром системы А. Н. Демченко.
С какого возраста начинать лечение мальчиков, страдающих первичным гипогонадизмом? У тех больных, у которых уровень андрогенизации достаточен для удовлетворительного физического развития, формирования мужского типа телосложения и дифференцировки скелета, лечение препаратами тестостерона рекомендуется начинать в возрасте 15 лет и старше, так как применение высоких доз тестостерона в более раннем возрасте может привести к окостенению диаэпифизарных хрящей и прекращению роста. Но у многих мальчиков, страдающих первичным гипогонадизмом, дефицит андрогенов неблагоприятно отражается на развитии скелета, мышечной системы и размерах полового члена. У таких больных следует начинать терапию в более ранние сроки - 10-11 лет [Скородок Л. М., 1981].
При лечении больных допубертатного возраста используются анаболические стероиды с умеренной андрогенной активностью, но выраженным влиянием на рост, физическое развитие и размеры полового члена. Назначается ретаболил внутримышечно в дозе 30 мг/м2 поверхности тела 2 раза в месяц - всего 4-6 инъекций, с повторным курсом через 4-6 мес. Можно давать метандростенолон в дозе 5 мг/м2 поверхности тела в сутки в течение 2 мес, с повторными курсами через 2-3 мес. Можно лечить больных силаболином и другими анаболическими стероидными препаратами.
В возрасте 15-16 лет больным первичным гипогонадизмом, имеющим нормальный или высокий рост, назначаются обычные терапевтические дозы препаратов тестостерона. Целесообразно начинать и проводить лечение препаратами тестостерона пролонгированного действия, сустаноном-250 или омнадреном-250 по 1 мл внутримышечно каждые 4 нед, или тестостерона энантатом, тестэнатом по 200 мг внутримышечно 1 раз в 2-3 нед. Подбор доз препаратов тестостерона желательно проводить под контролем клинического эффекта и динамики содержания тестостерона в крови, добиваясь его повышения до уровня у здоровых лиц соответствующего возраста.
При лечении больных первичным гипогонадизмом старше 17 лет сустаноном-250 по 1 мл внутримышечно 1 раз в 4 нед наблюдаются постепенный рост полового члена, развитие вторичных половых признаков. Но эрекции обычно слабые и редкие, а уровень тестостерона в крови ниже уровня у здоровых мужчин. И только при введении сустанона-250 внутримышечно по 1 мл каждые 3 нед, наряду с нормальным уровнем тестостерона в крови, отмечается снижение исходно повышенного содержания ЛГ и ФСГ в крови до нормы.
После достижения необходимой степени маскулинизации для поддержания клинического эффекта сустанон-250 можно вводить по 1 мл внутримышечно 1 раз в 4 нед. Однако у большинства больных, ведущих половую жизнь, для поддержания potentio coendi приходится вводить сустанон-250 внутримышечно по 1 мл каждые 3 или даже 2 нед.
При отсутствии препаратов тестостерона пролонгированного действия лечение больных первичным гипогонадизмом может проводиться тестостерона пропионатом, который вводится внутримышечно по 25-50 мг 3 раза в неделю.
Метилтестостерон сублингвально не пригоден для лечения больных гипогонадизмом. Для поддержания нормального уровня тестостерона в крови необходим прием метилтестостерона по 200 мг каждые 8 ч [Fogh М. et al" 1978], что приводит не только к тяжелым изменениям функции печени, но может даже способствовать развитию рака печени [Goodman М. et al., 1977].
Хорошие клинические результаты с повышением уровня тестостерона в крови получены при применении тестостерона ундеканоата внутрь в дозах 120-200 мг/сут (по 40 мг 3-4 раза в день) в течение 2-3 мес [Maisey et al., 1981; Wu F. et al., 1982]. Хотя тяжелых поражений печени при лечении тестостерона ундеканоатом не отмечено, все же при длительном лечении целесообразно чередовать курсы тестостерона ундеканоата per os с периодами внутримышечного введения препаратов тестостерона пролонгированного действия.
Гипогонадотропный гипогонадизм
Основными формами мужского гипогонадотропного гипогонадизма являются:
1) идиопатический гипогонадотропный гипогонадизм, формирующийся в результате вредных воздействий на гипоталамоипофизарную систему в интранатальном и раннем постнатальном периоде;
2) адипозогенитальная дистрофия;
3) гипогонадизм с изолированным дефицитом Л Г (синдром "фертильных евнухов" Мак-Каллак - Пасквалини);
4) гипогонадизм с преимущественным (иногда изолированным) дефицитом ФСГ;
5) синдром Каллмена-Де Мерсье, или ольфакто-генитальный синдром;
6) гипогонадизм с понижением секреции ЛГ, ФСГ и АКТГ-синдром Мэдока;
7) синдром неполной маскулинизации с понижением секреции ЛГ, ФСГ и тестостерона;
8) гипогонадизм, связанный с тотальной недостаточностью гипофиза, например при гипофизарном нанизме, после гипофизэктомии, при опухолях гипофиза, при краниофарингиоме.
Этиология, патогенез, клиническая картина и диагностика. Этиология и д иопатического гипогонадотропного гипогонадизма не выяснена. Семейная предрасположенность встречается редко. Часто выявляются вредные воздействия в антенатальном или интранатальном периоде: производственные интоксикации, сердечно-сосудистые, эндокринные заболевания, нефропатии, прием некоторых препаратов (резерпина, этимизола) во время беременности, асфиксия плода, родовая травма и т. д. Идиопатический гипогонадотропный гипогонадизм может быть "вторичным", обусловленным поражением гипофиза, но чаще является "третичным", вызванным повреждением гипоталамуса.
В клинической картине необходимо отметить раннее появление евнухоидизма. Яички маленькие, чаще мягковатой консистенции, мошонка недоразвита, нередко наблюдается псевдоретенция яичек, половой член недоразвит, вторичные половые признаки отсутствуют даже в 16-летнем возрасте. Жировая клетчатка развивается по женскому типу, с отложением жира в области молочных желез, соски которых нередко втянуты. Истинная гинекомастия встречается редко. Патологических отклонений глазного дна, полей зрения и при рентгенографическом исследовании черепа и турецкого седла, как правило, не выявляется.
Уровни ФСГ, ЛГ, тестостерона в крови низкие. При функциональной пробе яичек выявляется небольшое (на 30-50%) повышение уровня тестостерона в крови после 3-дневного введения хорионического гонадотропина, 1500 ЕД/м2 поверхности тела в сутки.
Адипозогенитальная дистрофия клинически отличается от идиопатического гипогонадотропного гипогонадизма только гиноидным телосложением и выраженным ожирением с распределением жира по женскому типу. У многих больных наблюдаются нейроциркуляторная дистония, тенденция к гиперхолестеринемии. При определении гонадотропинов, тестостерона при проведении функциональной пробы яичек с хорионическим гонадотропином получаются такие же результаты, как и у больных идиопатическим гипогонадотропным гипогонадизмом.
Гипогонадотропный гипогонадизм с изолированным (или преимущественным) дефицитом ЛГ был впервые описан Пасквалини в 1950 г. Вследствие врожденного нарушения секреции ЛГ резко снижается выработка тестостерона и развивается клиническая картина андрогенной недостаточности различной степени, вплоть до евнухоидизма. Крипторхизм и гинекомастия наблюдаются редко. Сперматогенез сохранен, но при исследовании эякулята отмечаются малый его объем, олигозооспермия, снижение подвижности спермиев, резкое уменьшение концентрации фруктозы, что можно связать с андрогенной недостаточностью. Термин "синдром фертильных евнухов", употребляемый в отношении этих больных, представляется неправильным, так как potentio coendi и соответственно фертильность у этих больных отсутствуют. Содержание ЛГ и тестостерона в крови у больных значительно понижено, ФСГ - в пределах нормы.
Гипогонадотропный гипогонадизм с преимущественным (или изолированным) дефицитом ФСГ приводит к недоразвитию стромы, канальцев яичек, к нарушению сперматогенеза. У многих больных несколько снижена секреция тестостерона и имеются слабовыраженные проявления андрогенной недостаточности. У детей и подростков обращается внимание на малые размеры яичек, более позднее и скудное развитие вторичного оволосения. Однако большинство мужчин, страдающих гипогонадотропным гипогонадизмом с дефицитом ФСГ, имеют нормальное телосложение, хорошее развитие мускулатуры, удовлетворительное вторичное оволосение, нормальные размеры полового члена и ведут половую жизнь. Обращаются они к врачу обычно по поводу бесплодия. При осмотре выявляются уменьшенные в размерах яички (окружность яичка обычно не больше 11-12 мм). Кариотип 46XY. При исследовании эякулята обнаруживаются различные изменения - от азооспермии до олигоспермии, со значительным уменьшением количества зрелых спермиев и их подвижности.
Уровень ФСГ в крови - низкий, содержание ЛГ и тестостерона - нормальное или немного пониженное. После 3-дневного введения хорионического гонадотропина, 1500 ЕД/м2 поверхности тела в сутки, отмечается увеличение содержания тестостерона примерно в 1,5 раза.
Синдром Каллмена-де Мерсье (ольфакто-генитальный синдром) - "семейная" форма гипогонадотропного гипогонадизма, передается аутосомно-рецессивным путем.
У больных имеется врожденный дефект развития гипоталамуса с дефицитом гонадолиберина и формированием гипогонадотропного гипогонадизма. Кроме того, поражается обонятельный анализатор. Клинически имеется евнухоидизм, иногда с крипторхизмом, как правило, с гипосмией или аносмией, иногда с дальтонизмом, снижением слуха и другими врожденными дефектами - расщеплением верхней губы, неба и др. Кариотип 46XY. Уровни ФСГ, ЛГ и тестостерона в крови значительно понижены. В то же время у многих больных с синдромом Каллмена введение синтетического гонадолиберина не приводит к повышению содержания гонадотропных гормонов в крови, что не позволяет исключить гипофизарный генез заболевания.
Небольшое нарушение обоняния довольно распространено при различных формах гипогонадизма, особенно гипогонадотропного. Однако только при синдроме Каллмена-де Мерсье гипосмия может достигать значительной степени, вплоть до аносмии.
Синдром Мэдока - результат первичного поражения гипоталамо-гипофизарной системы неизвестной этиологии. У больных развиваются гипогонадотропный гипогонадизм и вторичная хроническая недостаточность надпочечников: слабость, понижение аппетита, артериальная гипертензия, склонность к гипогликемическим состояниям, преждевременному старению. Заболевание хроническое, прогрессирует медленно, и выраженная клиническая картина обнаруживается обычно в постпубертатном возрасте. Кариотип 46XY. Уровни ФСГ, ЛГ, тестостерона, кортикотропина (АКТГ) и кортизола в крови значительно понижены; экскреция 17-KC и 17-OKC с мочой - низкая.
Синдром Лоренса - Муна - Бидля характеризуется гипогонадотропным гипогонадизмом, олигофренией, задержкой роста, нередко ожирением, наличием пигментного ретинита, шестипалости и других дефектов развития.
Лечение больных гипогонадотропным гипогонадизмом направлено на стимуляцию половых желез и, при возможности, на восстановление функции всей гипоталамо-гипофизарно-гонадной системы. Оно проводится гонадотропными препаратами и препаратами гонадолиберина.
Наилучший эффект лечения хорионическим гонадотропином, обладающим преимущественно ЛГ-активностью, получается при лечении больных гипогонадотропным гипогонадизмом с дефицитом обоих гонадотропинов или с преимущественным дефицитом ЛГ.
У больных с дефицитом ФСГ показано сочетанное применение менопаузального гонадотропина, обладающего выраженной ФСГ-активностью, и хорионического гонадотропина. У этих больных могут быть применены гонадотропные препараты, содержащие менопаузальный гонадотропин и хорионический гонадотропин, например пергонал.
Лечение должно начинаться как можно раньше. Уже у 5-7-летних детей проявляются генитальные и экстрагенитальные признаки гипогонадизма, а уровень тестостерона в крови значительно ниже, чем у здоровых мальчиков соответствующего возраста. У детей с гипогонадотропным гипогонадизмом допубертатного возраста проводится лечение хорионическим гонадотропином в дозе 1000 ЕД/м2 поверхности тела внутримышечно 2 или 3 раза в неделю полуторамесячными курсами. Эти дозы вызывают увеличение яичек, мошонки, полового члена, но не приводят к формированию вторичных половых признаков. Секреция тестостерона возрастает, но его уровень в крови остается ниже того, который обеспечивает появление вторичных половых признаков. Контроль за динамикой содержания тестостерона в крови позволяет предотвратить возможное ускоренное половое развитие, вызванное хорионическим гонадотропином. У мальчиков допубертатного возраста количество повторных курсов лечения хорионическим гонадотропином - 2-3 в год.
У больных, достигших пубертатного возраста, дозы хорионического гонадотропина составляют 1500 ЕД/м2 поверхности тела внутримышечно 3 раза в неделю 2-2 ½-месячными курсами.
Длительное беспрерывное (более 3 мес) введение хорионического гонадотропина нежелательно в связи с возможным резким снижением эффекта из-за выработки антител к нему.
У больных гипогонадотропным гипогонадизмом в возрасте старше 17 лет применение малых доз хорионического гонадотропина - до 1500 ЕД внутримышечно 3 раза в неделю, как правило, неэффективно. Таких больных приходится лечить этим препаратом в дозах 3000 ЕД 3 раза в неделю 2-3-месячными курсами, с перерывами по 3-4 мес между курсами. Такое лечение у большинства больных дает отчетливый клинический эффект, небольшое увеличение яичек; увеличение полового члена, появление или усиление, или учащение эрекций, развитие вторичных половых признаков. Во время курсов лечения хорионическим гонадотропином содержание тестостерона в крови повышается до его уровня у здоровых лиц. В перерывах между курсами, как правило, содержание тестостерона в крови вновь снижается, эрекции ослабевают или прекращаются.
У больных гипогонадотропным гипогонадизмом с преимущественным дефицитом ФСГ начинают комбинированное лечение менопаузальным гонадотропином по 75 ЕД и хорионическим гонадотропином по 1500 ЕД внутримышечно 3 раза в неделю. При отсутствии достаточного эффекта через 3-4 нед дозы препаратов повышают, вводя менопаузальный гонадотропин по 150 ЕД и хорионический гонадотропин по 2000 ЕД внутримышечно 3 раза в неделю. Длительность каждого курса лечения гонадотропными препаратами - 2-21 /г мес. Во время такого лечения, как правило, наблюдается временный терапевтический эффект: увеличение размеров яичек, полового члена, появление или усиление эрекций, у некоторых больных - поллюций. Уровень тестостерона в крови повышается. У ряда больных улучшается состав эякулята: увеличиваются количество, подвижность спермиев, концентрация фруктозы. Однако после прекращения введения гонадотропных препаратов у многих больных через 2-3 нед эрекции становятся реже или прекращаются.
Для развития и функционирования системы гипоталамус - гипофиз - яички необходим достаточный уровень андрогенов в крови. Имеются данные о роли андрогенов в увеличении рецепторов гландулоцитов яичек к ЛГ. Поэтому в перерывах между курсами лечения гонадотропными препаратами целесообразно применение малых доз препаратов тестостерона: метилтестостерона по 10 мг сублингвально 2-3 раза в день или тестостерона пропионата по 10-25 мг внутримышечно 2-3 раза в неделю, или сустанона-250 (омнадрена-250) внутримышечно по 0,5-1 мл 1 раз в месяц. Вместо тестостерона может быть проведено лечение анаболическими стероидными препаратами с малой андрогенной активностью - ретаболилом по 50 мг внутримышечно 2 раза в месяц, метандростенолоном по 5 мг сублингвально 1-2 раза в день.
Итак, лечение больных гипогонадотропным гипогонадизмом в возрасте 17 лет и старше малыми дозами хорионического гонадотропина (до 1500 ЕД внутримышечно 3 раза в неделю), как правило, неэффективно. Применение высоких его доз (3000 ЕД внутримышечно 3 раза в неделю) или сочетание его с менопаузальным гонадотропином дает временный вирилизирующий эффект. У многих больных гипогонадотропным гипогонадизмом после 5-6 двухмесячных курсов лечения гонадотропными препаратами их последующее применение не дает клинического эффекта. Приходится переходить на терапию сустаноном-250 по 1 мл внутримышечно каждые 3 нед, что оказывает нарастающее вирилизирующее действие. Лечение больных гипогонадотропным гипогонадизмом гонадотропными препаратами у многих не приводит к стойкой стимуляции системы гипоталамус - гипофиз - половые железы.
В то же время у отдельных больных гипогонадотропным гипогонадизмом после длительного (30-50 нед) лечения гонадотропными препаратами удается добиться сексуального развития со сперматогенезом и ремиссией гипогонадизма.
Ввиду того, что гипогонадотропный гипогонадизм у большинства больных обусловлен поражением гипоталамуса, для лечения этих больных применяют препараты гонадолиберина (гонадотропин-рилизинг-гормона, ЛГ-ФСГ-релизинг гормона). Эти препараты вводятся разными путями и в разных дозах: интраназально по 200 мкг в каждую ноздрю 6 раз в сутки [Spona, 1979; Hadziselimovic F. et al., 1982], внутривенно no 2 мкг 16 раз в сутки [Delemarre et al., 1983], с помощью инфузионного насоса через катетер в подкожную жировую клетчатку брюшной полости [Skarin G. et al., 1982]. Наибольшее распространение получил метод интраназального введения препаратов гонадолиберина или его синтетических аналогов в дозах 20-250 нг/кг массы тела каждые 2-3 ч в течение до 10 нед, в чередовании с 2-месячными курсами лечения гонадотропными препаратами. Такое лечение позволило добиться у многих больных гипогонадотропным гипогонадизмом хороших клинических результатов, вплоть до нормализации сперматогенеза. Следует подчеркнуть, что препараты гонадолиберина необходимо применять в "пульсирующем" режиме введения (иногда - короткими курсами по 3-4 дня с 3-дневНыми интервалами), так как беспрерывное длительное введение синтетических аналогов гонадолиберина приводит к снижению секреции гонадотропинов и тестостерона и используется для лечения детей и подростков с преждевременным половым созреванием центрального генеза [Comite F. et al., 1986; Roger M. et al., 1986].
Нормотропный гипогонадизм
Нормотропный гипогонадизм у мужчин изучен мало. Кариотип 46XY. В его развитии у мальчиков имеют значение тяжелые токсикозы и другие заболевания будущей матери во время беременности, родовая травма. Однако у многих больных патогенез не выяснен. У больных нормотропным гипогонадизмом содержание ФСГ и ЛГ в крови нормальное, а уровень тестостерона очень низкий, с монотонной его секрецией в течение суток. В то же время уровень эстрадиола у этих больных нормальный или немного повышенный, что объясняется более интенсивным превращением тестостерона в эстрадиол на периферии и может быть следствием увеличенной выработки эстрогенов клетками канальцев. Введение хорионического гонадотропина в дозе 1500 ЕД/м2 поверхности тела внутримышечно в течение 3 дней приводит к нарастанию концентрации тестостерона в крови, но этот прирост менее выражен, чем у больных идиопатическим гипогонадотропным гипогонадизмом. При нормотропном гипогонадизме яички не способны адекватно ответить на физиологическую стимуляцию, а на уровне гипоталамо-гипофизарной системы нарушен механизм обратной связи.
Клинически больные нормотропным гипогонадизмом - нормального роста; пропорции телосложения у них гиноидные, нередко имеется ожирение. Яички маленькие, плотные, нередко наблюдается их псевдоретенция, мошонка маленькая. Размеры полового члена значительно уменьшены. Вторичное оволосение - скудное. У многих больных отмечается нейроциркуляторная дистония, чаще гипертонического типа. У части больных есть гиперостоз внутренней пластинки лобной кости и признаки повышения внутричерепного давления (рис. 73).
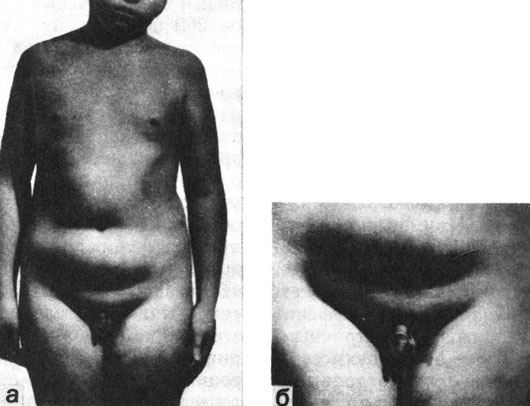
Рис. 73. Мальчик П., 14 лет. Нормогонадотропный гипогонадизм
Лечение больных нормотропным гипогонадизмом проводится хорионическим гонадотропином по 3000-4000 ЕД внутримышечно 3 раза в неделю или менопаузальным гонадотропином, 150 ЕД в сочетании с хорионическим гонадотропином, 3000 ЕД внутримышечно 3 раза в неделю, - 2-272-месячными курсами. Применение высоких доз гонадотропных препаратов оправдано низкой чувствительностью яичек к гонадотропинам. Широко применяются анаболические стероидные препараты, стимулирующие гонадотропную активность и повышающие чувствительность яичек к гонадотропинам. В перерывах между курсами гонадотропных препаратов проводится лечение препаратами тестостерона. Лечение больных нормогонадотропным гипогонадизмом препаратами гонадолиберина еще не разработано.
В последние годы описаны мужчины с изолированным повышением уровня ФСГ в крови, при нормальном содержании ЛГ, сочетавшемся с уменьшением частоты импульсов выбрасывания гонадолиберина, снижением уровня тестостерона в крови и олигозооспермией. Лечение этих больных гонадолиберином по 5 мкг подкожно каждые 2 ч (в импульсном режиме) в течение 6 нед привело к снижению уровня ФСГ, возрастанию содержания тестостерона в крови и улучшению состава эякулята [Gross J. et al., 1985; Honigl W. et al., 1986].
Нормальный уровень пролактина в крови необходим для поддержания чувствительности яичек к гонадотропинам, усиления секреции тестостерона и нормальной реакции периферических половых органов на тестостерон. Но при гиперпролактинемии нарушается превращение тестостерона в дигидротестостерон в периферических тканях, повышается связывание тестостерона с глобулином, нарушается стимулированная ЛГ секреция тестостерона, уменьшается секреция ФСГ, нарушается механизм обратной связи между уровнем эстрогенов и секрецией гонадотропинов.
У больных с пролактиномой отмечена атрофия гландулоцитов яичка при сохраненных семенных канальцах. В представлениях о механизмах действия пролактина имеются противоречия: рецепторы его в яичках у человека обнаружить не удалось, а стимулированная тиреолиберином секреция пролактина у больных гипогонадотропным гипогонадизмом оказалась такой же, как у здоровых лиц. В то же время при олигоспермии находили гиперпролактинемию у 4-40% обследованных больных.
Следует различать пролактиномы у мужчин и небольшую гиперпролактинемию при гипотиреозе, сахарном диабете, акромегалии, болезни Иценко - Кушинга, приеме лекарственных препаратов - аминазина, галоперидола, амитриптилина, имипрамина, резерпина и некоторых других.
Клиническая картина пролактиномы, развивавшейся в детском или подростковом возрасте, характеризуется симптомами задержки полового развития, головными болями, изменениями высшей нервной деятельности неврозоподобного типа, иногда гинекомастией. При развитии пролактиномы в постпубертатном периоде резко снижается potentio coendi, уменьшается либидо, появляется олигозооспермия, у некоторых больных - гинекомастия.
Иногда пролактинома достигает больших размеров, наблюдаются увеличение турецкого седла, нарушение структуры его стенок, изменения на глазном дне и даже битемпоральная гемианопсия. Большинство же пролактином - маленькие аденомы без изменений турецкого седла, глазного дна и полей зрения. Решающую роль в диагностике играет повторное определение пролактина в сыворотке крови, содержание его обычно выше 1000 мкМЕ/мл.
При подтверждении диагноза пролактиномы, если опухоль располагается интраселлярно, рекомендуется облучение гипофиза пучком протонов или телегамматерапия, иногда с предварительным лечением парлоделом. При больших размерах пролактиномы, особенно при экстраселлярном ее росте, показано оперативное удаление опухоли.
Другим методом лечения небольшой интраселлярно расположенной пролактиномы является применение бромкриптина-парлодела или других препаратов, снижающих секрецию,- пролактина-метерголина, мезулергида, 1-ДОФА в сочетании с тиреоидными препаратами.
Подбор дозы парлодела начинают с 2,5 мг на ночь, и при необходимости дозу препарата увеличивают до 5-10 мг/сут под контролем за динамикой уровня пролактина в крови. Большая часть дозы парлодела дается в вечерние часы, с учетом кривой секреции пролактина в течение суток. Наряду с подавлением секреции пролактина, парлодел приводит к дальнейшему снижению уровня ФСГ, а нередко и к некоторому понижению содержания ЛГ и тестостерона в крови. Поэтому, подобрав минимальную дозу парлодела, при которой сохраняется нормопролактинемия, нужно сочетать лечение парлоделом с препаратами гонадолиберина в "пульсирующем" режиме, чередуя их с курсами лечения менопаузальным и хорионическим гонадотропинами. Такая терапия у взрослых больных приводит к нормализации уровней ФСГ, ЛГ, тестостерона в крови, улучшению состава эякулята и хорошей potentio coendi.
У взрослых больных, нуждающихся только в поддержании potentio coendi, можно проводить сочетанное лечение парлоделом и сустаноном-250 (омнадреном-250) внутримышечно.
Нарушения половой функции при некоторых эндокринных заболеваниях
При длительно декомпенсированном сахарном диабете, начавшемся в детском возрасте, иногда развивается синдром, характеризующийся задержкой роста, гепатомегалией вследствие жировой инфильтрации печени и задержкой полового развития (синдром Мориака при преимущественном отложении подкожной жировой клетчатки в области лица и туловища или синдром Нобекура - при общем истощении). Задержка полового развития у этих больных идет со сниженной секрецией гонадотропинов. Адекватная инсулинотерапия с достижением и сохранением компенсации диабета у большинства больных приводит к прогрессированию пубертата и появлению сперматогенеза.
По данным различных исследователей, частота нарушений половой функции у мужчин, больных сахарным диабетом, колеблется от 24 до 74%, что выше, чем у всего мужского населения в целом. Чаще отмечаются нарушения эрекции при сохранении нормального полового влечения, эякуляции, оргазма. Выделяют 2 типа нарушений половой функции при сахарном диабете: снижение либидо и эректильную слабость (неспецифичны для диабета) и специфическую "диабетическую импотенцию", которая характеризуется нарушением эрекции при сохранении либидо или его повышении.
Возраст, в котором начался сахарный диабет, и длительность течения заболевания не играют большой роли для возникновения сексуальных нарушений. Сроки появления первых симптомов импотенции после выявления сахарного диабета колеблются от 1 до 15 лет и находятся в прямой зависимости от тяжести течения заболевания и наличия его осложнений.
У некоторых больных, особенно в начальный период развития сахарного диабета, наблюдаются психогенные формы импотенции. Изменение в образе жизни, общее недомогание, информация, получаемая от других больных о неизбежности быстрого развития импотенции при сахарном диабете, временное снижение потенции в период декомпенсации диабета способствуют развитию убежденности в стойкой импотенции и, как следствие этого, общей депрессии.
В 1967-1972 гг. В. М. Прихожан предложил клиническую классификацию импотенции при сахарном диабете.
I. Временная импотенция.
II. Прогрессирующая импотенция:
1) стадия начальных нарушений;
2) стадия выраженных нарушений;
3) паралитическая стадия.
Временная импотенция наблюдается в период выраженной декомпенсации сахарного диабета, после тяжелого гипогликемического состояния и проявляется в снижении либидо, нарушении эрекции, эякуляции. После достижения компенсации сахарного диабета половая функция восстанавливается. Стадия начальных нарушений при прогрессирующей импотенции характеризуется недостаточной эрекцией, преждевременной эякуляцией при сохраненном или повышенном либидо. Стадия выраженных нарушений характеризуется исчезновением спонтанных эрекций, значительной недостаточностью адекватных эрекций, редкими половыми актами, преждевременной эякуляцией. У части больных понижена чувствительность кожи головки полового члена, снижены или отсутствуют кавернозный и кремастерный рефлексы. При паралитической стадии наблюдается полное отсутствие эрекции, хотя либидо у многих больных сохраняется.
Патогенез нарушения половой функции у мужчин, больных сахарным диабетом, остается до конца не изученным. Большинство авторов считают, что импотенция у мужчин с диабетом является полиэтиологичным нарушением и включает иннервационные, сосудистые, гормональные и метаболические нарушения.
Установлено, что при диабетической нейропатии поражаются спинальные половые центры, нарушается вегетативная и соматическая иннервация половых органов. У мужчин с диабетом выявлена тесная взаимосвязь изменений уродинамики с нарушениями эрекции. Известно, что мочевой пузырь и половой член иннервируются парасимпатическими волокнами от одного центра в спинном мозге. Для сахарного диабета характерно снижение возбудимости сегментарного аппарата спинного мозга, и это снижение нарастает у больных с дистальной полинейропатией и при выраженной декомпенсации диабета. Аналогичные нарушения возникают в нейронах спинального центра эрекции. Стойкому снижению возбудимости центра эрекции способствуют гипогликемические комы, так как при них происходит поражение нейрональных структур. Функция спинального центра эякуляции поражается позже, чем центра эрекции. Ведущим при этом является снижение активности спинальных тормозных интранейронов, вызванное их непосредственным поражением и нарушением супраспинальных влияний. В результате повышается возбудимость данного центра, что и обусловливает преждевременную эякуляцию.
При патологоанатомическом исследовании мужчин, страдающих импотенцией и диабетом, обнаружены (как при световой, так и при электронной микроскопии) повреждения окончаний вегетативных нервов кавернозных тел.
Одним из проявлений вегетативной диабетической нейропатии является ретроградная эякуляция, обусловленная слабостью внутреннего сфинктера мочевого пузыря, которая часто является причиной бесплодия.
У большинства больных с импотенцией обнаружены изменения артерий и проявления диабетической микроангиопатии в сосудах полового члена. Диабетическая макроангиопатия приводит к недостаточности артериального кровотока, что, в свою очередь, вызывает нарушения эрекции. У больных обнаруживают фиброзные изменения в подушках Эбнера, расположенных в глубоких артериях полового члена, и изменения во внутренней оболочке этих сосудов.
У больных сахарным диабетом наблюдается прогрессирующее снижение проницаемости капилляров кожи по мере возникновения и усугубления импотенции. Это позволило предположить наличие параллельного снижения проницаемости капилляров в яичках, периферических нервах и в половых спинальных центрах.
У мужчин с тяжелым, длительно декомпенсированным сахарным диабетом снижаются объем эякулята, подвижность спермиев. При биопсии обнаруживают уменьшение количества гландулоцитов яичка, а иногда и атрофию семенных канальцев, патологический сперматогенез, снижение уровня фруктозы в семенной жидкости.
По данным большинства исследователей, у мужчин с сахарным диабетом и импотенцией снижен уровень тестостерона в сыворотке крови при нормальном содержании лютропина (ЛГ), фоллитропина (ФСГ), пролактина, эстрадиола (Эг), секстероидсвязывающего глобулина. Реакция гонадотропинов на введение гонадотропин-рилизинг-гормона, а также реакция тестостерона на введение ЛГ снижены.
При обследовании мужчин в возрасте 18-35 лет, больных декомпенсированным сахарным диабетом, нами было обнаружено снижение уровня тестостерона в сыворотке крови натощак, при нормальных уровнях ЛГ и ФСГ, а при нарушении потенции у больных выявлена небольшая гиперпролактинемия. После достижения нормогликемии уровень тестостерона у молодых больных диабетом повысился до нормы, что у многих сопровождалось восстановлением потенции. У мужчин 36-50 лет с декомпенсированным сахарным диабетом наблюдалось снижение уровня тестостерона, особенно резкое у лиц с импотенцией, а также повышение уровней ЛГ и пролактина в сыворотке крови. Содержание ФСГ в крови было нормальным. Компенсация сахарного диабета привела к некоторому (не до нормы) повышению уровня тестостерона и снижению пролактина в крови только у больных с сохраненной потенцией. У больных с импотенцией, несмотря на нормогликемию, сохранились сниженный уровень тестостерона и небольшая гиперпролактинемия. Среднее содержание эстрадиола в сыворотке крови у мужчин всех возрастных групп вне зависимости от состояния компенсации диабета, наличия его осложнений и нарушений половой функции не отличалось от показателей у здоровых.
Снижение уровня тестостерона в сыворотке крови у мужчин с диабетом, по-видимому, связано с органическими изменениями в яичках в результате микроангиопатии и нейропатии. Дополнительную роль в снижении содержания тестостерона играет повышенный уровень пролактина, действуя через подавление рецепторов ЛГ в яичках.
Лечение импотенции при сахарном диабете требует индивидуального подхода к каждому больному. Для достижения хорошего эффекта необходима стойкая компенсация сахарного диабета. У некоторых больных нормализация метаболических нарушений приводит к восстановлению нарушений половой функции. Всем больным, независимо от формы импотенции, нужно проводить соответствующее психотерапевтическое лечение, витаминотерапию (особенно витамины А, Е, группы В), а также лечение осложнений диабета (ангиопротекторы и т. д.).
Больным с начальными нарушениями половой функции модно назначать физиотерапевтические процедуры - гальванические "трусы", восходящий душ, фарадизацию промежности, дарсонвализацию внутренней поверхности бедер и промежности.
У больных с выраженными нарушениями половой функции, сохраняющимися несмотря на компенсацию диабета, проводится лечение препаратами тестостерона - сустаноном-250 или омнадреном-250 по 1 мл внутримышечно 1 раз в 3 нед или 1 раз в 2 нед. Назначение хорионического гонадотропина обычно неэффективно, что обусловлено первичным нарушением секреции тестостерона в яичках и соответственно недостаточным повышением уровня тестостерона в ответ на введение ЛГ.
У больных сахарным диабетом с импотенцией и значительным повышением уровня пролактина (больше 500 мМЕ/л) мы применили с хорошим эффектом комбинированное лечение малыми дозами парлодела (1,25-3,75 мг/сут) в сочетании с внутримышечным введением сустанона-250 по 1 мл каждые 3 нед.
При паралитической стадии импотенции больным рекомендуется использовать эректор ЦЗ-1. При стойкой эректильной импотенции производятся операции имплантации синтетических протезов полового члена. Операции должно предшествовать длительное и тщательное обследование, так как у больных сахарным диабетом чаще бывают послеоперационные осложнения.
В настоящее время для лечения импотенции используются методы хирургической реваскуляризации полового члена. Эти операции могут использоваться и для лечения импотенции при сахарном диабете.
Заболевания щитовидной железы. Вопрос о взаимоотношении щитовидной железы и половых желез давно привлекает внимание исследователей, однако до настоящего времени нет единого мнения о характере этих взаимоотношений. Известно, что для нормального развития системы гонадостата необходимо нормальное содержание в крови и периферическое действие тиреоидных гормонов.
Экспериментальный гипотиреоз вызывает гипогонадизм с атрофией гландулоцитов яичка, хотя сперматогенез при этом нарушается не всегда. Тиреоидэктомия сопровождается снижением уровней ФСГ и ЛГ в крови. Недостаток тиреоидных гормонов приводит к изменению стероидогенеза, в результате которого уменьшается секреция андростерона и тестостерона.
У мальчиков и подростков, проживающих в зоне зобной эндемии, нередко отмечается отставание в соматополовом развитии, сочетающееся с диффузным увеличением щитовидной железы и снижением уровня, связанного с белками йода в крови. У мужчин, страдающих гипотиреозом, обычно значительно снижена потенция, иногда в сочетании с уменьшением либидо. Причинами нарушения половой функции являются изменения высшей нервной деятельности, двигательные расстройства, общая слабость, а также небольшая гиперпролактинемия у многих больных.
При гипертиреозе усиливается превращение андростендиона в эстриол, повышается уровень эстрогенов в крови. У мужчин, больных диффузным или узловым токсическим зобом с тиреотоксикозами II или III степени, нередко снижаются либидо и потенция. Нарушения половой функции у этих больных связаны с общей слабостью, усилением катаболизма белков, поражением двигательных нейронов, а иногда - с тиреотоксической миопатией.
|
ПОИСК:
|
© Анна Козлова подборка материалов; Алексей Злыгостев оформление, разработка ПО 2001–2019
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'