БАКТЕРИОФАГ
Расстановка ударений: БАКТЕРИОФА`Г
БАКТЕРИОФАГ (бактери[и] + греч. phagos пожирающий; син.: фаг, бактериальный вирус) - вирус, способный инфицировать бактериальную клетку, репродуцироваться в ней, образуя многочисленное потомство, и вызывать ее лизис, сопровождающийся выходом фаговых частиц в среду обитания бактерии.
История. Впервые спонтанный лизис бактерий был описан н. Ф. Гамалеей в 1898 г. Английский бактериолог Туорт (F. Twort) в 1915 г. описал феномен "стекловидного" перерождения стафилококков и микрококков при длительном культивировании их на питательной среде. В ходе перерождения бактериальные колонии становились прозрачными и в конце концов теряли способность к пересевам. Фактор, вызывавший растворение колонии, переносился с зараженной колонии на незараженную и сохранял свою активность при разведении в 1 млн. раз. Туорт высказал предположение, что агент, вызывающий стекловидное перерождение бактерий, является вирусом, паразитирующим в бактериальной клетке. В 1917 г. канадский микробиолог д'Эрелль (F. d'Herelle) независимо от Туорта описал аналогичный феномен у дизентерийных бактерий и присвоил агенту, вызывающему гибель клеток, название "бактериофаг". Д'Эрелль (см.) заложил основы современного учения о Б. Он считал, что фаг представляет собой фильтрующийся вирус, являющийся облигатным паразитом бактерий. Д'Эреллю удалось разработать достаточно точный метод титрования фага, используя к-рый, он обнаружил, что в цикле взаимодействия фага с бактерией существует четыре фазы: прикрепление фага к клетке, проникновение внутрь клетки, размножение внутри клегки и лизис клетки с освобождением потомков фага в среду.
Открытие д'Эрелля привлекло к себе внимание медицинского мира в связи с надеждой использовать Б. в качестве средства для лечения и профилактики инфекционных болезней (см. Фагопрофилактика, фаготерапия). Однако большинство экспериментов и исследований, проведенных в клинике, показало относительно низкую терапевтическую ценность Б. по сравнению с антибиотиками, что в первую очередь связано с широким распространением фагорезистентных форм бактерий и их быстрой селекцией при использовании фага в практике. Тем не менее Б. могут эффективно использоваться в диагностике инфекционных заболеваний (см. Реакция нарастания титра фагов, Фагодиагностика, Фаготипирование).
Принципы классификации, основные свойства и морфология бактериофагов. Современная классификация фагов основана прежде всего на их хим. структуре, на типе нуклеиновой к-ты, заключенной в белковой оболочке. По этому критерию все фаги подразделяют на ДНК- и РНК-содержащие.
Вторым важнейшим классификационным признаком фагов является форма их взаимодействия с бактериальной клеткой. Согласно этому критерию фаги делят на вирулентные и умеренные. Заражение бактерий первыми из них всегда завершается лизисом клетки и освобождением в среду фагового потомства. Для умеренных же фагов существуют два альтернативных цикла развития - лизис клетки, как и при заражении вирулентным фагом, или же установление особого типа симбиотического взаимоотношения с клеткой, к-рое сохраняется при последующем делении бактерии и передается ее потомкам (см. Лизогения). Это состояние, как правило, обусловлено включением хромосомы умеренного фага в хромосому бактерии, с к-рой она реплицируется. Бактерии, несущие умеренный фаг, называются лизогенными, а форма Б., присутствующая в лизогенной бактерии, - профагом.
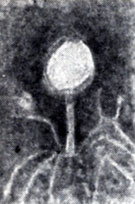
Рис. 1. Морфология различных фагов (для ясности см. схему на рис. 3): а - фаг Т-4, видны непрозрачная заполненная головка, чехол хвоста в несокращенном состоянии, шипы и хвостовые фибриллы (×156000)
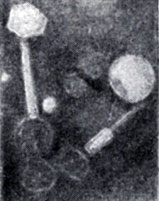
Рис. 1. Морфология различных фагов (для ясности см. схему на рис. 3): б - фаг Р-2, слева вверху видна нормальная частица, внизу - частица с сокращенным чехлом и пустотелой головкой (×65000)
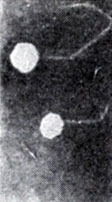
Рис. 1. Морфология различных фагов (для ясности см. схему на рис. 3): в - фаг Т-5, виден тонкий, извитой хвост, отсутствует сократительный чехол, базальная пластинка и хвостовые фибриллы (×68250)

Рис. 1. Морфология различных фагов (для ясности см. схему на рис. 3): г - фаг Р-22, видна гексагональная базальная пластинка с шипами, присоединенная к головке короткой шейкой (×64500)
Одним из таксономических признаков фагов является их отношение к половой дифференциации бактерий. По этому признаку фаги можно разделить на три основные группы: 1) f-1, f-2, Qβ, MS-2, атакующие только мужские бактерии; 2) Т-3, Т-7, Ф-П, взаимодействующие с женскими клетками (см. Конъюгация у бактерий); 3) индифферентные к половой дифференциации клеток фаги.
Одним из классификационных признаков фагов является их морфология. Обычно фаги делят на крупные и мелкие; кроме того, их различают по форме белкового чехла - капсида. К числу крупных фагов относятся наиболее детально изученные вирулентные колифаги (производное от E. coli + фаг) группы Т, подразделяющиеся в свою очередь на четные и нечетные: Т-1, Т-2, Т-3, Т-4, Т-5, Т-6, Т-7, а также умеренные кишечные фаги λ, Р-1, Р-2 и Р-22 (рис. 1). К категории мелких фагов относятся РНК-содержащие фаги f-2, MS-2, М-12, ДНК-содержащий фаг ФХ-174 и др.
Основные морфологические типы фагов представлены на рис. 2. Наиболее сложно устроены Т-четные фаги E. coli: Т-2, Т-4, Т-6, нек-рые из фагов Вас. subtilis: SPO-1, SP-8, SP-82 и др. Фаги Т-четной группы имеют вытянутую гексагональную головку, ригидный хвостовой отросток длиной 100 нм, диам. 2,5 нм и прикрепленный к нему сократительный чехол (рис. 2, а). Хвостовой отросток у нек-рых фагов, напр. у фага Т-2 (рис. 4), имеет дополнительные структуры, которые необходимы для осуществления отдельных этапов взаимодействия фага с клеткой. Кишечные фаги Т-1, Т-5 и умеренный фаг λ также имеют гексагональную головку и хвост (рис. 2, б), однако последний не обладает сократительной способностью. Диаметр головки фага λ - ок. 60 нм, - фага Т-5 - 90 нм, длина хвоста - 160 и 200 нм соответственно. Фаги, относящиеся к третьей морфологической группе (рис. 2, в), имеют крупную гексагональную головку и очень короткий хвостовой придаток. Представителями этой группы являются ДНК-содержащие фаги Т-3 и Т-7, диаметр головки к-рых достигает 50-60 нм. Наконец, существуют бесхвостые ДНК-содержащие мелкие фаги (рис. 2, г), типичным представителем к-рых является фаг ФХ-174. Этому фагу присуща полигональная структура капсида с диам. ок. 20 нм. Другие бесхвостые фаги, характеризующиеся малыми размерами капсида (20-35 нм), относятся к группе РНК-содержащих и обнаружены у различных представителей кишечной группы (f-2, f-7, MS-2, B-17 и др.), а также у Pseudomonas aeruginosa (рис. 2, д). Кроме полигональных или сферических, обнаружены нитеобразные кишечные фаги, содержащие однонитчатую ДНК (рис. 2, е). Длина нитевидных фагов достигает 800 нм, а диам. - 6 нм. Большинство фагов такого типа взаимодействует с мужскими штаммами E. coli, но известны и другие нитеобразные фаги, активные в отношении представителей рода Pseudomonas, способные инфицировать и женские штаммы.
Выявление фагов и подсчет количества фаговых частиц можно проводить путем электронной микроскопии очищенных препаратов или же наблюдая действие фагов на популяцию чувствительных бактерий.
Добавление вирулентного фага к взвеси бактерий с последующей инкубацией смеси при t° 30-37° приводит к растворению культуры - лизису, к-рый сопровождается полным просветлением культуральной среды, содержащей бактерии. Скорость наступления лизиса зависит от множественности инфекции, т. е. от числа частиц фага, приходящегося на одну бактерию. Если фаголизированную культуру инкубировать большее время, то может появиться вторичный рост (повторное помутнение культуры) за счет размножения селекционированных предсуществующих в бактериальной популяции резистентных мутантов. Инфекция бактерий умеренными фагами, проведенная в аналогичных условиях, приводит к временному уменьшению мутности культуры, за к-рым вскоре следует нарастание мутности за счет роста и размножения лизогенезированных бактерий.
Количество жизнеспособных частиц фага определяют на твердых питательных средах различными методами, из к-рых наиболее распространенным является метод Грациа (см. Грациа метод). В этом случае на поверхности твердой питательной среды с засеянным газоном чувствительных бактерий образуются участки лизиса культуры, к-рые называют бляшками фага, негативными колониями или стерильными пятнами (рис. 3).
Морфология негативных колоний специфична для различных фагов и часто используется как генетическая метка в различных исследованиях.
Вирулентные фаги обычно образуют прозрачные негативные колонии, а умеренные - мутные. Число колоний, или бляшкообразующих единиц (БОЕ), умноженное на фактор разведения исходной взвеси фага, дает величину титра фага, т. е. количество БОЕ в 1 мл исходного препарата. Фаги характеризуются и другой величиной, а именно эффективностью посева, т. е. отношением общего числа частиц фага, присутствующего в препарате (подсчитанного с помощью электронного микроскопа), к количеству БОЕ. Обычно при оптимальных условиях показатель эффективности посева фага колеблется в пределах 0,5-1,0.
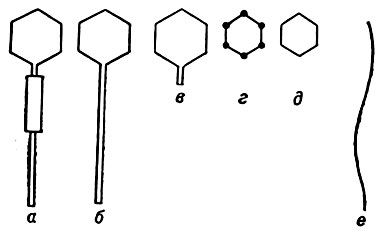
Рис. 2. Схема основных морфологических типов бактериофагов (а-е). Описание в тексте
Структура и химический состав фага. Начиная с работ Шлезингера (M. Schlesinger), проведенных в 30-х годах, стало ясно, что Б. представляет собой нуклеопротеид. В последующем было установлено, что любой Б. состоит из белковой оболочки, окружающей одну молекулу нуклеиновой к-ты. Структура белковой оболочки (капсида) наиболее изучена у Т-четных фагов кишечной палочки (Т-2, Т-4, Т-6), относящихся к классу крупных ДНК-содержащих фагов. Вес частицы Т-четного фага примерно равен 5×10-16г, из к-рых примерно 60% приходится на белки. Исследование структуры и функциональной анатомии Т-четных фагов [Андерсон (T. Anderson), 1953; Бреннер (S. Brenner), 1959; Хорн (R. Horne), 1959; Келленбергер (E. Kellenberger), 1966; Б. Ф. Поглазов, 1970] установило, что капсид состоит из сложно организованных элементов, каждый из к-рых выполняет определенную функцию при взаимодействии фага с клеткой. Тонкий анализ структуры фага стал доступен после разработки двух основных методических приемов: дезинтеграции частицы фага с помощью физ. и хим. факторов и метода негативного окрашивания для электронной микроскопии, визуализирующего ультраструктуру в большей степени, чем напыление металлом (Бреннер, Хорн, 1959). На основе этих методов установлено, что Т-четные фаги состоят из следующих элементов (рис. 4): головки, воротничка и хвостового отростка, заканчивающегося шестиугольной базальной пластинкой с короткими шипами. К базальной пластинке прикреплены фибриллы. Хвост фага состоит из полого цилиндрического стержня и окружающего его сократительного чехла.
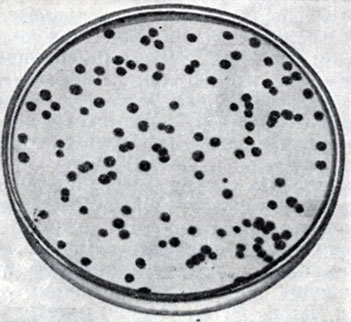
Рис. 3. Рост фага Т-2 на культуре E. coli. Видны негативные колонии фага (бляшки)
Каждый из структурных элементов фага в свою очередь состоит из большого числа строго ориентированных белковых субъединиц (капсомеров). При переносе Т-четного фага из солевого раствора в дистиллированную воду головка лопается (осмотический шок), заключенная в ней ДНК освобождается и может быть исследована электронно-микроскопическим (рис. 5) и физ.-хим. методами. Установлено, что ДНК Т-четного фага представляет собой линейную двухспиральную молекулу длиной ок. 50 мкм, состоящую из 2×105 пар оснований. ДНК большинства фагов содержит в своем составе обычные азотистые основания - аденин, тимин, гуанин и цитозин (А, Т, Г, Ц). Исключением из этого правила являются ДНК Т-четных фагов и ДНК нек-рых фагов Вас. subtilis, содержащие необычные (аномальные) азотистые основания. Так, вместо обычного цитозина содержится 5-оксиметилцитозин, к-рый может быть в глюкозилированной или неглюкозилированной форме.
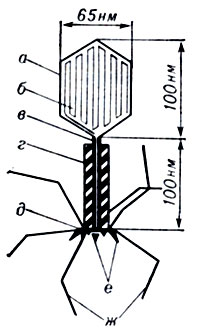
Рис. 4. Схема строения фага Т-2: а - головка; б - ДНК; в - стержень; г - чехол; д - базальная пластинка; е - шипы; ж - хвостовые фибриллы (на схеме воротничок не выделен)
В ДНК фагов Вас. subtilis (2G, SPO-1, SP-8, SP-82 и др.) тимин замещен на 5-оксиметилурацил. Столь необычная структура ДНК этих фагов придает им ряд свойств, отличающих их от обычных ДНК, в частности наделяет их высокой иммунологической специфичностью [Левин (L. Levine), 1961; Д. М. Гольдфарб, Л. А. Замчук, 1968; Н. А. Брауде, Л. А. Замчук, 1972].

Рис. 5. Молекула ДНК фага Т-2, вышедшая из головки фага (в центре), подвергнутого осмотическому шоку. Наверху и внизу видны свободные концы молекулы ДНК (электронограмма; ×60000)
Содержание отдельных азотистых оснований в ДНК различных фагов варьирует и зависит от вида фага. Кроме ДНК, внутри головки фагов Т-2, Т-4 находится так наз. внутренний белок фага, к-рый ассоциирован с его ДНК. В состав этого белка входят полиамины: спермидин и путресцин, кислоторастворимый полипептид, содержащий аспарагиновую к-ту, глутаминовую к-ту и лизин, и кислотонерастворимый белок [Херши (A. Hershey), 1957]. Функция этих компонентов сводится, вероятно, к нейтрализации кислотности ДНК и к созданию матрикса, обеспечивающего ее конденсацию.
Внутриклеточный цикл развития бактериофага. Кинетика репродукции Б. иллюстрируется опытом одноступенчатого цикла роста [Эллис, Дельбрюк (Ellis, M. Delbruck), 1939], в к-ром определяется титр БОЕ в зависимости от времени после смешивания определенного количества частиц Т-четного фага с бактериальной суспензией. Культура E. coli, содержащая 109 клеток в 1 мл, заражается фагом со средней множественностью 1. Смесь инкубируют 2-5 мин. в аэрируемой среде, а затем пробу переносят в 0,9 мл антифаговой сыворотки (1:100), получаемой путем иммунизации кроликов фаголизатами или концентратами фагов. За это время 80% фага адсорбируется на клетках. Зараженные бактерии разводят свежей средой в 10000 раз (первая ростовая пробирка) и дополнительно еще в 20 раз (вторая ростовая пробирка). Обе пробирки инкубируют при t° 37° и периодически берут пробы, в к-рых определяют содержание БОЕ путем высева по методу Грациа. В течение первых 25 мин. инкубации такой смеси число БОЕ остается постоянным (латентный период), затем наблюдается резкое возрастание количества фага, продолжающееся ок. 10 мин., после чего число БОЕ вновь становится постоянным (рис. 6). Латентный период и период возрастания числа БОЕ соответствует одному циклу размножения фага (литическому циклу), включающему события от взаимодействия фаговой частицы с поверхностью клетки-хозяина до выхода фагового потомства в окружающую среду. Литический цикл можно условно разделить на несколько этапов.
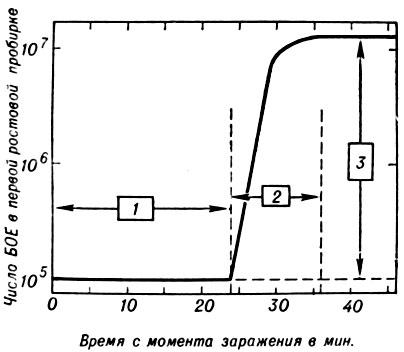
Рис. 6. График одноступенчатого цикла роста фага Т-4 (БОЕ - бляшкообразующие единицы): 1 - латентный период; 2 - период возрастания (горизонтальные стрелки характеризуют продолжительность латентного периода и периода возрастания); 3 - количество фаговых частиц, вышедших из одной инфицированной бактерии (вертикальная стрелка)
1. Адсорбция. В результате случайных столкновений частиц фага с бактериями специфические белки его капсида приходят в соприкосновение с поверхностными фагоспецифическими рецепторами клеточной стенки бактерии. В результате происходит необратимая адсорбция частиц фага (рис. 7). Т-четные фаги взаимодействуют с бактериальными рецепторами с помощью специфических белков на концах хвостовых нитей. Для успешной адсорбции необходим определенный ионный состав среды и присутствие кофактора адсорбции, к-рым для фага Т-4 является триптофан.

Рис. 7. Адсорбция частиц фага Т-5 на поверхности E. coli (электронограмма)
2. Проникновение фага внутрь клетки по существу представляет собой "инъекцию" нуклеиновой к-ты фага внутрь бактерии [Херши, Хейс (W. Hayes), 1952]. У Т-четных фагов этот процесс происходит следующим образом: шипы базальной пластинки хвостового отростка приходят в контакт с поверхностью бактерии, хвостовой чехол сокращается, в результате чего хвостовой стержень "прокалывает" клеточную стенку и ДНК перетекает в цитоплазму клетки через полость в хвостовом стержне. Вероятно, в процессе "прокалывания" клеточной стенки роль ферментов играет лизоцим (см.), обнаруженный в составе белков хвоста, растворяющий внутренний пептидогликановый слой стенки бактерии. Механизмы адсорбции и проникновения нуклеиновых кислот других фагов отличаются от таковых у Т-четных фагов, однако в конечном итоге во всех случаях свободная нуклеиновая к-та оказывается внутри клетки.
3. Проникновение фаговой ДНК в клетку знаменует собой начало так наз. эклипс-периода, в течение к-рого не удается обнаружить полноценные фаговые частицы внутри зараженной клетки при ее разрушении ультразвуком или лизоцимом. В это время в клетке происходит ряд процессов, конечным результатом которых является образование предшественников фагового потомства. Генетическая информация, содержащаяся в нуклеиновой к-те фага, начинает реализовываться с использованием декодирующих систем бактерии. В случае ДНК-содержащих Б. фаговые гены транскрибируются с образованием фагоспецифических информационных РНК, к-рые определяют синтез фагоспецифических белков транскрипционным аппаратом бактерии. В случае РНК-содержащих Б. фагоспецифические белки синтезируются под контролем фаговой РНК, выполняющей функцию и-РНК (см. Рибонуклеиновые кислоты). К числу фагоспецифических белков, помимо структурных белков капсида, относится также ряд ферментов, не входящих в состав зрелых частиц фага, но необходимых для перестройки биохимического аппарата бактерии в соответствии с нуждами фага. Многие Б., проникнув в клетку, вызывают подавление бактериальных макромолекул (ДНК, РНК, белков) и деградацию нуклеиновых кислот бактерии. Продукты деградации используются в качестве субстратов для синтеза нуклеиновых кислот фага. Выражение генома Б. на протяжении эклипс-периода происходит в соответствии с четкой программой, определяющей момент включения и выключения определенных групп фаговых генов (Р. Б. Хесин, М. М. Шемякин, 1962; Р. Б. Хесин, 1970). В бактериях, зараженных Т-четными фагами, на первых стадиях эклипс-периода образуются так наз. ранние белки, представляющие собой группу ферментов, обеспечивающих синтез фаговой ДНК. После начала репликации ДНК фага синтез ранних белков прекращается и начинается синтез поздних белков - структурных компонентов фаговых частиц.
Репликация (см.) нуклеиновых кислот фагов в большинстве случаев осуществляется специфическими ферментами, индуцированными фагом. У Т-четных фагов, содержащих двунитчатую ДНК, этот процесс протекает по полуконсервированному механизму с участием фагоспецифической ДНК-полимеразы - одного из ранних фагоиндуцированных белков. В случае РНК-содержащих фагов, а также фагов, содержащих однонитевую ДНК (напр., фаг ФХ-174), синтез нуклеиновых кислот включает промежуточную двунитчатую репликативную форму: сначала на исходной "плюс"-нити фаговой нуклеиновой к-ты синтезируется комплементарная ей "минус"-молекула, к-рая затем используется в качестве матрицы для образования "плюс"-нитей ДНК-фагового потомства (рис. 8).
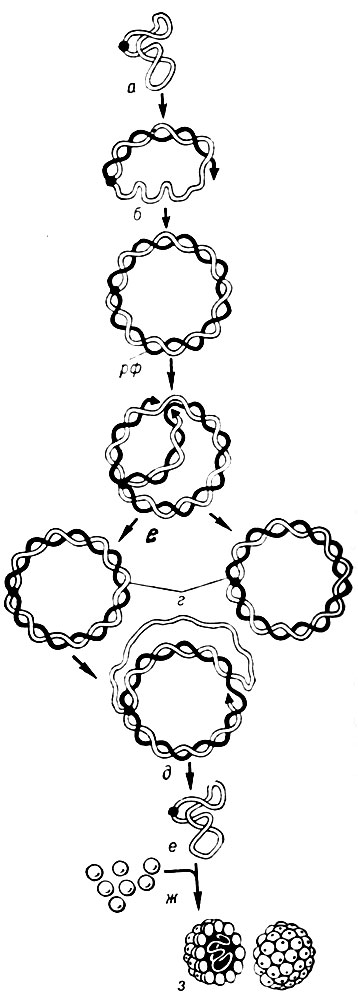
Рис. 8. Схема внутриклеточного развития фага ФХ-174 (а-з). Однонитчатая, циркулярная "плюс"-нить (светлая) ДНК инфицирующего фага (а) служит шаблоном для синтеза комплементарной (черной) "минус"-нити (б), образуя двунитчатую репликативную форму (рф). На ранней фазе инфекции репликативная форма ДНК копируется (реплицируется) полуконсер- вативно и симметрично (в), формируя дочерние рф-молекулы ДНК (г). На поздних фазах инфекции начинается асимметричная репликация (б), в ходе которой "минус"-нить служит шаблоном и синтезируется лишь дочерняя "плюс"-нить ДНК (е), которая вступает во взаимодействие с белком (ж) головки фага, образуя полноценную частицу (з)
4. Сборка фаговых частиц. Эклипс-период сменяется стадией морфогенеза частиц фагового потомства. На этой стадии латентного периода фаговые частицы могут быть выявлены внутри зараженных клеток. Морфогенез Б. заключается в сборке фагового капсида из отдельных молекул структурных белков фага. Сборка происходит поэтапно; сначала образуются отдельные компоненты капсида, к-рые затем объединяются в более крупные структуры. Большинство этапов морфогенеза происходит по принципу самосборки и может быть воспроизведено in vitro при смешивании отдельных компонентов фага. Однако нек-рые этапы сборки осуществляются при участии специфических белков, не являющихся структурными компонентами фага. Наименее понятным моментом морфогенеза фага является упаковка фаговой ДНК внутрь капсида.
5. Цикл размножения фага завершается выходом фаговых частиц потомства из клетки в окружающую среду. Выход сопровождается лизисом бактериальной клетки, к-рый выражается в просветлении бактериальной культуры, зараженной фагом. У Т-четных фагов лизис осуществляется двумя фагоспецифическими ферментами, один из к-рых неизвестной природы, так наз. продукт гена t, разрушает мембрану, а другой - лизоцим - растворяет оболочку бактерий изнутри. Количество частиц фагового потомства в расчете на одну зараженную клетку (урожай фага) может быть вычислено по кривой одноступенчатого цикла роста как отношение числа БОЕ после выхода фага к таковому до начала латентного периода. Величина выхода фага варьирует у различных фагов от нескольких десятков до нескольких тысяч. В оптимальных условиях образуется ок. 200 частиц Т-четных фагов. Эта величина может быть повышена за счет повторной адсорбции частиц фага на зараженных клетках после начала латентного периода (феномен задержки лизиса).
Генетика бактериофага. Исходным моментом в анализе генетической организации фага, как и любого другого организма, является выделение разнообразных мутантов, позволяющих проведение рекомбинационного анализа, необходимого для построения генетической карты фага.
Мутации фага по морфологии негативных колоний. Классическим признаком фага, использованным в фундаментальных исследованиях по молекулярной генетике и в генетическом анализе, является морфология негативных колоний фага. Негативные колонии могут варьировать в размерах, отличаться друг от друга характером края, прозрачностью, размером ореола вокруг зоны лизиса и пр. Все эти изменения часто являются результатом изменений физиол. условий, определяющих особенности взаимодействия фага с бактериальным хозяином. Они могут возникать также в результате мутаций в хромосоме фага и служить в качестве генетических маркеров при рекомбинационном анализе. Наиболее изученным типом мутаций, приводящих к изменению морфологии негативных колоний, является так наз. r-мутация у Т-четных фагов. Этот тип мутации был обнаружен Херши в 1946 г. Нормальный (дикий) тип фага Т-2 на бактериальном газоне E. coli В формирует маленькие негативные колонии, окруженные зоной неполного лизиса. Однако среди 103 -104 таких колоний фага Т-2 обнаруживаются единичные негативные колонии, имеющие значительно большие размеры с четко очерченным краем. Херши назвал такие мутанты быстролизирующими и обозначил их буквой "r" (от англ. rapid - быстрый), дикий тип - символом r+. Мутанты типа r можно подразделить на три группы: r-I, r-II, r-III, к-рые картируются в разных участках генетической карты фага Т-4 и фенотипически отличаются друг от друга по характеру роста на трех штаммах E. coli (B, S, K). Наиболее изученными из них являются r-II мутанты Т-четных фагов, образующие на штамме E. coli В типичные r-колонии и не растущие на штамме E. coli K-12 (λ).
Из числа других мутантов, фенотип к-рых характеризуется изменением морфологии негативных колоний, следует упомянуть мутные, или tu-мутанты фага Т-4 (от англ. turbid - мутный), негативные колонии к-рых окружены мутным кольцом, и звездчатые мутанты, описанные Саймондсом (N. Symonds, 1958). Аналогичные типы мутаций по морфологии бляшек описаны и у других фагов, в частности у фага λ, фагов Вас. subtilis и др.
Мутанты фага по диапазону действия. Этот тип мутации связан с изменением структуры белков рецепторного аппарата фага и фенотипически выражается в появлении способности мутанта инфицировать резистентные варианты бактерий, нечувствительные к дикому типу фага. Впервые мутанты по диапазону действия были открыты Лурией (S. Luria)B 1945 г. при изучении фага Т-1, а затем обнаружены и у других фагов. Лурия показал, что кишечная палочка, обычно чувствительная к фагу Т-1, мутирует, образуя резистентную форму, обозначаемую символом Ton-r (Т - название группы фагов, one - англ. один, resistant - резистентный). Подобно этому у E. coli можно получить резистентные мутанты к Т-четным фагам, напр, к Т-2, т. е. превратить дикий тип кишечной палочки, чувствительный к фагу Т-2 (Tto-s), в резистентный - Tto-r. Мутации такого рода возникают в генах кишечной палочки, контролирующих синтез рецепторов, взаимодействующих с адсорбционным аппаратом фага. При посеве фага дикого типа на резистентный бактериальный штамм большинство фаговых частиц не способно инфицировать бактерии, однако на газонах резистентных культур можно обнаружить единичные колонии фага, возникающие за счет инфекции резистентных клеток мутантными фаговыми частицами. Такие мутанты фага с измененным диапазоном действия обозначают индексом h (от англ. host - хозяин). Штрезингер (G. Streisinger, 1956) установил, что диапазон действия фага Т-2 контролируется единичным геном, определяющим конфигурацию белковой субъединицы, входящей в состав хвостовых фибрилл фага. Т. о., мутацию по диапазону действия четного фага можно характеризовать как переход от h+ генотипа к h генотипу. Интересно, что независимо полученные h-мутанты фага Т-2 не рекомбинируют, и при скрещивании не удается получить h+-рекомбинант, способный инфицировать E. coli Tto-S и не способный - E. coli Tto-r. С другой стороны, если из h-мутантов фага Т-2 получить h+-ревертанты (см. Реверсия) и скрестить их, то можно получить h-рекомбинанты. Это указывает на то, что исходной структурой гена - h фага Т-2 является h-форма, а наблюдаемый в лабораторных условиях h+ генотип по существу является мутантным.
Условно летальные мутанты характеризуются тем, что в одних условиях (рестриктивных, или ограничивающих) они ведут себя как летали, т. е. погибают, а в других (пермиссивных, или разрешающих) как дикий тип.
Одним из хорошо изученных классов условно летальных мутантов являются так наз. ts, или температурночувствительные, мутанты, к-рые размножаются в инфицированных клетках при t° 28-30° и не размножаются в них при t° 42-45°.
Показано, что мутации этого типа могут возникнуть в любом участке хромосомы фага Т-4, т. е. затрагивать различные функции фага. В дальнейшем было установлено, что ts-мутанты возникают не только у Т-четных фагов, но и у всех других описанных бактериальных вирусов, равно как и у вирусов животных и человека, а также у грибов и бактерий [Браун, Арбер (A. Brown, W. Arber), 1964; Фаттиг (W. Fattig) и соавт., 1965]. Фенотип ts-мутантов является результатом мутации, изменяющей в конечном итоге первичную структуру специфического белка. Это в свою очередь приводит к изменению его вторичной, третичной и четвертичной структуры.
Белок приобретает повышенную чувствительность к температуре окружающей среды и при повышении последней (42-45°) денатурируется, оставаясь активным при t° 28°. Этот же белок у фага дикого типа сохраняет свою структуру, а следовательно, и активность в диапазоне t° 42-45°.
Амбер-мутанты (am) фага Т-4 характеризуются отсутствием роста на штамме E. coli B, но способны формировать негативные колонии на E. coli К-12 (CR-63) [Эпстайн (R. Epstein) и соавт., 1963]. Штаммы бактериального хозяина, "разрешающие" репродукцию в них амбер-мутантов фага, называют пермиссивными, а штаммы, в к-рых репродукция мутантов подавлена, - неразрешающими, или непер миссивными. Изучение молекулярных механизмов амбер-мутаций показало, что в ДНК таких мутантов возникает мутационное изменение, к-рое транскрибируется (см. Транскрипция) на и-РНК в виде одного из так наз. нонсенс-кодонов - УАГ, не распознаваемого антикодоном транспортной РНК (см. Генетический код, Трансляция). В результате при транскрипции прекращается синтез полипептида в том участке, где находится нонсенс-кодон [Стреттон, Бреннер (A. Stretton, S. Brenner), 1965]. Исходя из этого свойства, амбер-кодон является терминирующим кодоном. Однако при заражении пермиссивного бактериального хозяина синтез полипептида продолжается, т. к. в такой бактерии присутствует транспортная РНК, к-рая способна транслировать ("осмысливать") терминирующий кодон и включать в данный участок полипептидной цепи приемлемую аминокислоту, восстанавливая тем самым функциональную активность синтезированного белка. Т. о., в пермиссивном бактериальном хозяине амбер-мутация супрессируется (см. Супрессия) и такой бактериальный штамм обозначается как su+, а соответствующая амбер-мутация фага относится к типу sus, т. е. супрессор-чувствительному классу мутаций.
Свойство бактерий супрессировать амбер-мутацию определяется генетическим локусом, локализованным в ее хромосоме. Соответственно непермиссивная бактерия обозначается символом su-.
Охра-мутации фага Т-4, так же как и амбер-мутации, относятся к классу нонсенс-мутаций. Фаги, несущие охра-мутацию, размножаются в пермиссивном бактериальном хозяине, имеющем супрессирующие гены, которые отличаются от генов,супрессирующих амбер-мутацию. Нонсенс-кодоном у охра-мутации является триплет УАА [Бреннер, Беквит (J. Beckwith), 1965].
Особенностью этого класса условно летальных мутаций является то, что они супрессируются специфичными для них супрессорами, хотя нек-рые амбер-мутации супрессируются также и охра-супрессорами. Поскольку амбер-кодон УАГ отличается от охра-кодона УАА только по одному азотистому основанию, они могут переходить друг в друга в результате единичного мутационного события.
Третьим известным типом нонсенс- мутации у фага Т-4 является так наз. опал-мутация, для к-рой характерен бессмысленный триплет У ГА, не распознаваемый транспортной РНК в su--штаммах. Изучение опал-мутаций позволило прийти к заключению, что УГА-триплет является, как и кодоны УАГ и УАА, терминирующим. Опал-мутация супрессируется в бактериальных штаммах, несущих специфический супрессор, и не супрессируется амбер- или охра-супрессорами.
Скрещивание и рекомбинация фагов. Впервые рекомбинация фагов была проведена в 1946 г. Дельбрюком и Бейли (W. Bailey) и независимо от них - Херши.
Для проведения скрещивания фагов необходимо располагать генетически маркированной парой родительских фагов, отличающихся друг от друга по крайней мере двумя признаками. Классические мутации, использованные в первых исследованиях по рекомбинации фагов, были h и r. В последующем скрещивание и рекомбинация проводились с использованием фагов, несущих мутации по всем известным признакам.
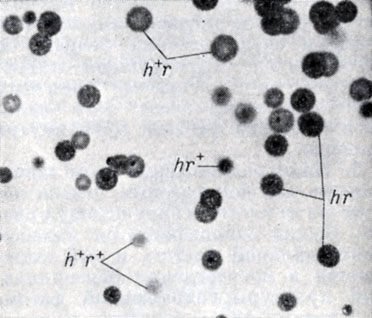
Рис. 9. Морфология негативных родительских фагов и их потомков, полученных в результате скрещивания h+r и hr+, проведенного в культуре E. coli B. Показаны негативные колонии родительских фагов группы Т-2 и два реципрокных рекомбинанта (h+r+ и hr)
Скрещивание фагов проводят путем заражения чувствительного бактериального хозяина двумя родительскими фагами, генетически отличающимися друг от друга. Условия заражения бактерии обоими фагами должны быть такими, чтобы почти все бактерии одновременно были инфицированы обоими типами фагов. Для этого множественность инфекции каждым фагом в среднем должна быть равна 5. Для достижения синхронной инфекции бактерий двумя скрещиваемыми фагами применяют метод Бензера-Жакоба, заключающийся в подавлении внутриклеточного цикла репродукции фага цианидом. Затем, снизив концентрацию цианида путем разведения взвеси зараженных бактерий до неэффективной, "включают" этим самым внутриклеточную фазу инфекции, в ходе к-рой осуществляется рекомбинация между родительскими фагами. В результате последующего лизиса клеток в потомстве обнаруживают 4 класса фагов: оба родительских и два реципрокных класса рекомбинантов (рис. 9). Кроме указанных классов, обнаруживаются редкие варианты (2%), характеризующиеся признаками обоих родительских фагов (гетерозиготы). Отношение числа рекомбинантов фагов в потомстве к общему числу частиц потомства характеризует частоту рекомбинации. Этот показатель постоянен для двух данных маркеров фага при условии, если скрещивание проводят в строго стандартных условиях. Однако частота рекомбинации варьирует в зависимости от того, какие маркеры фага выбраны для рекомбинации. Скрещивания фагов, несущих различные генетические маркеры, показывают, что частота рекомбинации варьирует от 0,01% при внутригенной рекомбинации до 40% в случае маркеров, удаленных друг от друга. Поскольку частота рекомбинации пропорциональна расстоянию между генами, то с помощью рекомбинационного анализа удалось установить положение одних генов относительно других в пределах хромосомы фага. Результаты такого анализа привели к заключению, что генетический аппарат фага представлен одной группой сцепления, т. е. состоит из одной хромосомы. На основании результата двухфакторных скрещиваний было установлено, что наиболее отдаленные друг от друга маркеры хромосомы фага не сцеплены, что соответствовало представлению о линейной организации хромосомы Т-четного фага.
Генетический анализ, проведенный на основе трехфакторного скрещивания с большим набором ts и am-мутаций фага Т-4, обнаружил сцепленность между крайними маркерами, что указывает на циркулярность карты сцепления генов у этого фага. Заключение относительно существования у фага одной группы сцепления генов, полученное на основании генетических данных, соответствует физ. наблюдениям, установившим, что в головке фага находится одна молекула ДНК. Однако представление о циркулярности генетической карты оказалось в противоречии с электронномикроскопическими данными Клейншмидта (Kleinschmidt, 1962), однозначно устанавливающими существование свободных концов в молекуле ДНК, извлеченной из головки фага Т-2. Это противоречие было устранено после открытия в хромосоме Т-четных фагов терминальной избыточности и циркулярных перестроек.
Структура хромосомы фага. Хромосома фага состоит из одной молекулы нуклеиновой к-ты, к-рая заключена в белковый чехол головки фага. У крупных Т- четных фагов кишечной палочки мол. вес гигантской двунитчатой ДНК равен примерно 1,2×108 дальтон, что соответствует 2×105 пар нуклеотидов.
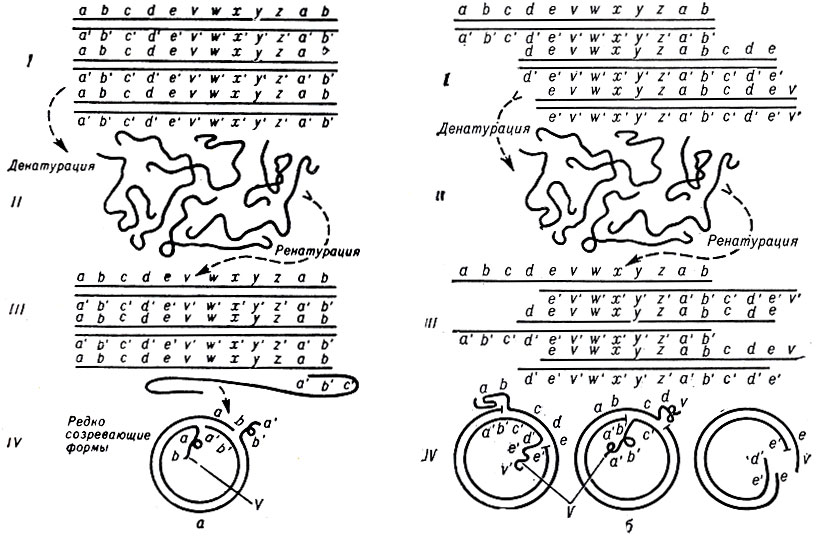
Рис. 10. Схема терминальной избыточности и циркулярных перестроек в хромосоме фагов (латинскими буквами условно обозначены гены). Денатурация и ренатурация линейных молекул ДНК фагов с терминальной избыточностью: а - без циркулярной перестройки; при тепловой денатурации таких молекул ДНК образуются нити, которые при ренатурации будут формировать линейные хромосомы исходной длины; изредка происходит спаривание молекул на противоположных концах в области терминальной избыточности, что приводит к образованию редко возникающей циркулярной молекулы ДНК; б-с циркулярными перестройками; отдельные полинуклеотидные нити при ренатурации реассоциируют разными способами, при которых часто формируются циркулярные молекулы. I - нативные хромосомы (ДНК) фагов; II - денатурированные хромосомы (ДНК) фагов; III - ренатурированные хромосомы (ДНК) фагов; IV - циркулярные молекулы (ДНК) фагов; V - неспаренные концевые участки в циркулярной хромосоме (ДНК) фагов
Мало известно относительно организации хромосомы фага внутри головки. Показано, что в ходе внутриклеточного цикла развития фага его ДНК конденсируется, и ее объем в головке составляет примерно Vis объема, занимаемого в репликативном фонде. Нить ДНК внутри головки упакована параллельно продольной оси фага. Генетические и физ. исследования установили, что хромосомна фагов Т-2 и Т-4, находящаяся в головке, содержит больше ДНК, чем требуется для кодирования функций вегетативного фага, т. к. каждая хромосома, находящаяся в индивидуальной фаговой частице, имеет на своих концах одну и туже дополнительную последовательность нуклеотидов. Эта дополнительная область в хромосоме фага называется терминальной избыточностью хромосомы и по протяженности составляет ок. 3% от полного генома [Штрезингер, Эдгар, Денхардт (R. Edgar, G. Denhardt), 1967]. Более того, индивидуальные хромосомы в популяции фага не одинаковы и характеризуются так наз. циркулярными перестановками, т. е. их терминальная избыточность содержит различные генетические области, случайно полученные из различных участков генома. Это означает, что, хотя каждая хромосома фага, заключенная в белковой головке, представляет собой линейную структуру, любая пара генов в разных частицах может повторяться на ее концах (циркулярная перестройка), создавая таким образом циркулярную группу сцепления. Механизм формирования подобной структуры определяется тем, что ДНК четных фагов, реплицируясь в клетке, рекомбинирует, образуя полимеры из нескольких геном-эквивалентов [Френкель (F. Frankel), 1966]. В последующем индивидуальные хромосомы возникают в результате отрезания из этого гигантского полимера, называемого конкатенатом (от лат. con вместе, catena цепь), участка ДНК определенной длины, однако несколько большего, чем геном:
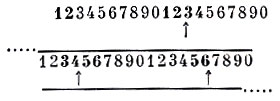
Схема образования хромосомы фага Т-4 из конкатената (изображен в виде прямой линии; цифрами обозначены гены; стрелками указаны участки надрезания хромосом а жирным шрифтом - терминальная избыточность)
Т. о., в инфицированных клетках возникает набор фаговых геномов с циркулярными перестройками в области терминальной избыточности.
Открытие Штрезингером явления терминальной избыточности и циркулярных перестроек хорошо объясняет, каким образом линейная структура ДНК фага согласуется с циркулярной генетической картой фага (рис. 10 и 11).
Стало ясным также различие в характере поведения геномов фагов, обладающих циркулярными перестройками в области терминальной избыточности и не обладающих таковыми (Т-3, Т-5 и Т-7). В первом случае денатурация и последующий отжиг (ренатурация) ДНК приводят, как показал Томас (С. Thomas, 1963), а затем и другие исследователи, к образованию большого числа циркулярных геномов, к-рые редко встречаются в случае ДНК фагов Т-3, Т-5, Т-7, не имеющих циркулярных перестроек.
Условно летальные мутации фага Т-4 всех описанных типов, как и у других фагов, затрагивают все признаки и локализованы в разных участках хромосомы. Выделение большого числа ts- и am-мутантов позволило идентифицировать и картировать около 70 генов фага Т-4, что составляет примерно 50% от возможного числа генов в хромосоме фага. Идентификация функции генов осуществляется путем комплементационного теста (см. Мутационный анализ) между большим числом условно летальных мутантов и наблюдением за наличием или отсутствием различных функций фага, поврежденных соответствующими мутациями, напр. синтез ДНК, синтез фагоиндуцированных ферментов, структурных белков фага, морфогенез, лизис, появление фаговых антигенов и пр. Положение отдельных генов в хромосоме фага относительно друг друга устанавливалось на основе данных, полученных в ходе рекомбинационного анализа (см. Генетический анализ).
В результате удалось сконструировать генетические карты различных фагов, но наиболее детальными из них являются карты фагов λ и Т-4 (рис. 11). Если оценить протяженность хромосомы фага Т-4 на основании показателей процента рекомбинации между маркерами, т. е. выразить ее в единицах карты (1 единица карты равна 1% рекомбинации), то окажется, что общая длина хромосомы карты составит примерно 800 ед. Отсюда следует, что одна единица карты фага Т-4 эквивалентна 200 парам нуклеотидов. Такой расчет требует корректив, т. к. не учитывает явления высокой отрицательной интерференции (см. Рекомбинация), влияющей на частоту рекомбинации в пределах участков хромосомы фага Т-4, близко находящихся друг от друга. Подобный результат получен с фагами SPO 1, Bac. subtilis и др.
Существуют два основных функциональных класса генов фага: 1) гены, контролирующие ранние функции, связанные в основном с синтезом ДНК, и 2) гены, контролирующие поздние функции, такие как синтез структурных компонентов фага, его созревание, морфогенез и лизис клетки (рис. 11).
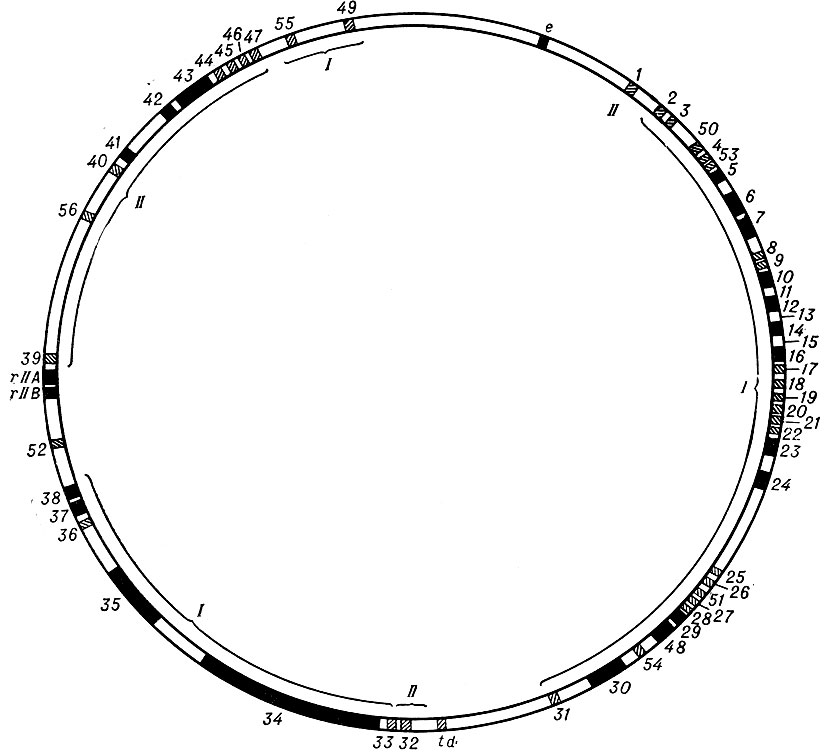
Рис. 11. Генетическая карта фага Т-4. I - гены, контролирующие синтез белковых субъединиц фага и их самосборку; II - гены, контролирующие синтез и репликацию ДНК; е - ген, контролирующий синтез лизоцима; td - ген, контролирующий синтез фаговой тимидилатсинтетазы; rIIA и rIIB - гены, контролирующие синтез rII-белка; гены выделены на карте в виде заштрихованных и черных сегментов; протяженность черных сегментов показывает минимальную относительную длину генов; цифры (снаружи генетической карты) - порядковый номер гена
Гены, определяющие сходные функции, локализованы в хромосоме фага в виде скоплений, напр, гены, определяющие морфогенез фага и формирование капсида, расположены в правой верхней части хромосомы, а большинство генов, связанных с синтезом ДНК фага Т-4, - в левой. В этой тенденции топографического объединения функционально родственных генов в хромосоме фага Т-4 имеется ряд исключений, напр, ген 31, принимающий участие в формировании капсида, равно как и гены 34-38, контролирующие синтез нитей хвоста фага, локализованы между генами, связанными с контролем синтеза ДНК.
Черные сегменты, обозначенные на рис. 11, демонстрируют минимальную длину генов, установленную по частотам рекомбинаций между мутациями, локализованными в данном гене. Цифры снаружи генетической карты фага Т-4 обозначают порядковый номер гена, rIIA, rIIB и td - гены, контролирующие синтез r-белка и тимидилатсинтетазы соответственно.
Библиогр.: Гольдфарб Д. М. и Замчук Л. А. Иммунология нуклеиновых кислот, М., 1968; Крылов В. Н. Место и время действия г 11-гена бактериофага Т4 при внутриклеточном развитии фага, Генетика, т. 5, № 2, с. 136, 1967, библиогр.; Поглазов Б. Ф. Сборка биологических структур, М., 1970; Степанов А. И. и Алиханян С. И. Электронно-микроскопическое изучение ts-мутантов фага Т4В, Генетика, т. 6, № 7, с. 114, 1968; Bernstein H., Edgar R. S. a. Denhardt G. H. Intragenic complementation among temperature sensitive mutants of bacteriophage T4D, Genetics, v. 51, p. 987, 1965, bibliogr.; Brenner S. a. Beckwith J. R. Ochre mutants, a new class of suppressible nonsense mutants, J. molec. Biol., v. 13, p. 629, 1965; Brenner S., Stretton A. O. W. а. Kaplan S. Genetic code, Nature (Lond.), v. 206, p. 994, 1965, bibliogr.; Delbrück M. a. Bailey W. T. Induced mutations in bacterial viruses, Cold Spr. Harb. Symp. quant. Biol., v. 11, p. 33, 1946; Edgar R. S. a. Lielausis I. Temperature-sensitive mutants of bacteriophage T4D, Genetics, v. 49, p. 649, 1964; Epstein R. H. a. o. Physiological studies of conditional lethal mutants of bacteriophage T4D, Cold Spr. Harb. Symp. quant. Biol., v. 28, p. 375, 1963; Frankel F. R. Studies on the nature of replicating DNA in T4-infected Escherichia coli, J. molec. Biol., v. 18, p. 127, 1966; Hayes W. The genetics of bacteria and their viruses, Oxford, 1968; Hershey A. D. Spontaneous mutations in bacterial viruses, Gold Spr. Harb. Symp. quant. Biol., v. 11, p. 67, 1946, bibliogr.; Mac Hattie L. A. a. o. Terminal repetition in permuted T2 bacteriophage DNA molecules, J. molec. Biol., v. 23, p.355, 1967; Ritchie D. A. a. o. Terminal repetition in non-permuted T3 and T7 bacteriophage DNA molecules, ibid., p. 365; Salts Y. a. Ronen A. Neighbour effects in the mutation of ochre triplets in the T4r II gene, Mutation Res., v. 13, p. 109, 1971; Streisinger G., Edgar R. S. a. Denhardt G. H. Chromosome structure in phage T4, Proc. nat. Acad. Sci. (Wash.), v. 51, p. 775, 1964; Stretton A. O. W. a. Brenner S. Molecular consequences of the amber mutation and its suppression, J. molec. Biol., v. 12, p. 456, 1965; Thomas C. A. The arrangements of nucleotide sequences in T2 and T5 DNA molecules, Cold Spr. Harb. Symp. quant. Biol., v. 28, p. 395, 1963; Zipser D. A third class of suppressible polar mutants, J. molec. Biol., v. 29, p. 441, 1967.
Источники:
- Большая медицинская энциклопедия. Том 2/Главный редактор академик Б. В. Петровский; издательство «Советская энциклопедия»; Москва, 1975.- 608 с. с илл., 8 л. вкл.
|
ПОИСК:
|
© Анна Козлова подборка материалов; Алексей Злыгостев оформление, разработка ПО 2001–2019
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'