БАКТЕРИИ
Расстановка ударений: БАКТЕ`РИИ
БАКТЕРИИ (греч. baktērion палочка) - разнообразная по биол. свойствам группа широко распространенных на Земле микроскопических, в основном одноклеточных, организмов, принадлежащих к низшим формам жизни.
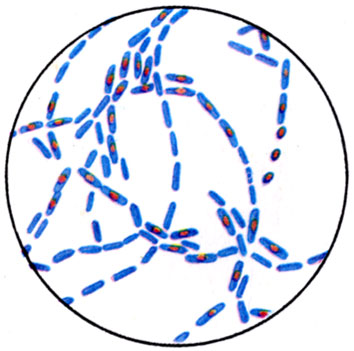
К ст. Бактерии. Рис. 1. Споры Bac. cereus (окраска по Ожешке)
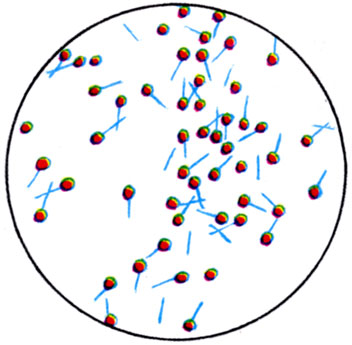
К ст. Бактерии. Рис. 2. Споры Cl. tetani (окраска по Ожешке)
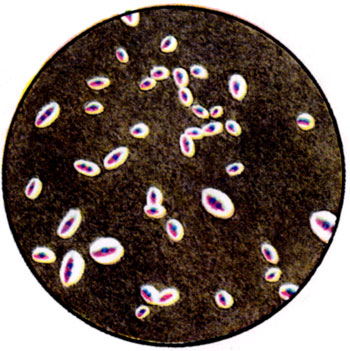
К ст. Бактерии. Рис. 3. Капсулы Klebsiella pneumoniae (окраска по Бурри)

К ст. Бактерии. Рис. 4 и 5. Зерна волютина у коринебактерий

К ст. Бактерии. Рис. 4 и 5. Зерна волютина у коринебактерий
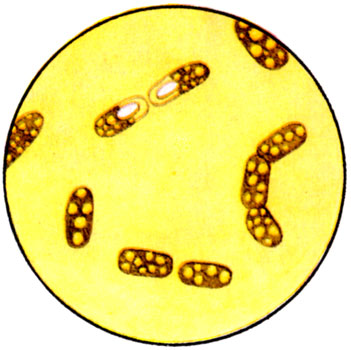
К ст. Бактерии. Рис. 6. Включения у Bac. megaterium
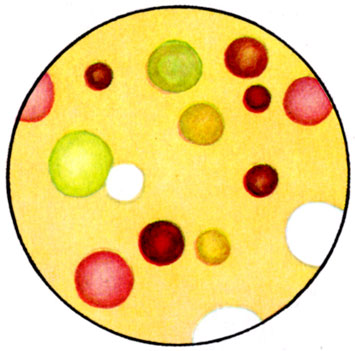
К ст. Бактерии. Рис. 7. Колонии пигментных микрококков

К ст. Бактерии. Рис. 8. Диффузия пигмента (болотного цвета) Pseudomonas aeruginosa в питательную среду
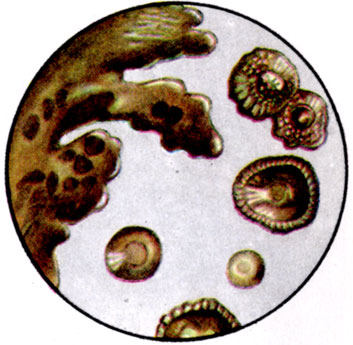
К ст. Бактерии. Рис. 9. Пигментные колонии Azotobacter chroococcum
Первые сведения о Б. были получены в 17 в. из исследований Левенгука, обнаружившего их основные формы. Б. могут существовать в самых разнообразных условиях. Большинство их лишено хлорофилла. Исключение составляют анаэробные пурпурные и зеленые серобактерии, а также несерные пурпурные Б., содержащие хлорофилл и использующие солнечную энергию для фотосинтеза. Б. могут усваивать неорганический углерод и азот, использовать в качестве источников энергии многие неорганические и органические соединения, осуществлять превращения углерода, азота, серы, железа и других элементов. Наряду с водорослями Б. являются одними из самых древних организмов на Земле. Клеточное строение Б. сходно с сине-зелеными водорослями, актиномицетами (см.) и спирохетами (см.), с к-рыми, как полагают, Б. связаны филогенетически. Среди Б. имеются виды, вызывающие заболевания у человека, животных и высших растений.
Систематика. Первые попытки классифицировать Б. по морфологическим признакам были предприняты в 18 в. Позднее в основу классификации были положены физиологические признаки. В качестве таксономических признаков применялись наиболее стабильные - форма, окраска по Граму (см. Грама метод), спорообразование, тип дыхания, биохимические, антигенные и другие свойства, однако до наст, времени не создано классификации, построенной на принципе филогенетического родства Б. с учетом эволюционных связей.
| Класс Schizomycetes | ||
|---|---|---|
| порядок | семейство | род |
| Патогенные бактерии | ||
| Pseudomonadales (неподвижные клетки с полярными жгутиками) | Spirillaceae | Vibrio Spirillum |
| Eubacteriales (кокковидные, палочковидные бактерии с перитрихиальными жгутиками и неподвижные формы) | Micrococcaceae | Micrococcus Staphylococcus |
| Neisseriaceae | Neisseria | |
| Lactobacillaceae | Dipiococcus Streptococcus Peptostreptococcus |
|
| Brucellaceae | Pasteurella Bordetella Brucella Haemophilus |
|
| Enterobacteriaceae | Escherichia Klebsiella Proteus Salmonella Shigella |
|
| Bacillaceae | Bacillus Clostridium |
|
| Corynebacteriaceae | Corynebacterium | |
| Actinomycetales (нитевидные, ветвящиеся клетки - актиномицеты) | Mycobacteriaceae | Mycobacterium |
| Actinomycetaceae | Nocardia Actinomyces |
|
| Streptomycetaceae | ||
| Actinoplanaceae | ||
| Spirochaetales (подвижные, неригидные бактерии, у которых цитоплазма спирально закручена вокруг осевой нити) | Spirochaetaceae | Borrelia Treponema Leptospira |
| Mycoplasmatales (мелкие полиморфные, фильтрующиеся формы) | Mycoplasmataceae | Mycoplasma |
| Acholeplasmataceae | Acholeplasma | |
| Непатогенные бактерии | ||
| Chlamydobacteriales | ||
| Hyphomicrobiales | ||
| Caryophanales | ||
| Beggiatoales | ||
| Myxobacterales | ||
| Myxobacterales | ||
Широкое распространение получила классификация Берджи (D. Bergey, 1957), в основу к-рой положены международные правила номенклатуры Б. Номенклатура выдержана в биноминальной системе, принятой в зоологических и ботанических классификациях (см. табл. 1). В качестве таксономических признаков взяты различные биол. свойства Б.
Приведенные в табл. 1 микоплазмы - мельчайшие образования, отграниченные вместо ригидной клеточной стенки только цитоплазматической мембраной, существенно отличающиеся от бактерий, выделены в настоящее время в отдельный класс - Mollicutes (см. Mycoplasmataceae).
Морфология. Существует три основные формы Б. - шаровидная, палочковидная и спиралевидная (рис. 1); большая группа нитчатых Б. объединяет преимущественно водные Б. и не содержит патогенных видов.

Рис. 1. Основные формы бактерий (схематическое изображение); 1-6 - шаровидные формы: 1 - стафилококки; 2 и 3 - диплококки; 4 - стрептококки; 5 - тетракокки; 6 - сарцины; 7-9 - различные виды палочек; 10-12 - спиралевидные формы: 10 - вибрионы; 11 и 12 - спириллы
Шаровидные Б. - кокки, подразделяются в зависимости от расположения клеток после деления на несколько групп: 1) диплококки (делятся в одной плоскости и располагаются парами); 2) стрептококки (делятся в одной плоскости, но при делении не отделяются друг от друга и образуют цепочки); 3) тетракокки (делятся в двух взаимно перпендикулярных плоскостях, образуя группы по четыре особи); 4) сарцины (делятся в трех взаимно перпендикулярных плоскостях, образуя группы кубической формы); 5) стафилококки (делятся в нескольких плоскостях без определенной системы, образуя скопления, напоминающие виноградные грозди). Средний размер кокков 0,5-1 мкм (см. Кокки).
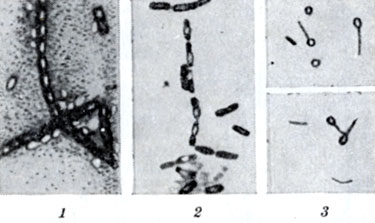
Рис. 2. Расположение спор (просветленные участки) у некоторых видов бактерий: 1 - Bac. anthracis; 2 - Cl. sporogenes; 3 - Cl. tetani
Палочковидные Б. имеют строго Цилиндрическую или овоидную форму, концы палочек могут быть ровными, закругленными, заостренными. Палочки могут располагаться попарно в виде цепочек, но большинство видов располагается без определенной системы. Длина палочек варьирует от 1 до 8 мкм, средний диам. 0,5-2 мкм. Принято собственно бактериями называть палочки, не образующие спор (см. Споры). Б., образующие споры, называются бациллами. По принятой номенклатуре к бациллам относят аэробные формы. Анаэробных спорообразующих Б. относят к клостридиям. Спорообразование у бацилл и клостридий не связано с процессом размножения. Споры у них относятся к типу эндоспор, представляющих собой круглые или овальные тела, преломляющие свет и окрашивающиеся по специальным методам (цветн. табл., ст. 584, рис. 1 и 2). Расположение спор в клетке, их величина и форма характерны для каждого вида Б. (рис. 2). Нек-рые палочки (микобактерии, коринебактерии) образуют нитевидные особи, другие (клубеньковые Б.) образуют разветвленные, звездчатые формы - так наз. бактероиды (рис. 3).
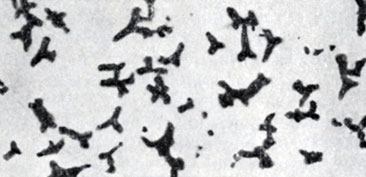
Рис. 3. Палочки звездчатой формы (бактероиды)
Спиралевидные формы Б. подразделяют на вибрионы и спириллы. Изогнутость тел вибрионов не превышает одной четверти оборота спирали. Спириллы образуют изгибы из одного или нескольких оборотов (см. Вибрионы, Спириллы).
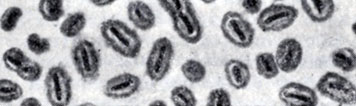
Рис. 4. Капсулы палочек склеромы
Нек-рые Б. обладают подвижностью, что отчетливо видно при наблюдении методом висячей капли (см.) или другими методами. Подвижные Б. активно передвигаются с помощью особых органелл - жгутиков (см. Жгутики бактериальные) либо за счет скользящих движений (миксобактерии).
Капсула имеется у ряда Б. и является их внешним структурным компонентом (рис. 4 и цветн. табл., ст. 584, рис. 3). У ряда Б. аналогично капсуле имеется образование в виде тонкого слизистого слоя на поверхности клетки. У нек-рых Б. капсула формируется в зависимости от условий их существования. Одни Б. образуют капсулы только в макроорганизме, другие - как в организме, так и вне его, в частности на питательных средах, содержащих повышенные концентрации углеводов. Нек-рые Б. образуют капсулы независимо от условий существования (см. Капсульные бактерии). В состав капсулы большинства Б. входят полимеризованные полисахариды, состоящие из пентоз и аминосахаров, уроновые кислоты, полипептиды и белки. Капсула не является аморфным образованием, а определенным образом структурирована. У нек-рых Б., напр. пневмококков, капсула определяет их вирулентность, а также нек-рые антигенные свойства бактериальной клетки.
Клеточная стенка Б. определяет их форму и обеспечивает сохранение внутреннего содержимого клетки. По особенностям хим. состава и структуры клеточной стенки Б. дифференцируют с помощью окрашивания по Граму.
Строение клеточной стенки различно у грамположительных и грамотрицательных Б. Основным слоем клеточной стенки, характерным для всех видов Б., является ригидный слой (син.: мукопептидяый слой, муреин, пептидогликан; последнее название наиболее соответствует хим. строению слоя), в состав к-рого входят повторяющиеся остатки аминосахаров - N-ацетилглюкозамина и N-ацетилмурамовой к-ты, образующих основу линейного полимера - муреина.
С остатком N-ацетилмурамовой к-ты соединен полипептид, состоящий у большинства Б. из четырех аминокислотных остатков - Б-аланина, D-глутаминовой к-ты, L-лизина или диаминопимелиновой к-ты (ДАП) и D-аланина в молярном отношении 1:1:1:1. В составе пептида в зависимости от вида Б. могут наблюдаться вариации. Лизин или ДАП могут быть заменены орнитином, 2,6-диаминобутаровой к-той и др. Иногда к остатку глутаминовой к-ты присоединена добавочная аминокислота. Пептидные цепи соединены друг с другом с помощью перекрестных полипептидных цепочек, состав к-рых широко варьирует у разных видов Б. Перекрестные связи, напр. у стафилококка, образованы пентаглициновыми мостиками, соединяющими D-аланин одной пептидной единицы с лизином другой. У нек-рых Б. перекрестные связи идентичны пептидным единицам. У E. coli пептидные цепи соединены непосредственно друг с другом через D-аланин одной цепи и ДАП другой. Схематическое изображение пептидогликана представлено на рис. 5.
У грамположительных Б. в дополнение к пептидогликану имеются тейхоевые кислоты (рибит-тейхоевые и глицерин-тейхоевые), также образующие полимер и ковалентно связанные с пептидогликанОм. У нек-рых Б. обнаружены тейхуроновые и 2-аминоманнуровая кислоты.
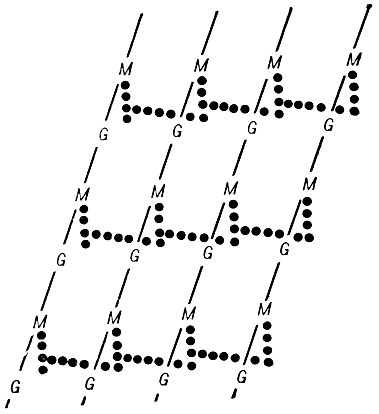
Рис. 5. Схематическое изображение пептидогликана: цепочки (косые линии) составлены из N-ацетилглюкозамина (G) и N-ацетилмурамовой к-ты (М). Вертикально расположенные точки - пептидные субъединицы, горизонтально расположенные точки - перекрещивающиеся пептидные мостики, связывающие цепочки в единую структуру пептидогликана
В состав клеточных стенок грамотрицательных Б., кроме ригидного слоя, входят липопротеиновый и липополисахаридный слои. Липополисахаридный слой (ЛПС) наиболее изучен у энтеробактерий, и особенно сальмонелл. Л ПС представляет собой комплекс фосфорилированных гетерополисахаридов, ковалентно связанных с содержащим глюкозамин липидом (липид А). В состав ЛПС входит О-антиген клетки (у энтеробактерий). Полисахаридная часть ЛПС состоит из основной (базисной) структуры и О-антигенной части. В состав базисной части, присущей всем энтеробактериям, входят гептоза, 2-кето-3-дезоксиоктонат (КДО), глюкоза, галактоза и N-ацетил-глюкозамин. Через КДО базисная часть присоединена к компоненту, состоящему из липида А, этаноламина, фосфата и КДО. С другой стороны (наружной) к базисной структуре присоединены боковые цепи, образованные повторяющимися олигосахаридными единицами. Наружные полисахаридные цепи видоспецифичны и являются соматическими О-антигенами. О-специфичность определяется углеводным составом всей боковой цепи, последовательностью расположения в ней углеводов и концевым сахаром, 6-дезокси- или 3,6-дидезоксигексозой. Наследственные нарушения в биосинтезе ЛПС энтеробактерий базисной части или О-боковых цепей приводят к появлению R-форм мутантов (см. Диссоциация бактерий).
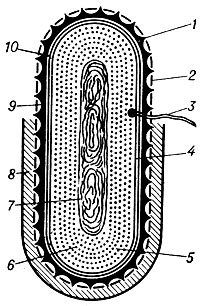
Рис. 6. Строение клетки энтеробактерии (схематическое изображение): 1 - детерминантные группы О-антигена; 2 - липопр отеиновый слой; 3 - жгутик (Н-антиген); 4 - цитоплазматическая мембрана; 5 и 6 - рибосомы в цитоплазме; 7 - нуклеоид; 8 - капсула; 9 - липополисахаридный слой; 10 - ригидный слой клеточной стенки
Липопротеиновый слой (ЛП) у грамотрицательных Б., по представлению Вейделя (Weidel), является наружным слоем клеточной стенки. ЛПС занимает промежуточное положение, наиболее глубоко расположенным является ригидный слой. Эта схема не объясняет обнаружение О-антигена без предварительного разрушения ЛП. Поэтому были предложены другие схемы строения стенки, согласно к-рым ЛП покрывает бактериальную клетку не сплошным слоем, а через него проходит ЛПС в виде "отростков", как это показано на рис. 6. Это представление подтверждено иммунохимическими методами с использованием ферритина при изучении локализации О-антигена.
У нек-рых грамположительных Б. клеточная стенка, так же как и у грамотрицательных, состоит не только из ригидного слоя, но имеет многослойное строение. Напр., у стрептококков в ее состав входит белковый слой, промежуточный липополисахаридный и внутренний ригидный слой. Клеточная стенка не является инертной структурой в ферментативном отношении. В ее составе обнаружены аутолитические ферменты, фосфатаза, аденозинтрифосфатаза.
Цитоплазматическая мембрана Б. прилегает к внутренней поверхности клеточной стенки, отделяет ее от цитоплазмы и является очень важным в функциональном отношении компонентом клетки. В мембране локализованы окислительно-восстановительные ферменты, с системой мембран связаны такие важнейшие функции клетки, как деление, биосинтез ряда компонентов, хемо- и фотосинтез и др. Толщина мембраны у большинства Б. составляет 7-10 нм. Электронномикроскопическим методом обнаружено, что она состоит из трех слоев: двух электронно-плотных и промежуточного - электронно-прозрачного. В состав мембраны входят белки, фосфолипиды, липопротеины, небольшое количество углеводов и нек-рых других соединений. Многие белки мембраны Б. являются ферментами, участвующими в процессах дыхания, а также в биосинтезе компонентов клеточной стенки и капсулы. В составе мембраны определяются также пермеазы, обеспечивающие перенос в клетку растворимых веществ. Мембрана служит осмотическим барьером, она обладает избирательной полупроницаемостью и ответственна за поступление внутрь клетки питательных веществ и выход из нее продуктов обмена.
Помимо цитоплазматической мембраны, в клетке Б. имеется система внутренних мембран, получивших название мезосом, к-рые, вероятно, являются производными цитоплазматической мембраны; их строение варьирует у разных видов Б. Наиболее развиты мезосомы у грамположительных Б. Строение мезосом неоднотипно, их полиморфизм отмечается даже у одного и того же вида Б. Внутренние мембранные структуры могут быть представлены простыми инвагинациями цитоплазматической мембраны, образованиями в виде пузырьков или петель (чаще у грамотрицательных Б.), в виде вакуолярных, ламмелярных, тубулярных образований. Мезосомы чаще всего локализованы у клеточной перегородки (рис. 7), отмечается также их связь с нуклеоидом. Поскольку в мезосомах обнаружены ферменты дыхания и окислительного фосфорилирования, многие авторы считают их аналогами митохондрий клеток высших. Предполагается, что мезосомы принимают участие в делении клетки, распределении дочерних хромосом в разделяющиеся клетки и спорообразовании. С мембранным аппаратом клетки связаны также функции фиксации азота, хемо- и фотосинтеза. Следовательно, можно полагать, что мембраны клетки играют определенного рода координирующую роль в пространственной организации ряда ферментных систем и органелл клетки.
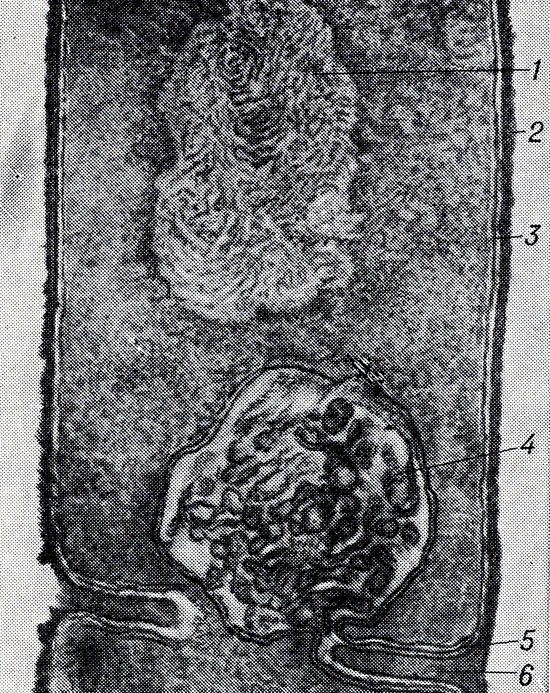
Рис. 7. Bac. subtilis: 1 - нуклеоид; 2 и 5 - клеточная стенка; 3 - цитоплазматическая мембрана; 4 - мезосома; 6 - клеточная перегородка (ультратонкий срез, электронограмма; ×190000)
Цитоплазма и в ключения. Внутреннее содержимое клетки состоит из цитоплазмы (см.), представляющей собой сложную смесь различных органических соединений, находящихся в коллоидном состоянии. На ультратонких срезах цитоплазмы (рис. 7) обнаружено большое количество зерен, значительная часть к-рых является рибосомами. В цитоплазме Б. могут содержаться внутриклеточные включения (цветн. табл., ст. 584, рис. 4-6) в виде гранул гликогена, крахмала, жировых веществ. У ряда Б. в цитоплазме находятся гранулы волютина, состоящие из неорганических полифосфатов, метафосфатов и соединений, близких к нуклеиновым кислотам. Роль волютина до конца не ясна. Нек-рые авторы на основании его исчезновения при голодании клеток рассматривают волютин как запасные питательные вещества. Волютин обладает сродством к основным красителям, проявляет хромофильность и метахромазию, легко выявляется в клетках в виде крупных гранул, особенно при специальных методах окраски.
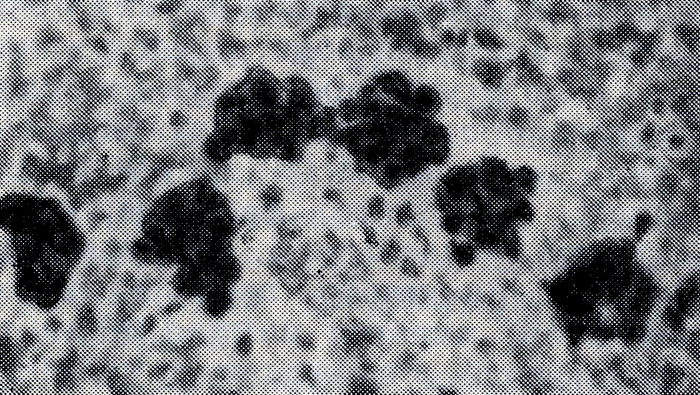
Рис. 8. Полисомы - темные скопления (электронограмма)
Рибосомы Б. являются местом синтеза белков клетки, в процессе к-рого образуются структуры, состоящие из большого числа рибосом (до 20), называемые полирибосомами или чаще полисомами (рис. 8). В образовании полисом принимает участие м-РНК. По окончании синтеза данного белка полисомы вновь распадаются на одиночные рибосомы, или субъединицы. Рибосомы могут располагаться свободно в цитоплазме, но значительная их часть связана с мембранами клетки. На улътратонких срезах большинства Б. рибосомы обнаруживаются в цитоплазме в виде гранул диам. ок. 20 нм. Рибосомы E. coli, очищенные в присутствии ионов магния, осаждаются при ультрацентрифугировании со скоростью седиментации 70 S. При более низких концентрациях магния они диссоциируют на две субъединицы с константами седиментации 50 S и 30 S. Полагают, что 50 S частица имеет сферическую, а 30 S - уплощенную форму. При повышении концентрации ионов магния 70 S частицы образуют димеры. В свободном состоянии (вне синтеза белка) рибосомы находятся в диссоциированном состоянии в рибосомной фракции клеток. Диссоциацию рибосом на субъединицы стимулирует специальный фактор Диссоциации. 50 S и 30 S субъединицы имеют мол. вес 1,8⋅106 и 0,85⋅106 соответственно. Обе частицы состоят из рибосомальной РНК (или р-РНК) и белка. 50 S частица содержит по одной молекуле 23 S и 5 S р-РНК. 30 S частица содержит одну молекулу и S р-РНК. Белковый состав рибосом неоднороден. 30 S частицы состоят из двадцати одного, а 50 S из тридцати-тридцати пяти различных слков. Часть белков 30 S частиц ризи со своеобразием строения получившей название нуклеоида (рис. 9). Нуклеоиды Б. содержат основное количество ДНК клетки. Они окрашиваются методом Фейльгена (см. Дезоксирибонуклеиновые кислоты), хорошо видны при окраске по Романовскому-Гимзе (см. Романовского-Гимзы метод), после кислотного гидролиза или в живом состоянии при фазово-контрастной микроскопии, а также на ультратонких срезах в электронном микроскопе (рис. 7 и 9). Нуклеоид определяется в виде компактного одиночного или двойного образования. У растущих культур нуклеоиды часто выглядят в виде раздвоенных образований, что отражает их деление. Митотического деления ядерных структур у Б. не обнаружено. Форма нуклеоидов и их распределение в клетке весьма изменчивы и зависят от ряда причин, в т. ч. и от возраста культуры. На электронных микрофотографиях в местах расположения нуклеоидов видны светлые участки меньшей оптической плотности. Ядерная вакуоль не отделена от цитоплазмы ядерной оболочкой. Форма вакуоли не постоянна. Ядерные участки заполнены пучками тонких нитей, образующих сложное переплетение. В составе ядерных структур Б. не обнаружены гистоны (см.); предполагают, что их роль у Б. выполняют полиамины. Ядра Б. не похожи на ядра других организмов. Это послужило основой для выделения Б. в группу прокариотов, в отличие от эукариотов, обладающих ядром, содержащим хромосомы, оболочку и делящимся путем митоза. Нуклеоид Б. соединен с мезосомой. Характер связи пока не известен. Хромосома бактерий имеет циркулярно замкнутую структуру. Это было показано методом радиоавтографии у E. coli (рис. 10), предварительно меченных 3Н-тимидином. О структуре ДНК судили по распределению зерен меченого тимидина. Подсчитано, что длина замкнутой в кольцо ДНК клетки составляет 1100-1400 мкм, а мол. вес 2,8⋅109 [Кернс (J. Cairns), 1963].
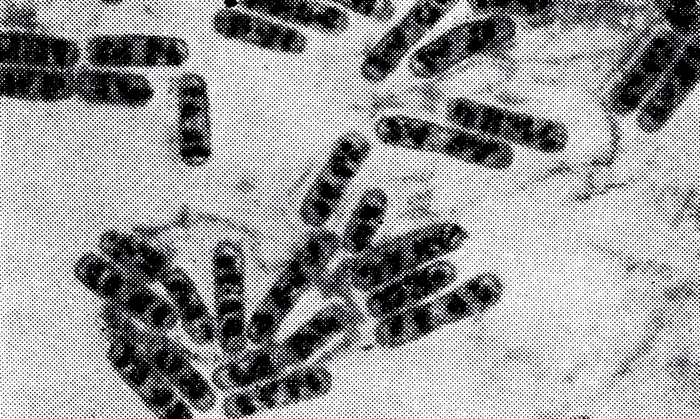
Рис. 9. Нуклеоиды Bac. eereus - темные скопления внутри клеток (окраска по Романовскому-Гимзе)
Жгутики и ворсинки. На поверхности нек-рых Б. имеются органеллы движения - жгутики (рис. 11). Их можно обнаружить с помощью особых методов окраски, микроскопирования в темном поле или в электронном микроскопе. Жгутики имеют спиралевидную форму, причем шаг спирали специфичен для каждого вида Б. На основании количества жгутиков и их расположения на поверхности клетки различают следующие группы подвижных микробов: монотрихи, амфитрихи, лофотрихи и перитрихи. Монотрихи имеют один жгутик, расположенный на одном из полюсов клетки и реже субполярно или латерально. У амфитрихов на каждом полюсе клетки расположено по одному жгутику. Лофотрихи имеют пучок жгутиков на одном или двух полюсах клетки. У перетрихов жгутики распределены без определенного порядка по всему телу клетки.
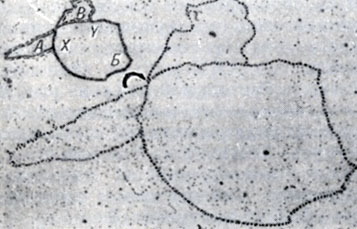
Рис. 10. Радиоавтография хромосомы E. coli. Видна циркулярнозамкнутая структура; слева сверху - схема репликации; X - начальная точка репликции; Y - точка роста; А - отреплецированный участок; Б - неотреплецированный участок; В - репликационная точка
М. А. Пешков (1966) предлагает несколько другую терминологию. Амфи- и лофотрихи он объединяет термином "мультрихи" и выделяет смешанный тип, имеющий два или более жгутиков разного вида в разных точках прикрепления. Основание жгутиков (блефаропласт) расположено в цитоплазматической мембране. Жгутики почти целиком состоят из белка - флагеллина.
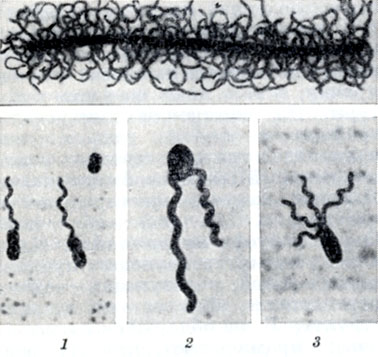
Рис. 11. Характер расположения жгутиков у бактерий; вверху - перитрих; 1 - монотрихи, 2 - амфитрих, 3 - лофотрих
На поверхности нек-рых Б. (энтеробактерии), кроме жгутиков, имеются ворсинки (фимбрии, пили), видимые только под электронным микроскопом (рис. 12). Различают несколько морфологических типов ворсинок. Наиболее полно изучен первый тип (общий) и ворсинки, существующие только при наличии в клетке половых факторов (см. Половой фактор бактерий). Ворсинки общего типа покрывают всю поверхность клетки, состоят из белка; половых ворсинок приходится 1-4 на клетку. И те и другие обладают антигенной активностью (см. Конъюгация у бактерий).
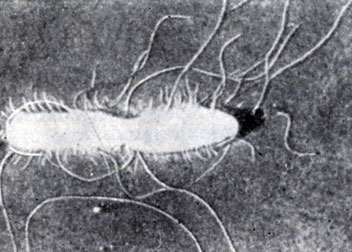
Рис. 12. Жгутики и ворсинки у S. typhi (электронограмма)
Физиология. По химическому составу Б. не отличаются от других организмов.
В состав Б. входят углерод, азот, водород, кислород, фосфор, сера, кальций, калий, магний, натрий, хлор и железо. Их содержание зависит от вида Б. и условий культивирования. Обязательным хим. компонентом клеток Б., как и других организмов, является вода, представляющая собой универсальную дисперсионную среду живой материи. Основная часть воды находится в свободном состоянии; ее содержание различно у разных Б. и составляет 70-85% влажного веса Б. Кроме свободной, имеется ионная фракция воды и вода, связанная с коллоидными веществами. По составу органических компонентов клетки Б. сходны с клетками других организмов, отличаясь, однако, наличием нек-рых соединений. В состав Б. входят белки, нуклеиновые кислоты, жиры, моно-, ди- и полисахариды, аминосахара и др. У Б. имеются необычные аминокислоты: диаминопимелиновая (содержащаяся еще у сине-зеленых водорослей и риккетсий); N-метиллизин, входящий в состав флагеллина нек-рых Б.; D-изомеры нек-рых аминокислот. Содержание нуклеиновых кислот зависит от условий культивирования, фаз роста, физиол. и функционального состояния клеток. Содержание ДНК в клетке более постоянно, нежели РНК. Нуклеотидный состав ДНК неизменен в процессе развития Б., видоспецифичен и используется как один из важнейших таксономических признаков. Бактериальные липиды разнообразны. Среди них встречаются жирные кислоты, фосфолипиды, воски, стероиды. Нек-рые Б. образуют пигменты (цветн. табл., ст. 584, рис. 7-9) с интенсивностью, к-рая широко варьирует у одного и того же вида и зависит от условий выращивания. Твердые питательные среды более благоприятны для образования пигментов. По хим. строению различают каратиноидные, хиноновые, меланиновые и другие пигменты, к-рые могут быть красного, оранжевого, желтого, коричневого, черного, синего или зеленого цвета. Чаще пигменты нерастворимы в питательных средах и окрашивают только клетки. Пигменты, растворимые в воде (пиоцианин), диффундируют в среду, окрашивая ее. К пигментам Б. относится также бактериохлорофилл, придающий фиолетовую или зеленую окраску нек-рым фотосинтезирующим Б.
Ферменты Б. делятся на функционирующие только внутри клетки (эндоферменты) и только вне клетки (экзоферменты). Эндоферменты в основном катализируют синтетические процессы, дыхание и т. п. Экзоферменты катализируют гл. обр. гидролиз высокомолекулярных субстратов до соединения с более низким мол. весом, способных проникать внутрь клетки.
В клетке ферменты связаны с соответствующими структурами и органеллами. Напр., аутолитические ферменты связаны с клеточной стенкой, окислительно-восстановительные ферменты - с цитоплазматической мембраной, ферменты, связанные с репликацией ДНК,- с мембраной или нуклеоидом.
Активность ферментов зависит от ряда условий, в первую очередь от температуры выращивания Б. и pH среды. Понижение температуры обратимо снижает, а повышение до определенных пределов (40-42°) повышает активность ферментов. У термофильных и психрофильных Б. оптимум активности ферментов совпадает с оптимальной температурой роста. Оптимальная температура для мезофильных Б., к к-рым принадлежат патогенные Б., примерно равна 37°. Оптимум pH в основном лежит в пределах 4-7. Встречаются вариации оптимума pH. Ферменты Б., активность к-рых не зависит от присутствия субстрата в среде культивирования, называют конститутивными. Ферменты, синтез к-рых зависит от наличия субстрата в среде, называются индуцируемыми (старое название - адаптивные). Напр., образование β-галактозидазы у кишечной палочки начинается только при добавлении в среду лактозы, к-рая индуцирует синтез этого фермента.
Контроль синтеза ферментов осуществляется путем ингибирования конечным продуктом или путем индукции и репрессии.
Ферментативная активность Б. используется для их идентификации, чаще всего при этом изучаются сахаролитические и протеолитические свойства. Нек-рые ферменты, образуемые патогенными Б., являются факторами вирулентности (см.).
Питание. Б. используют питательные вещества только в виде относительно небольших молекул, проникающих внутрь клетки. Такой способ питания, характерный для всех организмов растительного происхождения, называют голофитным. Сложные органические вещества (белок, полисахариды, клетчатка и др.) могут служить источником питания и энергии только после их предварительного гидролиза до более простых соединений, растворимых в воде либо в липоидах. Способность различных соединений проникать в цитоплазму клеток зависит от проницаемости цитоплазматической мембраны и хим. структуры питательного вещества.
Вещества, к-рые служат источником питания Б., поразительно разнообразны. Важнейшим элементом, необходимым для живых организмов, является углерод. Одни виды Б. (аутотрофы) могут использовать неорганический углерод из углекислоты и ее солей (см. Аутотрофные организмы), другие (гетеротрофы) - только из органических соединений (см. Гетеротрофные организмы). Подавляющее большинство Б. относится к гетеротрофам. Для усвоения углерода требуется посторонний источник энергии. Немногочисленные виды Б., обладающие фотосинтетическими пигментами, используют энергию солнечного света. Эти Б. называются фотосинтезирующими. Среди них имеются аутотрофы (зеленые и пурпурные серобактерии) и гетеротрофы (несерные пурпурные Б.). Их называют также соответственно фотолитотрофами и фотоорганотрофами. Большинство же Б. использует энергию хим. реакций и называется хемосинтезирующими. Хемосинтезирующие аутотрофы называются хемолитотрофами, а гетеротрофы - хемоорганотрофами.
Гетеротрофные Б. усваивают углерод из органических соединений различной хим. природы. Легко усваиваются вещества, содержащие ненасыщенные связи или атомы углерода с частично окисленными валентностями. В связи с этим наиболее Доступными источниками углерода являются сахара, многоатомные спирты и др. Нек-рые гетеротрофы наряду с усвоением органического Углерода могут усваивать и неорганический углерод.
Отношение Б. к источникам азота также различно. Существуют Б., Усваивающие минеральный и даже атмосферный азот. Другие Б. неспособны синтезировать белковую молекулу или нек-рые аминокислоты простейших соединений азота. Е этой группе имеются формы, использующие азот из отдельных аминокислот, из пептонов, сложных белковых веществ и из минеральных источников азота с добавлением несинтезируемых ими аминокислот. К этой группе принадлежат многие патогенные Б.
Кроме источников азота и углерода, Б. нуждаются в фосфоре, сере, калии, магнии, железе, микроэлементах, а также в дополнительных факторах роста (см. Бактериальные факторы роста).
Дыхание. Часть веществ, проникающих внутрь бактериальной клетки, окисляясь, снабжает ее необходимой энергией. Этот процесс называют биол. окислением или дыханием.
Биологическое окисление сводится в основном к двум процессам: дегидрированию субстрата с последующим переносом электронов к конечному акцептору и накоплению в биологически доступной форме высвобождающейся энергии. Конечным акцептором электронов могут служить кислород, нек-рые органические и неорганические соединения. При аэробном дыхании конечным акцептором электронов является кислород. Энергетические процессы, в к-рых конечным акцептором электронов является не кислород, а другие соединения, называются анаэробным дыханием, причем к собственно анаэробному дыханию нек-рые исследователи относят те процессы, когда конечным акцептором электронов являются неорганические соединения (нитраты и сульфаты).
Под брожением понимают такие энергетические процессы, в к-рых органические соединения выступают одновременно как доноры и как акцепторы электронов.
Среди Б. имеются строгие аэробы (см.), развивающиеся только в присутствии кислорода, облигатные анаэробы, развивающиеся только в отсутствие кислорода, и факультативные анаэробы (см.), способные к развитию и в аэробных и в анаэробных условиях. Большинство Б. обладает пространственно организованной системой дыхательных ферментов, получившей название дыхательной цепи или цепи переноса электронов.
Дыхание у Б., подобно дыханию других организмов, сопряжено с процессами окислительного фосфорилирования, сопровождается образованием соединений, богатых макроэргическими связями (АТФ). Энергия, накапливающаяся в этих соединениях, используется по мере необходимости.
В качестве источника энергии Б. могут использовать разнообразные органические соединения (углеводы, азотсодержащие вещества, жиры и жирные кислоты, органические кислоты и др.). Способность получать энергию в результате окисления неорганических соединений присуща лишь небольшой группе Б. Неорганические вещества, окисляемые ими, специфичны для каждого вида Б. К этим Б. относятся нитрифицирующие Б., серобактерии, железобактерии и др. Среди них имеются и аэробы и анаэробы.
Фотосинтезирующие Б. превращают энергию видимого света непосредственно в АТФ; этот процесс, осуществляемый в ходе фотосинтеза, называют фотофосфорилированием.
Рост и размножение. Бактериальная клетка начинает делиться после завершения последовательных реакций, связанных с воспроизведением ее компонентов.
Наиболее важным процессом роста клетки является воспроизведение ее наследственного аппарата. Разделению нуклеоида предшествуют процессы репликации ДНК (см. Репликация). Репликация начинается, когда отношение ДНК/белок клетки достигнет определенного уровня. Для инициации репликации требуется синтез специфических белковых продуктов. На реплицирующейся ДНК клетки при изучении ауторадиографическим методом различают две точки: точку начала репликации и точку роста (рис. 10). Репликативная точка продвигается по всей ДНК клетки, имеющей, как отмечалось, циркулярно замкнутую структуру. Время прохождения точки репликации от начала до конца всей циркулярной структуры ДНК, или время синтеза ДНК, постоянно и не зависит от скорости роста клеток. У быстро растущих культур, когда время генерации (время, протекающее между делением клеток) меньше, чем время, необходимое для репликации ДНК (40-47 мин. у E. coli B/r), новая инициация начинается до окончания предыдущей. Т. о., у быстро растущих культур имеется несколько репликационных точек (вилок). Процесс репликации ДНК сопровождается сегрегацией синтезирующихся цепей ДНК во вновь образующиеся дочерние клетки. В разделении нитей ДНК большую роль играют мезосомы клетки.
Рост палочковидных клеток во время цикла генерации сводится к экспоненциальному увеличению их длины. Во время деления рост клетки замедляется и начинается вновь после деления.
Окончание репликации ДНК является моментом, инициирующим деление клетки. Угнетение синтеза ДНК до окончания репликации приводит к нарушению процесса деления: клетка перестает делиться и растет в длину. На примере E. coli показано, что для начала деления требуется наличие термолабильного белка и такое соотношение между отдельными полиаминами в клетке, при к-ром количество путресцина должно превышать количество спермидина. Имеются данные о значении фосфолипидов и аутолизннов для процесса деления клеток.
У растущей культуры Б. синтезируется полный набор рибосом. Рибосомальная РНК первоначально синтезируется на ДНК-матрице, затем модифицируется и превращается в зрелые 16 S и 23 S р-РНК. 5 S р-РНК также не является прямым продуктом транскрипции (см.). Предшественники рибосом не содержат полного набора рибосомальных белков. Полный набор появляется только в процессе созревания.
Механизм воспроизведения мезосом, как и мембранного аппарата клетки, еще не ясен. Предполагают, что при росте бактериальной клетки мезосомы постепенно разделяются.
При росте бактериальной клетки клеточная перегородка формируется рядом с мезосомой (рис. 7). Образование перегородки приводит к делению клетки. Вновь образованные дочерние клетки отделяются друг от друга. У нек-рых Б. образование перегородки не приводит к разделению клеток: образуются многокамерные клетки.
Получен ряд мутантов у E. coli, у к-рых клеточная перегородка образуется либо в необычном месте, либо наряду с перегородкой с обычной локализацией формируется добавочная перегородка близко от полюса клетки. В результате деления таких мутантов образуются как обычные клетки, так и маленькие клетки (мини-клетки) размером 0,3-0,5 мкм. Мини-клетки лишены, как правило, ДНК, т. к. при делении родительской клетки нуклеоид не попадает в них. В связи с отсутствием ДНК мини-клетки используются в генетике Б. для изучения выражения функции генов у внехромосомных факторов наследственности и других вопросов.
При выращивании в жидких питательных средах скорость роста популяции клеток изменяется во времени. Рост популяции Б. разделяют на несколько фаз. После посева клеток в свежую питательную среду нек-рое время Б. не размножаются - эту фазу называют начальной стационарной или лаг-фазой. Лаг-фаза переходит в фазу положительного ускорения. В этой фазе начинается деление Б. Когда скорость роста клеток всей популяции достигает постоянной величины, начинается логарифмическая фаза размножения. В этот период можно рассчитать время генерации, количество генераций и нек-рые другие показатели. Логарифмическая фаза сменяется фазой отрицательного ускорения, затем наступает стационарная фаза. Количество жизнеспособных клеток в данной фазе постоянно (М-концентрация - макс. конц. жизнеспособных клеток). Затем следует фаза отмирания популяции. На скорость роста популяции влияют: вид культуры Б., возраст посеянной культуры, состав питательной среды, температура выращивания, аэрация и др.
Во время роста популяции клеток в них накапливаются продукты обмена, происходит истощение питательных веществ и другие процессы, ведущие к переходу в стационарную и последующие фазы. При постоянном добавлении питательных веществ и одновременном удалении продуктов обмена можно добиться длительного пребывания клеток популяции в логарифмической фазе. Наиболее часто для этой цели применяют хемостат (см.).
Несмотря на постоянную скорость роста популяции Б. в логарифмической фазе, отдельные клетки все же находятся в разных стадиях деления. Иногда важно синхронизировать рост всех клеток популяции, т. е. получить синхронную культуру. Простыми методами синхронизации является изменение температурных условий или культивирование в условиях недостатка питательных веществ. Вначале культуру помещают в неоптимальные условия, затем сменяют их оптимальными. При этом у всех клеток популяции синхронизируется цикл деления, но синхронное деление клеток происходит обычно не более 3-4 циклов.
Ранее неоднократно выдвигались гипотезы, согласно к-рым превращение одних форм Б. в другие в цикле развития идет по замкнутому кругу. Все эти гипотезы объединяются общим термином "циклогения". Теоретические представления о циклогении имеют в наст, время лишь исторический интерес. Однако фактические данные о процессах диссоциации бактерий (см.) не потеряли своего значения.
Действие внешних факторов. Жизнеспособность Б. при действии внешних факторов изучают разными методами, напр. путем подсчета выживших клеток. Для этого строят кривые выживаемости, выражающие зависимость числа выживших клеток от времени воздействия.
Б. относительно устойчивы к низким температурам. Б. более чувствительны к действию высоких температур. Обычно при прогревании Б. при t° 60-70° происходит гибель вегетативных клеток, споры при этом не погибают. Чувствительность Б. к высоким температурам используется при стерилизации (см.).
Разные виды Б. относятся по-разному к высушиванию. Одни Б. (напр., гонококки) очень быстро погибают, другие (микобактерии) весьма устойчивы. Однако соблюдая определенные условия (наличие вакуума, специальных сред), можно получить высушенные лиофилизированные культуры Б., длительное время сохраняющие жизнеспособность (см. Лиофилизация).
Б. можно разрушить путем механического растирания с различными порошками (стеклянный, кварцевый), а также воздействием ультразвука.
Б. чувствительны к ультрафиолетовым лучам; наиболее эффективны лучи с длиной волны ок. 260 нм, что соответствует максимуму поглощения их нуклеиновыми кислотами. Ультрафиолетовые лучи обладают мутагенным действием. Рентгеновские лучи также обладают летальным и мутагенным действием (см. Мутагены).
Чувствительность к химиотерапевтическим препаратам и антибиотикам зависит от вида Б. и механизма действия препарата на клетку. Из чувствительных Б. могут быть получены устойчивые формы в результате мутации или при передаче факторов множественной лекарственной устойчивости микроорганизмов (см.).
Распространение бактерий в природе и их роль в круговороте веществ. Патогенность и вирулентность. Б. обитают в почве, воде, организме человека и животных. Разнообразные группы Б. могут развиваться в условиях, не доступных для других организмов. Качественный и количественный состав Б., обитающих во внешней среде, зависит от многих условий: pH среды, температуры, наличия питательных веществ, влажности, аэрации, присутствия других микроорганизмов (см. Антагонизм микробов) и др. Чем больше в среде содержится разнообразных органических соединений, тем большее количество Б. можно в ней обнаружить. В незагрязненных почвах и водах встречается сравнительно небольшое количество сапрофитных форм Б. В почве обитают спорообразующие и неспорообразующие Б., микобактерии, миксобактерии, кокковые формы. В воде встречаются разнообразные спорообразующие и неспорообразующие Б. и специфические водные Б. - водные вибрионы, нитчатые Б. и др. В иле на дне водоемов обитают различные анаэробные Б. Среди Б., обитающих в воде и почве, имеются азотфиксирующие, нитрифицирующие, денитрифицирующие, расщепляющие целлюлозу Б. и др. В морях и океанах обитают Б., растущие при высоких концентрациях солей и повышенном давлении, встречаются светящиеся виды. В загрязненных водах и почве, кроме почвенных и водных сапрофитов, в большом количестве встречаются Б., обитающие в организме человека и животных, - энтеробактерии, клостридин и др. Показателем фекального загрязнения обычно является наличие кишечной палочки. В связи с широким распространением Б. и своеобразием метаболической активности многих их видов они имеют исключительно большое значение в круговороте веществ в природе. В круговороте азота участвуют многие виды Б. - от видов, расщепляющих белковые продукты растительного и животного происхождения, до видов, образующих нитраты, к-рые усваиваются высшими растениями. Метаболическая активность Б. обусловливает минерализацию органического углерода и образование углекислоты, возврат к-рой в атмосферу важен для поддержания жизни на Земле. Усвоение углекислоты из атмосферы производится зелеными растениями благодаря их фотосинтетической активности. Большая роль принадлежит Б. в круговороте серы, фосфора, железа.
Сравнительно небольшая часть всех известных микробов способна вызывать заболевания человека и животных. Потенциальная способность Б. вызывать инфекционные заболевания, являющаяся их видовым признаком, называется болезнетворностью или патогенностью. У одного и того же вида степень выраженности патогенных свойств может довольно широко варьировать. Степень патогенности штамма определенного вида Б. называется его вирулентностью (см.). Среди Б. имеются условно патогенные виды, болознетворность к-рых зависит от состояния макроорганизма, внешней среды и др.
Генетика бактерий - раздел общей генетики, изучающий наследственность и изменчивость у Б. Относительная простота организации Б., их способность расти в синтетических средах, быстрое размножение позволяют анализировать относительно редко возникающие изменения генома (см.) Б., составляющих многомиллиардные популяции, и проследить за их наследованием. Для этого используются специальные методы, обеспечивающие отбор из огромной популяции отдельных генетически измененных бактериальных клеток, передачу хромосомы или ее фрагментов от одних клеток (доноров) другим (реципиентам) с последующим генетическим анализом возникших рекомбинантов (см. Рекомбинация). Методы генетического анализа (см.) Б. позволили изучить не только организацию бактериальной хромосомы, но и расшифровать тонную структуру гена, а также установить функциональные взаимоотношения генетических единиц, составляющих отдельные бактериальные опероны (см.).
Развитие генетики Б. связано с изучением бактериальной трансформации (см.), к-рое дало возможность установить роль ДНК как материальной основы наследственности. При изучении генетической трансформации у Б. были разработаны методы экстракции и очистки ДНК, биохимические и биофизические методы анализа ее свойств. Это позволило не только изучать генетические изменения на клеточном уровне, но и сопоставлять эти изменения с изменением структуры ДНК. Т. о., в совокупности с генетическими методами методы биохимического исследования генетического материала обеспечили возможность анализа закономерностей бактериальной генетики на молекулярном уровне.
Среди Б. наиболее изученными в генетическом отношении являются кишечные палочки, у к-рых были открыты способы передачи генетического материала (хромосомы или ее фрагментов) от донора реципиенту, осуществляемые либо путем прямого скрещивания (см. Конъюгация у бактерий), либо с помощью бактериальных вирусов (см. Трансдукция). Другими микроорганизмами, обладающими такими же видами обмена генетическим материалом и по генетической характеристике приближающимися к кишечным палочкам, являются сальмонеллы.
Закономерности генетического обмена, установленные на кишечных палочках и сальмонеллах, присущи и ряду других микроорганизмов, играющих важную роль в инфекционной патологии. Феномены конъюгации и трансдукции обнаружены также у шигелл и нек-рых других патогенных микроорганизмов, что позволяет осуществить генетический анализ факторов, обусловливающих их патогенность.
Для выяснения молекулярных механизмов, различных генетических феноменов значительный интерес представляют микроорганизмы, способные к генетической трансформации, при к-рой бактерии-реципиенты поглощают очищенную ДНК, экстрагированную из бактерий-доноров. В опытах трансформации выявляется генетическая активность изолированной, внеклеточной ДНК, что позволяет анализировать функциональную активность ДНК, подвергнутой различным воздействиям, изменяющим ее структуру как in vivo, так и in vitro.
Поэтому в молекулярно-генетических исследованиях широко используются трансформируемые виды Б., такие как Bac. subtilis, H. influenzae, Pneumococcus и др.
Свойства Б., как и любых других организмов, определяются набором присущих им генов. Запись генетической информации, закодированной в бактериальных генах, осуществлена на основе универсального триплетного кода (см. Генетический код). Яновским (C. Janofsky) были получены доказательства колинеарности (соответствия) между последовательностью нуклеотидов и последовательностью аминокислот в полипептиде и установлен in vivo состав отдельных триплетов, кодирующих включение различных аминокислот.
Набор генов, присущих Б., определяет их генотип (см.). Б., обладающие одним и тем же генотипом, не всегда идентичны по своим свойствам; их свойства могут варьировать в зависимости от среды культивирования, возраста бактериальных культур, температуры выращивания и ряда других факторов внешней среды. Генотип определяет только потенциально присущие бактериальным клеткам свойства, выражение к-рых зависит от функционирования (активности) конкретных генетических структур. Хромосома Б. включает 2 типа функционально различных генетических структур: структурные гены, детерминирующие специфичность белков, к-рые данная клетка способна синтезировать, и регуляторные гены, регулирующие активность структурных генов в зависимости от окружающих условий, в частности от наличия или отсутствия субстрата синтезируемого фермента либо от концентрации необходимого клетке соединения, от состояния генетического материала (репликация ДНК) и пр.
В активном состоянии структурные гены транскрибируются (см. Транскрипция), т. е. становятся доступными для считывания генетической информации с помощью ДНК-зависимой РНК-полимеразы. Формирующаяся в процессе транскрипции информационная РНК (и-РНК) транслируется в соответствующий полипептид, структура к-рого закодирована в данных структурных генах.
По типу регуляции синтетические системы Б. делят на 2 вида: катаболические и анаболические. Первые осуществляют утилизацию необходимой клетке энергии, вторые обеспечивают биосинтез соединений, необходимых Б.
Катаболическая система E. coli, осуществляющая расщепление лактозы на глюкозу и галактозу, детально изучена Жакобом и Моно (F. Jacob, J. Monod).
Ферменты этой системы (β-галактозидаза, галактозидпермеаза и галактозидтрансацетилаза) детерминируются соответствующими структурными генами. Рядом со структурными генами расположен регуляторный участок, так наз. оператор, "включающий" и "выключающий" считывание информации (транскрипцию) со структурных генов.
| Наименование бактерий, основные синонимы (использована номенклатура Bergey's Manual, 1957) | Размеры, форма, подвижность, культуральные свойства, окраска по Граму | Образование | Отношение к O2/образование каталазы | Восстановление | Разжижение | Образование | Ферментативное расщепление углеводов | Образование экзотоксина | Патогенность для животных и человека. Источники выделения | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| спор/капсулы | органических красителей | нитратов | желатины/свернутой сыворотки | индола/H2S | моносахариды | дисахариды | трисахариды | полисахариды | спирты | глюкозиды | |||||||||||||||||||||
| ксилоза | арабиноза | глюкоза | фруктоза | манноза | галактоза | лактоза | мальтоза | сахароза | раффиноза | крахмал | гликоген | инулин | декстрин | дульцит | маннит | сорбит | глицерин | адонит | инозит | салицин | амигдалин | ||||||||||
| 1. Actinobacillus mallei; Pfeifferella mallei; Bact. mallei; палочка сапа |
0,5-0, 8×2,0-5,0 мкм. Палочки с закругленными концами. Полиморфны. Встречается биполярная окраска. Неподвижны. Растут на обычных средах. В глицериновом бульоне-незначительное помутнение, пленка, выпадающая на дно. Колонии на желатине круглые, беловатые, прозрачные. Старые колонии с желтоватым оттенком. На картофеле характерный рост, напоминающий капли меда. Окраска по Граму отрицательная | -/- | фак ан/• |
• | - | -об/• | -/- | • | • | к нш |
• | • | • | • | • | • | • | • | • | • | • | • | к нш |
• | к нш |
• | • | • | • | - | Патогенен для морских свинок, кошек, кроликов. Возбудитель сапа у животных и человека |
| 2. Actinobacillus pseudomallei; Bact. pseudomallei |
0,5-0,8×2,0-5,0 мкм. Стройные палочки с закругленными концами окрашивающиеся, биполярно. Подвижны. Колонии на глицериновом агаре круглые, с неправильными краями, непрозрачные. В бульоне помутнение с пленкой. Окраска по Граму отрицательная | -/• | аэ/• | • | • | +/+ м |
-/• | • | • | к | • | • | • | к | к | к | • | • | • | • | • | • | к | • | • | • | • | • | • | • | Патогенен для крыс, мышей, морских свинок. Возбудитель мелиоидоза у животных и человека |
| 3. Aerobacter aerogenes; Bact. aerogenes; Bact. lactis aerogenes |
0,5-0,8×1,0-2,0 мкм. Палочки. Неподвижны. Колонии на агаре гладкие, влажные, непрозрачные, белые. На бульоне помутнение с пленкой и обильным осадком. Окраска по Граму отрицательная | +нш/- | фак ан/+ |
• | + | -/• | -/• | • | кг | кг | кг | • | кг | кг | кг | нш | кг | кг | • | • | кг | • | кг | кг | кг | кг | кг | кг | • | • | Выделяется из кишечника животных и человека |
| 4. Aerobacter cloacae; Bact. cloacae |
0,5-1,0×1,0-2,0 мкм. Палочки. Подвижны. Колонии на агаре круглые, непрозрачные, с белым центром. На бульоне помутнение с нежной пленкой. Окраска по Граму отрицательная | -/• | фак аэ/• |
• | + | +/• | -/• | кг | кг | кг | кг | • | кг | кг | кг | кг | кг | - об |
• | - об |
кг | - об |
кг | кг | кг | • | • | кг | • | • | Выделяется из кишечника животных и человека |
| 5. Alcaligenes faecalis; Bact. faecalis alcaligenes; фекальный щелочеобразователь |
0,5×1,0-2,0 мкм. Палочки. Подвижны. На желатине колонии серовато-белые, гладкие, блестящие, просвечивающие. В бульоне помутнение с пленкой и вязким осадком. Окраска по Граму отрицательная | -/- | аэ/• | • | +нш | -/• | -/• | - | - | - | - | - | - | - | - | - | - | - | • | • | - | - | - | • | • | • | • | • | • | • | Выделяется из кишечника человека |
| 6. Bac. anthracis; бацилла сибирской язвы; палочка сибирской язвы |
1,0-1,25×5,0-10,0 мкм. Грубые палочки с обрубленными концами. В культурах цепочки. Неподвижны. Колонии на агаре серовато-белые, неправильной формы, бахромчатые, локонообразные. В бульоне придонный рост. Окраска по Граму положительная | +/+ | фак аэ/• |
+ | +нш | +( м |
-/+ сл |
• | • | к | к | • | • | • | к | к | • | - | • | • | к | • | • | • | • | • | • | • | • | • | Патогенен для белых мышей, морских свинок, кроликов. Возбудитель сибирской язвы у животных и человека |
| 7. Bac. anthracoides; Bac. pseudoanthracis |
1,0-2, 0×3 , 5-4 ,0 мкм. Толстые палочки, часто в цепочке, нити. Подвижны. Колонии на агаре округлые, беловатые с бахромчатыми краями. В бульоне помутнение с пленкой и крошковидным осадком. Окраска по Граму положительная | +/- | фак аэ/• |
• | +нш | +( м |
-/• | • | • | • | • | • | • | • | • | • | • | + | • | • | • | • | • | • | • | • | • | • | • | • | Мыши заражаются ингаляционным путем. Выделяется из кишечника животных |
| 8. Bacteroides Iragilis; Bac. fragilis |
0,8×1,5-3,0 мкм. Палочки с закругленными концами. Неподвижны. Располагаются парами и поодиночке. Интенсивно окрашиваются у полюсов. На агаре колонии мелкие серые, неправильной формы. В бульоне помутнение. Окраска по Граму отрицательная | -/- | ан/- | • | - | - | -/- | • | к | к | к | • | к | к нш |
к | к | • | • | • | • | • | • | • | • | • | • | • | • | • | • | При подкожном введении кроликам, морским свинкам и мышам вызывает абсцессы. Выделяется у человека при гангренозном аппендиците, гангрене легких и гнойных процессах мочевых путей |
| 9. Bacteroides melaninogenicus; Bact. melaninogenicum |
0,5-0,8×1-2 мкм. Палочки с закругленными концами. Неподвижны. Колонии на кровяном агаре небольшие, черного цвета. Окраска по Граму отрицательная | -/- | ан/- | • | - | - | -/- | • | • | к | к | • | - | • | к | к | • | • | • | • | • | • | к | • | • | • | • | • | • | • | Выделяется из инфицированных хирургических ран человека |
| 10. Bordetella parapertussis; Haemophilus parapertussis; палочка паракоклюша |
0,6×2,0 мкм. Короткие овальные палочки Неподвижны. Колонии на кровяном агаре окружены зоной гемолиза. Растет на обычных средах, вырабатывает коричневый пигмент. Окраска по Граму отрицательная | -/- | аэ/+ | - | • | • | - | • | • | - | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | Вызывает пневмонию у мышей при интраназальном введении. Выделяется из дыхательных путей человека при коклюшеподобных заболеваниях |
| 11. Bordetella pertussis; Hemophilus pertussis; Bact. pertussis; палочка коклюша |
0,2-0,×0,5-2,0 мкм. Короткие овальные палочки, часто с биполярными зернами. Неподвижны. Колонии на кровяном агаре мелкие, прозрачные, очерченные, окружены зоной гемолиза. В живых средах помутнение с осадком. На желатине и свернутой сыворотке не растет. Окраска по Граму отрицательная | -/+ | аэ/+ | × | - | - | -/- | • | • | - | - | • | - | - | - | - | • | • | • | • | - | • | • | - | • | • | • | • | • | • | Внутрибрюшинное заражение морских свинок вызывает гибель от интоксикации. Внутрикожное заражение кроликов-альбиносов вызывает локальное кровоизлияние с последующим некрозом. Возбудитель коклюша |
| 12. Brucella abortus; Bact. abortus |
0,2-0,3×0,6-1,5 мкм. Мелкие короткие палочки. Неподвижны. Колонии на агаре мелкие, круглые, прозрачные. В бульоне слабое помутнение. Растут на средах с основным фуксином и не растут на средах с тионином (конц. 1:25000). Окраска по Граму отрицательная | -/- | фак ( аэ/+ |
НК - |
- | -/• | -/+ | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | Возбудитель инфекционного аборта у крупного рогатого скота. Восприимчивы кролики, морские свинки. Возбудитель бруцеллеза у человека |
| 13. Brucella melitensis; Micrococcus melitensis |
0,3-0,5×0,6-1,5 мкм. Мелкие короткие палочки. Неподвижны. Колонии на агаре мелкие, круглые, выпуклые: R-формы - грубозернистые. В бульоне помутнение с осадком. Растет на средах с тионином и основным фуксином в конц. 1:25000. Окраска по Граму отрицательная | -/- | аэ/+ | НК - |
+ нп |
-/• | -/+сл | Углеводов не разлагает | • | Возбудитель инфекционного аборта у коз, овец. Возбудитель бруцеллеза у человека | |||||||||||||||||||||
| 14. Brucella suis; Bac. abortus suis |
0,3-0,5×0,6-1,5 мкм. Мелкие короткие палочки. Неподвижны. Растут на средах, содержащих тионин, и не растут на средах с основным фуксином (конц. 1:25000). Окраска по Граму отрицательная. Не нуждается в CO2 | -/- | аэ/+ | - | - | -/• | -/+ интенсивно |
• | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | Возбудитель инфекционного аборта у свиней. Восприимчивы также лошади, собаки и мелкие лабораторные животные. Возбудитель бруцеллеза у человека |
| 15. Calymmatobacterium granulomatis; Donovania granulomatis |
0,5-1,0×0,6-5,0 мкм. Палочки. Возможны кокковидные формы. Зернистость. Полиморфны. Неподвижны. Колонии слизистые, серовато-белые. В бульоне помутнение, сероватая пленка, осадок. Окраска по Граму отрицательная | •/+ | • | • | • | • | • | • | кг | кг | кг | • | кг | кг | кг | кг | • | • | • | кг | кг | • | кг | • | • | • | • | кг | • | • | Возбудитель венерической гранулемы |
| 16. Clostridium aerofoetidum; Bac. aerofoetidus |
0,4-0,6×2,0-5,0 мкм. Палочки, иногда короткие цепочки. Подвижны. Колонии на агаре круглые, прозрачные с голубоватым оттенком, бахромчатым краем. В бульоне помутнение с осадком. Окраска по Граму положительная | +/- | ан/• | • | + | +/+ | • | кг | • | кг | кг | кг | кг | кг | кг | - | • | кг | • | - | • | • | - | • | - | • | • | кг | кг | - | При подкожном введении животным вызывает отек. В ассоциациях с другими анаэробами, по-видимому, играет роль в патогенезе гангрены |
| 17. Clostridium botulinum; Bac. botulinus; палочка ботулизма |
0,9-1,0×4,0-8,0 мкм. Крупные палочки с закругленными концами. Подвижны. Колонии на сахарном агаре круглые с неправильными краями. Окраска по Граму положительная | +/- | обл ан/- |
МС НК + |
- | +/+ нш |
-/+ | - | - | кг | кг | • | - | кг нш |
кг | - | - | кг | • | - | кг | - | - | • | кг нш |
кг | кг | кг нш |
• | + | Патогенен для белых мышей, морских свинок, кроликов, норок, лошадей. Возбудитель ботулизма |
| 18. Clostridium capitovale; Bac. capitovalis; Cl. capitovalis |
0,5-0,8×2,0-2,5 мкм. Стройные палочки. Подвижны. Колонии на агаре - прозрачные, круглые или неправильной формы. В бульоне помутнение с газообразованием. Окраска по Граму положительная | +/- | ан/• | • | - | +/+ | -/• | • | кг | кг нш |
• | кг нш |
- | - | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | - | При подкожном введении морской свинке вызывает отек (непостоянно). Обнаружен в испражнениях человека, при сепсисе, газовой гангрене |
| 19. Clostridium chauvoei; Bact. chauvoei |
0,5-0,7×2,0-6,0-8,0 мкм. Палочки с закругленными концами, полиморфны. Подвижны. На сахарно-кровяном агаре опалесцирующие колонии, круглые, плоские или напоминающие по форме виноградный лист. Незначительный гемолиз. Окраска по Граму положительная | +/- | обл ан/- |
МС - НК + |
+ | +/- | -/+сл | • | • | кг | кг | • | кг | кг | кг | кг | • | • | • | - | - | - | - | • | - | • | • | - | • | + | Патогенен для морских свинок, мышей. Может быть патогенным для человека |
| 20. Clostridium fallax; Bac. fallax |
0,6-0,8×3,0×6,0 мкм. Палочки с закругленными концами. Подвижны. Колонии на сахарном агаре круглые, прозрачные с зубчатым краем. В бульоне скудный рост в виде незначительного помутнения. Окраска по Граму положительная | +/+ | ан• | - | • | -/- | -/• | • | • | кг | кг | • | кг | кг | кг | кг | • | кг | • | кг | • | • | - | • | - | • | • | кг | • | + | Патогенен для морских свинок. Один из возбудителей газовой гангрены у человека |
| 21. Clostridium histolyticum, Bac. histolyticus |
0,5-0,8×3,0-5,0 мкм. Палочки с закругленными концами. Подвижны. На сахарнокровяном агаре колонии мелкие, круглые, бесцветные. На среде Китта-Тароцци интенсивное помутнение с перевариванием кусочков печени. Окраска по Граму положительная | +/- | обл ан/+ |
МС - |
- | +/+ | -/+ | • | • | к нш |
к нш |
к нш |
к нш |
• | к нш |
- | • | • | • | - | • | - | - | - | - | • | • | - | к нш |
+ | Патогенен для морских свинок, мышей, кроликов и др. Один из возбудителей газовой гангрены у человека |
| 22. Clostridium novyi; Clostridium oedematiens; Bac. oedematicus |
0,8-1,0×4,0-10,0 мкм. Крупные палочки с закругленными концами. Подвижны. На сахарно-кровяном агаре колонии прозрачные, изолированные или в виде сплошного сероватого налета. В бульоне интенсивное помутнение с осадком. Окраска по Граму положительная | +/- | обл ан/- |
МС - НК + |
• | +/- | -/• | кг | • | кг | кг нш |
• | - | - | кг нш |
- | • | кг | • | - | • | - | - | • | кг нш |
• | • | - | • | + | Патогенен для морских свинок, кроликов, мышей. Один из возбудителей газовой гангрены у человека |
| 23. Clostridium perfringens (тип. A); Clostridium welchii; Bac. perfringens; палочка газовой гангрены |
1,0-1,5×4,0-8,0 мкм. Толстые палочки, иногда короткие цепочки или нити. Неподвижны. Колонии на агаре круглые с возвышающимся малопрозрачным центром сероватого цвета. В бульоне интенсивное помутнение с последующим образованием осадка и просветлением. Окраска по Граму положительная | + ( |
ан/- | МС / НК - |
+ НШ |
+/- | -/+ | кг ( |
• | кг | кг | кг | кг | кг | кг | кг | кг | кг | кг | кг нш |
• | - | - | • | - нш + |
• | кг | - | • | + | При введении животным развивается газовая гангрена. Один из возбудителей газовой гангрены у человека. Тип F - возбудитель некротического энтерита |
| 24. Clostridium septicum; Bac. oedematis maligni |
0,8-1,0×2,0-10,0 мкм. Палочки, длинные нити. Полиморфны. Подвижны. Колонии на агаре в виде расплывающегося налета. В бульоне интенсивное помутнение с обильным осадком. Окраска по Граму положительная | +/- | обл ан/- |
МС / НК - |
+ | +/- | -/+ | • | • | кг | кг | кг | кг | кг | кг | - | • | • | • | - | кг | - | - | • | - | • | • | кг | • | + | Патогенен для морских свинок, кроликов, мышей и др. Один из возбудителей газовой гангрены у человека |
| 25. Clostridium sordellii; Clostridium bifermentans; Bac. bifermentans |
0,8-1,0×5,0-6,0 мкм. Палочки с закругленными концами. Молодые культуры подвижны. Колонии на агаре сероватые, неправильной формы. В бульоне помутнение, газообразование, осадок. Окраска по Граму положительная | +/- | ан/• | НК + |
- | +/+ | +/+ | • | • | кг | кг | кг | - | - | кг | - | • | • | • | - | • | • | - | • | кг нш |
• | • | кг нш |
• | + нш |
При парентеральном введении морским свинкам - кровоизлияние и отек. Один из возбудителей газовой гангрены у человека |
| 26. Clostridium sporogenes; Bac. sporogenes |
0,6-0,8×3,0-7,0 мкм. Палочки с закругленными концами. Подвижны. Колонии на агаре неправильной формы, прозрачные, а впоследствии мутно-желтые. В бульоне помутнение с газообразованием. Окраска по Граму положительная | +/- | ан/+сл | МС - |
- | +/+ | -/+ | • | • | кг | кг нш |
• | кг нш |
- | кг | - | • | • | • | • | кг нш |
• | кг нш |
кг нш |
кг нш |
• | • | кг нш |
• | - | Не патогенен для животных. В сочетании с другими анаэробами, по-видимому, играет роль в патогенезе газовой гангрены у человека |
| 27. Clostridium tertium; Bac. tertius |
0,4-0,6×3,0-6,0 мкм. Палочки. Малоподвижны. Колонии на агаре круглые, с изрезанным краем, опалесцирующие. В бульоне помутнение с осадком. Окраска по Граму положительная | +/- | ан/• | • | • | -/+ | • | кг | кг | кг | кг | кг | кг | кг | кг | кг | • | кг | • | • | • | • | кг | • | - | • | кг | кг | • | - | Не патогенен для животных. Выделяется из ран при газовой гангрене у человека |
| 28. Clostridium tetani; Bac. tetani; палочка столбняка |
0,4-0,6×4,0-8,0 мкм. Стройные палочки с закругленными концами. Подвижны. Колонии на сахарно-кровяном агаре мелкие, с возвышающимся малопрозрачным центром и бахромчатым или ворсинчатым краем. В бульоне равномерное помутнение с газобразованием. Окраска по Граму положительная | +/- | обл ан/- |
- | - | +/+ мм |
+/- | • | • | - | - | - | - | - | - | - | • | • | • | - | • | - | - | • | - | • | • | - | • | + | Патогенен для морских свинок, кроликов, крыс, мышей и др. Возбудитель столбняка у животных и человека |
| 29. Corynebacterium diphtheriae; Bact. diphtheriae; дифтерийная палочка |
0,3-0,8×2,0-3,0-5,0-8,0 мкм. Палочки слегка изогнутые, со вздутиями на концах. Полиморфны. Содержат зерна волютина. В препаратах расположены под углом. Неподвижны. На обычных средах растет с трудом. В бульоне Мартена пленка, слабое помутнение. На свернутой сыворотке мелкие, круглые, блестящие колонии серо-белого цвета. Окраска по Нейссеру положительная | -/- | аэ или фак ан/• |
• | + | -/- | -/+сл | • • |
• • |
к к |
• • |
• • |
к к |
- - |
к к |
- - |
• • |
к тип - тип |
к gravis mitis - |
• • |
к - |
• • |
- - |
• • |
• • |
• • |
• • |
• • |
• • |
• + |
Патогенен для морских свинок. Возбудитель дифтерии человека |
| 30. Corynebacterium pseudodiphtheriticum; Corynebacterium hofmannii; Bact. pseudodiphtberiticum; ложнодифтерийная палочка; палочка Гофманна |
0,3-0,5×0,8-1,5 мкм. Толстые палочки с закругленными концами. Неподвижны. Колонии на агаре гладкие, сероватого цвета. В бульоне слабое помутнение с незначительным осадком. Окраска по Граму отрицательная | -/- | аэ/• | • | + | -/• | -/• | • | • | - | • | • | - | - | - | - | • | • | • | • | - | • | • | • | - | • | • | • | • | - | Выделяется из ротовой полости и носоглотки человека |
| 31. Diplococcus crassus; Micrococcus crassus |
0,6×0,8 мкм. Кокки, располагаются парами и по четыре. Неподвижны. Колонии на агаре круглые, серовато-белого цвета, зернистые. Окраска по Граму неопределенная | -/- | аэ/• | • | • | • | • | • | • | к | • | • | • | • | к | к | • | • | • | - | • | • | - | • | • | • | • | • | • | • | Обнаруживается на слизистой оболочке верхних дыхательных путей у человека |
| 32. Diplococcus pneumoniae; пневмококк, диплококк Френкеля |
0,5-1,25 мкм. Ланцетовидные кокки, располагающиеся попарно короткими цепочками. Неподвижны. Колонии на сывороточном агаре мелкие, круглые, прозрачные. В бульоне легкое помутнение с незначительным осадком. На кровяном агаре зона зеленого цвета вокруг колонии (образование метгемоглобина). Окраска по Граму положительная | -/+ | фак аэ/+ |
• | • | -/• | -/- | • | • | к | • | • | • | к | • | • | • | • | • | к | • | • | • | • | • | • | • | • | • | - | Патогенен для мышей, кроликов. Обнаруживается в дыхательных путях. Возбудитель пневмонии, ангин и других воспалительных процессов у человека |
| 33. Escherichia coli; Bact. coli; кишечная палочка |
0,4-0,6-1,0×2,0-3,0 мкм. Палочки с закругленными концами Подвижны. Колонии на агаре круглые, мутные, слегка выпуклые, серобелого цвета с желтоватым оттенком. В бульоне равномерное помутнение. Окраска по Граму отрицательная | -/- | фак аэ/+ |
НК + |
+ нш |
-/• | +/+ нш |
кг | кг | кг | кг | кг | кг | кг | кг | - нш |
кг нш |
- | • | • | - | кг нш |
кг | • | кг нш |
- | - | кг нш |
• | - | Нек-рые штаммы патогенны при парентеральном введении для кроликов, морских свинок и мышей. Факультативный паразит. Нек-рые разновидности вызывают острый гастроэнтерит, сепсис у человека |
| 34. Fusobacterium fusiforme; Fusobacterium plautivincenti; Bac. fusiformis |
0,8-1,0×5,0-10,0 мкм. Веретенообразные палочки. Неподвижны. Содержат гранулы. Колонии на сывороточном агаре мелкие с темным центром и войлокообразным краем. В бульоне помутнение. Окраска по Граму отрицательная | -/- | ан | • | • | • | +/+ ( -/+ ( |
• | • | к к |
• | • | к | • | к | к к |
• | к | • | • | • | • | • | • | • | • | • | • | • | • | Непатогенна для экспериментальных животных. Обнаруживается при ангине Венсана, язвенном стоматите, гангрене и в ранах в ассоциации с Treponema Yincenti |
| 35. Gaffkya tetragena; Micrococcus tetragenus; Sarcina tetragena |
0,7-1,0 мкм. Круглые кокки в виде пакетов по 4-16. Неподвижны. Колонии на агаре круглые, выпуклые, беловатого или желтоватого цвета. В бульоне легкая муть с тягучим осадком. Окраска по Граму положительная | -/+ нп |
аэ/• | НК - |
- | -/+ | -/- | • | • | к сл |
• | • | • | к | • | • | • | - | • | • | • | • | • | • | к | • | • | • | • | • | При парентеральном введении мышам, морским свинкам может развиться септицемия. Может вызывать местные воспалительные процессы. Обнаруживается на коже и на слизистых оболочках |
| 36. Haemophilus conjunctivitidis; Bact. conjunctivitidis; палочка Коха-Уикса |
0,2-0,3×0,5-1,2 мкм. Очень мелкие короткие палочки. Неподвижны. На обычных средах не растут. Культивируются на средах с кровью. На агаре Левинталя колонии очень мелкие, прозрачные. Окраска по Граму отрицательная | -/- | аэ/• | • | - | -/- | -/- | • | • | к сл |
к сл |
• | к сл |
- | • | • | • | - | • | • | • | • | • | • | • | • | • | • | • | • | Возбудитель острого инфекционного конъюнктивита у человека |
| 37. Haemophilus ducreyi; Bact. ducreyi; палочка мягкого шанкра; стрептобактерия Дюкрея-Унны |
0,4×1,5-2,0 мкм. Палочки полиморфные. В препаратах из ткани располагаются цепочками. Неподвижны. На обычных средах не культивируются. На кровяном агаре через 3 дня мелкие, прозрачные, блестящие колонии. Окраска по Граму отрицательная | -/- | аэ/- | • | - | -/- | • | • | • | к | • | • | • | к | • | к | • | • | • | • | • | • | к | • | • | • | • | • | • | • | При заражении кроликов в яичко развивается орхит. Возбудитель мягкого шанкра у человека |
| 38. Haemophilus influenzae; Bact. influenzae; палочка инфлюенцы; палочка Пфейффера |
0,3-0,5×1,0-2,0 мкм. Палочки мелкие, полиморфны, иногда окрашиваются биполярно. Неподвижны. Колонии на кровяном агаре мелкие, круглые, гомогенные. Зависимы от факторов роста Y и X. Окраска по Граму отрицательная | -/+ нш |
фак ан/• |
• | + | -/• | +/• нш |
• | • | к | к | • | к | - | к нш |
к нш |
• | • | • | • | к нш |
• | - | • | • | • | • | • | • | • | При парентеральном введении вызывает у кроликов, морских свинок и мышей интоксикацию. Выделен у человека при воспалительных процессах верхних дыхательных путей |
| 39. Klebsiella ozaenae Bact. ozaenae; палочка озены |
1,5 мкм (толщина). Толстые палочки различной длины. Неподвижны. Колонии на агаре в виде слизистого серовато-белого расплывающегося налета. В бульоне помутнение с осадком. Окраска по Граму отрицательная | -/+ | фак ан/• |
• | - | -/- | -/• | • | • | кг нш |
• | • | • | кг м |
кг нш |
кг нш |
• | • | • | • | • | - | кг нш |
• | • | • | • | • | • | • | Патогенен для мышей. Обнаруживается при озене у человека |
| 40. Klebsiella pneumoniae; Bact. friedlanderi; палочка фридлендера |
0,5-0,8×1,0-2,0 мкм. Палочки, располагающиеся попарно. Неподвижны. Диплобактерии. На агаре колонии фестончатые. В бульоне помутнение и осадок. Окраска по Граму отрицательная | -/+ | факан/• | • | + | - | +нш/+( |
к | к | кг | • | • | • | кг | к | к | - | • | • | - | • | к + - |
к | к | • | • | к | к | • | • | Патогенен для мышей. Возбудитель пневмонии и местных гнойных процессов у человека |
| 41. Klebsiella rhinoscleromatis | 0,6-0,7×1,6-2,4 мкм. Палочки, иногда полярные тельца. Неподвижны. На агаре бесцветные, слизистые, прозрачные и полупрозрачные колонии. В бульоне помутнение с пленкой. Окраска по Граму отрицательная | -/+ | аэ фак ан/• |
• | + | -/• | -/- | • | • | к | • | • | • | - | • | к | • | • | • | • | • | • | к | • | • | к | к | к | • | - | Возбудитель риносклеромы у человека |
| 42. Listeria monocytogenes; Bact. monocytogenes |
0,5×1,0-2,0 мкм. Палочки с закругленными концами, иногда слегка искривленные; располагаются под углом попарно и короткими цепочками. Подвижны. Колонии на печеночном агаре круглые, гладкие, полупрозрачные с неровными краями. На бульоне поверхностная пленка и хлопьевидный осадок. Окраска по Граму положительная | -/- | фак ан/+ |
• | - | -/• | -/- | к нш |
- | к | • | - | • | к нп |
к | к | • | к м |
• | - | к | - | - | - | к | • | - | к | • | • | Патогенен для морских свинок, кроликов и др. Возбудитель инфекционного мононуклеоза у человека |
| 43. Micrococcus flavus | 0,6-0,8 мкм. Кокки, располагаются одиночками и парами. Неподвижны. Колонии на агаре мелкие, круглые с зеленовато-желтым или золотисто-желтым пигментом. Окраска по Граму неопределенная | -/- | аэ/• | • | - | +/• | -/- | • | • | к | • | • | • | • | к | к | • | • | • | • | • | • | • | • | • | • | • | • | • | • | Обнаруживается на слизистой оболочке верхних дыхательных путей у человека |
| 44. Moraxella lacunata; палочка Моракса-Аксенфельда |
0,4-0,5×2,0 мкм. Палочки, располагаются попарно или короткими цепочками. Неподвижны. На обычных средах не культивируются. На сывороточном агаре мелкие, плоские, сероватые, прозрачные колонии. На желатине не растет. Окраска по Граму отрицательная | -/- | аэ фак ан/• |
• | - | -/+ м |
-/• | • | • | к | • | • | • | • | • | к | • | • | • | • | • | • | к | • | • | • | • | • | • | • | Возбудитель инфекционного хронического конъюнктивита у человека |
| 45. Mycobacterium avium; Mycobacterium tuberculosis avium; Bac. tuberculosis typ. avium; туберкулезная палочка, птичий тип |
2,0-5,0-10,0 мкм. Палочки. Неподвижны. На глицериновом агаре правильные полусферические колонии кремового или белого цвета. В глицериновом бульоне порошкообразный рост, осадок на стенках и дне. Окраска по Цилю-Нельсену положительная. Кислото-спирто-щелочеустойчивы | -/- | аэ/+ | МС +/- |
• | -/• | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | - | Возбудитель туберкулеза птиц. Для кур и кроликов вирулентен, для мышей умеренно вирулентен, не патогенен для человека |
| 46. Mycobacterium bovis; Mycobacterium tuberculosis typus bovinus; Bact. tuberculosis typ. bovinus; туберкулезная палочка, бычий тип |
0,8×1,8 мкм. Палочки. Неподвижны. На яичной среде колонии гладкие, полушаровидные, мелкие. В глицериновом бульоне растет скудно. Окраска по Цилю-Нельсену положительная. Кислото-спирто-щелочеустойчивы | -/- | аэ/• | МС +/- |
• | -/• | -/- | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | Патогенен для морских свинок, кроликов. Возбудитель туберкулеза у животных и человека |
| 47. Mycobacterium leprae; Bact. leprae; палочка проказы |
0,2-0,35×1,5-4,6 мкм. Палочки, слегка изогнутые, концы закруглены или заострены. Зернистость. Ветвистые формы, неподвижны. Выращиваются с трудом. По нек-рым данным, культивируются на средах с глицерином, кровяной сывороткой, на яичных средах с лизатами из семенников рыб | -/- | аэ/• | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | Возбудитель проказы у человека |
| 48. Mycobacterium microti; Bact. tuberculosis typ. muris; туберкулезная палочка, мышиный тип |
0,4×2,5 мкм. Палочки. Тонкие. Полиморфные, возможна зернистость. Неподвижны, на трипсиновом бульоне тонкая пленка и осадок. На среде Дорсэ кремово-белые колонии. Окраска по Цилю-Нельсену положительная. Кислото-спирто-щелочеустойчивы | -/- | аэ/• | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | Патогенна для мышей |
| 49. Mycobacterium tuberculosis; Bact. tuberculosis typ. humanus; туберкулезная палочка; человеческий тип; палочка Коха |
0,5-0,8×1,0-6,0 мкм. Палочки, слегка изогнутые, концы закругленные. Зернистость. Полиморфны. Неподвижны. На обычных средах не растет. На глицериновом бульоне морщинистая, массивная пленка. На среде Петраньяни сухой серо-желтый крошковатый налет. Колонии шероховатые (розетки), плоские. Окраска по Цилю-Нельсену положительная. Кислото-спирто-щелочеустойчивы | -/- | аэ/• | МС +/- |
• | -/• | -/- | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | Патогенен для морских свинок, мышей. У кроликов экспериментально генерализованного туберкулеза не вызывает. Возбудитель туберкулеза у человека |
| 50. Neisseria gonorrlioeae; Gonococcus; гонококк |
0,6-1,0 мкм. Кокки бобовидной формы. Неподвижны. Колонии на сывороточном агаре мелкие, прозрачные. В бульоне с асцитической жидкостью рост медленный в виде вязкого осадка. Окраска по Граму отрицательная | -/- | фак аэ ан/+ |
МС - |
• | •- | -/- | • | • | к | - | • | • | • | - | - | • | • | • | • | • | • | - | • | • | • | • | • | • | • | Животные невосприимчивы. Возбудитель гонореи, бленнореи |
| 51. Neisseria meningitidis; Meningococcus; менингококк |
0,8×0,6 мкм. Овальные кокки бобовидной формы, расположены парами. В культурах полиморфны. Неподвижны. Колонии на асцит-агаре прозрачные, сероватого цвета. В асцитбульоне помутнение и осадок. Окраска по Граму отрицательная | -/- | аэ( |
МС + |
- | -/- | -/- | - | - | к | - | - | - | - | к | - | - | • | • | • | • | • | • | • | • | • | • | • | • | • | При субокципитальном введении у кроликов развивается менингит. Возбудитель эпидемического цереброспинального менингита |
| 52. Neisseria catarrhalis; Micrococcus catarrhalis; катаральный микрококк |
0,8×0,6 мкм. Кокки бобовидной формы, располагаются парами и по четыре. Неподвижны. Колонии на агаре круглые, серо-белые, с неровными краями. В бульоне помутнение. Окраска по Граму отрицательная | -/- | аэ/• | • | • | -/• | -/- | - | - | - | - | - | - | - | - | - | • | • | • | • | • | • | • | • | • | • | • | • | • | • | Выделяется при воспалительных процессах верхних дыхательных путей у человека |
| 53. Pasteurella pestis; Bact. pestis; Yersinia pestis; палочка чумы |
0,5-0,7×1,5-2,0 мкм. Палочки овоидной формы, окрашивающиеся биполярно. Неподвижны. Колонии на агаре: S-формы круглые с отграниченным краем, прозрачные; R-формы - морщинистые с неровным краем и фестончатой каймой. В бульоне S-формы - равномерное помутнение, R-формы - хлопьевидный осадок. Окраска по Граму отрицательная | -/+( |
аэ фак ан/• |
• | + нп |
-/- | -/• | • | кг | кг нш |
кг | • | кг | - | кг | - | - | - | • | - нш |
- нш |
- | кг | • | • | - нш |
• | • | • | - | Патогенен для морских свинок, крыс, мышей, кроликов и других грызунов; верблюдов. Возбудитель чумы у животных и человека |
| 54. Pasteurella pseudotuber-culosis; Streptobacillus pseudotuber-culosis rodentium; Bact. pseudotuberculosis; палочка псевдотуберкулеза грызунов |
0,4-0,8×0,8-2,0 мкм. Короткие толстые палочки эллипсоидной или кокковидной формы, встречаются нитевидные формы. Иногда биполярны. Подвижны. Колонии на агаре: S-формы - гладкие, круглые, выпуклые, слизистые; R-формы - морщинистые с бухтообразным краем и зернистым центром. В бульоне: S-формы - равномерное помутнение, R-формы - хлопьевидный осадок. Окраска по Граму отрицательная | -/+нш | фак ан/+ |
МС + |
+ | -/- | -/+ | к | к | к | к | • | к | - | к | - | к нш |
• | • | к нш |
к нш |
к нш |
к нш |
• | к нш |
к нш |
- | к нш |
• | • | Патогенен для морских свинок, крыс, кроликов. Возбудитель скарлатиноподобной лихорадки у человека |
| 55. Pasteurella tularensis; Francisella tularensis |
0,2×0,3-0,7 мкм. Мелкие палочки. Неподвижны. На средах с яичным желтком или сывороткой крови медленный рост мелких, слизистых колоний. Окраска по Граму отрицательная | -/+ | фак аэ/+ |
• | - | • | -/• | - | - | к | к нп |
к нп |
- | - | к нп |
- | - | • | • | - | к нп |
- | - | - | к нп |
к нп |
- | - | - | - | Патогенен для крыс, мышей и других грызунов. Возбудитель туляремии у животных и человека |
| 56. Pseudomonas aeruginosa; Bact. aeruginosum; Bact. pyocyaneum; синегнойная палочка |
0,5-0,6×1,5 мкм. Палочки, иногда короткие цепочки. Подвижны. Колонии на агаре большие, круглые, слизистые, с темным центром и просвечивающим краем. В бульоне интенсивное помутнение с пленкой и осадком. Образует зеленый пигмент. Окраска по Граму отрицательная | -/- | фак аэ/• |
НК - |
+ | +/+ | -/+ нш |
• | - | - | - | • | - | - | - | - | • | • | • | - | - | - | - | • | - | • | - | • | • | + | Патогенен для кроликов, морских свинок, крыс, мышей. Может вызывать местные нагноительные процессы. У грудных детей - септицемию |
| 57. Peptostreptococcus anaerobius | 0,8 мкм. Кокки, расположенные цепочками. Неподвижны. Колонии на агаре круглые, беловатые. В бульоне помутнение с осадком и газообразованием. Окраска по Граму положительная | -/• | ан/• | • | • | -/• | +/• | • | к | к | к | • | к | • | к | к | • | • | • | • | • | • | к | • | • | • | • | • | • | + | Выделен при газовой гангрене у человека |
| 58. Peptostreptococcus putrid us; Streptococcus putridus |
0,8 мкм. Кокки, расположенные цепочками. Неподвижны. Колонии на агаре круглые, беловатые. В бульоне помутнение с осадком и газообразованием. Окраска по Граму положительная | -/• | ан/• | • | • | -/• | •/+ | • | • | к | к | • | • | • | к | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | Возбудитель пуэрперального сепсиса, тромбофлебита. Выделяется при газовой гангрене, остеомиелите у человека |
| 59. Proteus mirabilis; Bact. mirabilis |
0,5-0,6×1,0-3,0 мкм. Палочки. Подвижны. Колонии на агаре неправильные, расплывающиеся, сероватые. В бульоне помутнение с пленкой и осадком. Окраска по Граму отрицательная | -/- | фак аэ ан/• |
• | + | +/+ | -/+ | • | кг | кг | кг | • | кг | - | - | кг м |
• | - | • | • | - | • | - | • | • | • | • | • | • | • | У человека выделен при гастроэнтерите |
| 60. Proteus morganii; Salmonella morgani; Bact. morgani; палочка Моргана |
0,4-0,6×1,0-2,0 мкм. Палочки с закругленными концами. Подвижны. Колонии на агаре серо-белого цвета с голубоватым оттенком. В бульоне - помутнение. Окраска по Граму отрицательная | -/- | аэ/• | • | + | -/• | +/- | к нш |
- | кг или к |
кг или к нш |
кг | кг | - | - редко к |
- | - | • | • | • | - | - | - | - | кг | - | - | - | • | - | При внутрибрюшинном заражении мышей вызывает смертельную инфекцию. Выделяется из испражнений человека при острых кишечных заболеваниях, а иногда в норме |
| 61. Proteus rettgeri; Bact. rettgeri; палочка Реттгера |
0,4×1,4 мкм. Палочки. Неподвижны при t° 37°, резко подвижны при t° 25°. В бульоне помутнение и хлопьевидный осадок. На агаре мелкие сероватые, прозрачные колонии. У некоторых штаммов ползучий рост. Окраска по Граму отрицательная | -/-/ | фак аэ ан/• |
• | + нп |
-/• | +/- нп |
• | - | к | к | • | к | - | - | к м |
• | • | • | • | - | - | к | • | • | к | • | к нп |
• | - | Выделяется при гастроэнтеритах у человека |
| Возможно незначительное газообразование | |||||||||||||||||||||||||||||||
| 62. Proteus vulgaris; Bac. proteus vulgaris; протей, вульгарный протей |
0,5-1,0×1,0-3,0 мкм. Палочки, часто длинные нити. Н-форма подвижна, О-форма неподвижна. Колонии на агаре: Н-формы расплывающиеся, сероватые, непрозрачные; О-формы - отдельные круглые колонии. В бульоне помутнение, обычно с нежной пленкой. Окраска по Граму отрицательная. Мочевину расщепляет | -/- | фак аэ /• |
НК + |
+ | +/+ | +/+ | • | • | кг | кг | • | кг | - | кг | кг | • | - | • | • | • | • | - | • | • | • | • | • | • | • | Возбудитель пищевых токсикоинфекций, возможно летних поносов у детей |
| 63. Salmonella choleraesuis; Bact. choleraesuis |
0,6-0,7×2,0-3,0 мкм. Палочки. Подвижны. Колонии на агаре круглые, гладкие, прозрачные. В бульоне равномерное помутнение, иногда нежная пленка. Окраска по Граму отрицательная | -/- | фак аэ /• |
НК + |
+ | - | -/- | кг | - | кг | кг | кг | кг | - | кг | - | - | • | • | - | • | кг | кг | кг | кг | • | - | - | • | • | Обнаруживается при чуме свиней в качестве вторичной инфекции. Парентеральное заражение вызывает гибель мышей, кроликов. Возбудитель пищевых токсикоинфекций у человека |
| 64. Salmonella dublin; Bact. enteritidis var. dublin |
0,6-0,7×2,0-3,0 мкм. Палочки с закругленными концами. Подвижны. Колонии на агаре и рост в бульоне те же, что и у вышеописанной бактерии. Окраска по Граму отрицательная | -/- | фак ан /• |
• | • | -/• | •/+ | кг нп |
кг нп |
кг | • | • | • | - | • | - | - | • | • | - | • | кг | кг | • | кг нп |
- | - | - | • | - | Патогенен для белых мышей. Выделен у человека при менингите и при послеоперационном осложнении |
| 65. Salmonella enteritidis; Bact. enteritidis (Gaertner); палочка Гертнера |
0,6-0,7×2,0-3,0 мкм. Палочки с закругленными концами. Подвижны. Колонии на агаре круглые, выпуклые, гладкие, сероватые. В бульоне равномерное помутнение, иногда серовато-белая пленка, осадок. Окраска по Граму отрицательная | -/- | аэ/• | • | + | -/• | -/+ | кг | кг | кг | кг | кг | кг | - | кг | - | - | • | • | - | кг | кг | кг | кг | кг | - | - | - | • | - | При заражении белых мышей вызывает септицемию. Возбудитель пищевых токсикоинфекций у человека |
| 66. Salmonella enteritidis var. danysz; палочка Даниша-Исаченко |
0,6-0,7×2,0-3,0 мкм. Палочки с закругленными концами. Подвижны. Колонии на агаре и рост в бульоне те же, что и у вышеописанной бактерии. Окраска по Граму отрицательная | -/- | аэ/• | • | + | -/• | -/+ | кг | кг нп |
кг | - | • | • | - | кг | - | - | • | • | - | • | кг | кг | • | кг нш |
- | - | - | • | - | Патогенен для белых мышей. Возбудитель пищевых токсикоинфекций у человека |
| 67. Salmonella hirschfeldii; Bact. hirschfeldii; палочка паратифа C |
0,3-0,5×1,0-2,5 мкм. Палочки с закругленными концами. Подвижны. Колонии на агаре белые, гладкие, блестящие. В бульоне помутнение с нежной пленкой и серовато-белым осадком. Окраска по Граму отрицательная | -/- | фак ан/• |
НК + |
+ | -/• | -/+ | кг | кг | кг | кг | • | • | - | кг | - | • | • | • | • | кг | кг | кг | кг | • | - | - | - | • | • | Патогенен для белых мышей. Возбудитель паратифа C |
| 68. Salmonella paratyphi; Salmonella paratyphi A; Bact. paratyphi A; палочка паратифа A |
0,6-0,8×3,0-4,0 мкм. Палочки с закругленными концами. Подвижны. Колонии на агаре круглые, прозрачные. В бульоне помутнение с незначительным осадком. Окраска по Граму отрицательная | -/- | фак ан/• |
НК + |
+ | • | -/- | - | кг | кг | кг | кг | кг | - | кг | - | - | • | • | - | кг | кг | кг | кг | кг | - | - | - | • | - | При подкожном заражении животных развивается септицемия. Возбудитель паратифа A |
| 69. Salmonella schottmiilleri; Salmonella paratyphi B; Bact. paratyphi B; палочка паратифа B |
0,6-0,7×2,0-3,0 мкм. Палочки с закругленными концами. Подвижны. Колонии на агаре круглые, голубовато-серые, прозрачные. В бульоне помутнение с осадком, иногда нежная пленка. Окраска по Граму отрицательная | -/- | фак ан /• |
НК +/• |
+ | -/- | -/- | кг | кг | кг | кг | кг | кг | - | кг | - | - об |
• | • | - | кг | кг | кг | кг | кг | - | кг | - | • | - | При подкожном заражении животных развивается септицемия. Возбудитель паратифа B |
| 70. Salmonella typhi; Bact. typhi; палочка брюшного тифа |
0,6-0,8×2,0-3,0 мкм. Палочки с закругленными концами. Подвижны. Колонии на агаре круглые с ровными краями, прозрачные. В бульоне помутнение, небольшой осадок. Окраска по Граму отрицательная | -/- | аэ/• | НК - МС + |
+ | -/- | -/+ | к нш |
- нш |
к | к | • | к | - | к | - | к | • | • | - | к | - нш |
к | к | к | • | - | - | • | - | При парентеральном введении вызывает интоксикацию и гибель кроликов и мышей. Возбудитель брюшного тифа |
| 71. Salmonella typhimurium; Bact. typhimurium; палочка мышиного тифа |
0,5×1,0-1,5 мкм. Палочки с закругленными концами. Подвижны. Колонии на агаре мелкие, круглые, сероватые. В бульоне помутнение. Окраска по Граму отрицательная | -/- | фак аэ /• |
НК +/• |
+ нш |
-/- | -/+ | • | кг | кг | кг | • | кг | - | кг | - | - | • | • | - | кг | • | кг | кг | • | - | кг | - | • | - | Патогенен для мышей, кроликов. У мышей вызывает инфекцию при пероральном введении. Возбудитель пищевых токсикоинфекций у человека |
| 72. Sarcina lutea; желтая сардина |
1,0-1,5 мкм. Круглые кокки, расположенные пакетами по 4-8-16. Неподвижны. Колонии на агаре крупные, выпуклые, гладкие, желтоватые. В бульоне придонный рост. Окраска по Граму положительная | -/- | аэ/• | • | + | +/• м |
+сл /+ |
• | • | - | • | • | • | - | • | - | • | • | • | • | • | • | • | • | • | • | • | • | • | • | Обнаруживается на поверхности кожи человека |
| 73. Shigella alkalescens; Bac. alkalescens |
0,5×1,0-1,5 мкм. Палочки. Неподвижны. На агаре серовато-белые прозрачные колонии. В бульоне помутнение. Окраска по Граму отрицательна | -/- | фак аэ /+ |
• | + | -/• | +/- | к | • | к | • | • | • | - | к | к нш |
• | • | • | • | - | к | к | к | к | • | • | - | • | • | Выделяется из кишечника человека при диарее |
| 74. Shigella dispar; Bac. dispar |
0,5-1,0×1,5 мкм. Палочки с закругленными концами. Неподвижны. Окраска по Граму отрицательная | -/- | фак аэ /• |
• | + | -/• | +/- | к нш |
• | к | • | • | • | к | к | к нш |
• | • | • | • | • | к нш |
к | к | • | • | • | • | • | • | Патогенен для кроликов и человека. Обнаруживается при циститах, пиелитах и пиелонефритах |
| 75. Shigella dysenteriae; Bact. dysenteriae Grigoriewi-Shiga; бактерия дизентерии Григорьева-Шиги |
Палочки с закругленными концами. Неподвижны. На агаре плоские, влажные, блестящие колонии. В бульоне слабое помутнение с сероватым осадком. Окраска по Граму отрицательная | -/- | фак аэ /- |
НК - |
+ | -/- | -/- | - | - | к | к | к нп |
к нп |
- | - | - | к | - | • | - | к | - | - | - | к нп |
к | • | - | - | + | Патогенен для кроликов при парентеральном введении. Возбудитель дизентерии у человека |
| 76. Shigella flexneri; Bact. dysenteriae (Flexner); бактерия дизентерии Флекснера |
0,4-0,6×1,0-3,0 мкм. Палочки с закругленными концами. Неподвижны. На агаре круглые серо-белого цвета гладкие колонии с блестящим оттенком. В бульоне помутнение с осадком. Окраска по Граму отрицательная | -/- | фак аэ /- |
НК - |
- | -/- | +/ нш |
к нп |
к нп |
к | к | к | к | - | к | к нп |
- | • | • | • | к | к нп |
к | • | • | - | • | - | • | - | Возбудитель дизентерии у человека |
| 77. Shigella schmitzii; Shigella stutzeri-schmitzii; Shigella ambigua; Bact. dysenteriae (Schmitz); бактерия дизентерии Штуцера-Шмитца |
0,4-0,6×1,0-3,0 мкм. Палочки с закругленными концами. Неподвижны. Колонии на агаре и рост в бульоне те же, что и у вышеописанной бактерии. Окраска по Граму отрицательная | -/- | фак аэ /+ |
• | - | • | +/- | - | к | к | к | • | к | - | к | - | • | • | • | • | • | к нп |
- | к нп |
- | • | • | - | • | - | Возбудитель дизентерии у человека |
| 78. Shigella sonnei; Bact. dysenteriae (Sonne); дизентерийная палочка Зонне; палочка Крузе-Зонне |
0,4-0,6×1,0-3,0 мкм. Палочки с закругленными концами. Неподвижны. Колонии на агаре двух типов: первого типа у свежевыделенных культур - круглые, выпуклые, блестящие, сероватого цвета с ровным краем; второго типа - плоские зернистые, нежные с неровным краем. В бульоне помутнение и сероватый осадок. Окраска по Граму отрицательная | -/- | фак ан /+ |
НК - |
+ | -/• | -/- | к нп |
к | к | к | к | к | к м |
к нп |
к м |
к | • | • | - | к | - | к | к нп |
к | • | - | - | • | - | Возбудитель дизентерии у человека |
| 79. Spliaerophorus necrophorus; Bact. necrophorum; Bacteroides funduliformis |
0,5-1,5×80,0-100,0 мкм. Длинные палочки, нити, иногда ветвистые в культурах. Неподвижны. Короткие формы. Колонии на агаре мелкие, круглые с хлопьевидным краем, непрозрачные с желтоватым центром. В бульоне помутнение с газообразованием. Окраска по Граму отрицательная | -/- | ан/• | • | - | -/- | +/+ | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | + | Патогенен для кроликов. Выделяется при номе, при инфекциях мочеполовых путей, кишечных путей, при хронических язвенных колитах |
| 80. Spirillum minus; Spirochaeta morsusmuris |
0,3-0,5×2,0-4,0 мкм. Короткие спириллы с 2-3 завитками. Подвижны. Окраска по Граму отрицательная | -/- | аэ фак ан /• |
• | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | • | Патогенен для крыс, мышей и морских свинок. Возбудитель содоку у животных и человека |
| 81. Staphylococcus aureus; золотистый стафилококк; гноеродный стафилококк |
0,8-1,0 мкм. Кокки, расположенные поодиночно и в виде гроздьев. Неподвижны. Колонии на агаре круглые, гладкие, желтоватооранжевого цвета. На кровяном агаре вокруг колоний зоны гемолиза. В бульоне помутнение с осадком. Окраска по Граму положительная | -/- | аэ фак ан/+ |
• | + | +/• | -/+ сл нш |
• | • | к | • | • | • | к | + | к | - | - | • | - | • | • | к | • | • | • | • | - | • | + | Патогенен для мышей, морских свинок, кроликов. Возбудитель гнойно-воспалительных процессов, пищевых токсикоинфекций у человека |
| 82. Staphylococcus epidermidis; белый стафилококк |
0,5-0,6 мкм. Кокки, расположенные поодиночно и группами в виде виноградной грозди. Неподвижны. Колонии на агаре круглые, прозрачные, беловатые. В бульоне помутнение с осадком. Окраска по Граму положительная | -/- | аэ фак ан/+ |
• | + | +/• | -/• | • | • | к | к | • | • | к | к | к | - | • | • | - | • | • | - | • | • | • | - | • | • | • | Патогенен для мышей, морских свинок,кроликов и др. Обнаруживается на коже и слизистых. Может вызывать местные воспалительные процессы у человека |
| 83. Streptococcus faecalis; энтерококк; фекальный стрептококк |
0,5-1,0 мкм. Кокки овальной, иногда ланцетовидной формы; полиморфны; возможны короткие цепочки. Неподвижны. Колонии на агаре мелкие. В бульоне равномерная муть, просветление, слизистый осадок. Окраска по Граму положительная | -/- | фак аэ /• |
МС | + нш |
-/ | -/+ нш |
• | к нш |
к | • | • | • | к | • | к нш |
- | - | • | - | • | • | к нш |
к нш |
к нш |
• | • | к | • | - | Обнаруживается в кишечнике человека. Выделяется при подострых эндокардитах из крови |
| 84. Streptococcus pyogenes; Streptococcus haemolyticus; гноеродный стрептококк; гемолитический стрептококк |
0,6-1,5 мкм. Кокки, расположенные цепочками. Неподвижны. На кровяном агаре мелкие колонии, зона гемолиза. В бульоне рост в виде хлопьев и осадка. Окраска по Граму положительная | -/- | аэ или фак ан /• |
МС- | - | -/• | -/• | • | • | к | • | • | • | к | к | к | - | - | • | - | • | • | - | - | - | • | • | - | • | + | Патогенен для кроликов (не все штаммы). Возбудитель гнойных процессов и сепсиса у человека |
| 85. Streptococcus viridans; Streptococcus salivarius; зеленящий стрептококк |
0,6-0,9 мкм. Кокки, расположенные короткими цепочками. Неподвижны. Колонии на кровяном агаре мелкие, вокруг зона позеленения. В бульоне равномерная муть, осадок. Окраска по Граму положительная | -/- | аэ фак ан /• |
- | -/• | -/• | - | - | к | • | • | • | к | • | к | к нш |
• | • | к | • | • | к | - | - | • | • | к нш |
• | - | Возбудитель гнойных процессов, сепсиса, выделяется при эндокардите у человека | |
| 86. Vibrio comma; Vibrio cholerae; Vibrio cholerae asiaticae; холерный вибрион |
0,4-0,6×1,5-3,0 мкм. Изогнутые палочки. Подвижны. Колонии на агаре круглые, прозрачные, блестящие, с голубоватым оттенком. В бульоне нежная пленка и помутнение, не гемолизирует эритроциты барана. Окраска по Граму отрицательная. Чувствителен к полимиксину В (50 мкг) | -/- | аэ/• | НК - МС + |
+ | +/+ | +/+ | • | - | к | к | к | к | - | к | к | • | к | к | - | • | - | к | - | к м |
• | • | • | • | - | Патогенен для морских свинок, кроликов при определенных условиях. Возбудитель холеры у человека |
| 87. Vibrio El-Tor; вибрион Эль-Тор |
0,4-0,6×1,5-3,0 мкм. Изогнутые палочки. Подвижны. Колонии на агаре круглые, прозрачные, блестящие, с голубоватым оттенком. В бульоне нежная пленка и помутнение. На кровяных средах, в отличие от холерных вибрионов, вызывает гемолиз. Окраска по Граму отрицательная. Резистентен к полимиксину В (50 мкг) | -/- | аэ/• | • | + | +/+ | +/+ | • | - | к | к | к | к | • | к | к | • | к | к | - | • | - | к | - | к м |
• | • | • | • | • | Патогенен для морских свинок, кроликов при определенных условиях. Возбудитель холеры у человека |
| 88. Vibrio metschnikovii; вибрион Мечникова |
0,4-0,6×1,5-3,0 мкм. Изогнутые палочки. Подвижны. Колонии на агаре круглые, прозрачные, блестящие, с голубоватым оттенком. В бульоне нежная пленка и помутнение. Окраска по Граму отрицательная | -/- | фак аэ /• |
• | + | +/• | +/• | • | • | к | • | • | • | • | • | к | • | • | • | • | • | • | • | • | • | • | • | • | • | • | Возбудитель холероподобного заболевания кур. Патогенен для морских свинок, голубей. Непатогенен для человека |
Другой регуляторной единицей данной системы является ген, контролирующий синтез репрессора - белка,способного соединяться с оператором. В присутствии репрессора структурные гены не транскрибируются РНК-полимеразой и синтеза соответствующих ферментов не происходит. Между оператором и геном-регулятором находится короткий участок ДНК - промотор - место посадки РНК-полимеразы. Добавленная к среде культивирования Б. лактоза связывает репрессор, оператор оказывается свободным, и структурные гены начинают транскрибироваться, в результате чего происходит синтез ферментов. Т. о., лактоза, являющаяся субстратом действия ферментов, выполняет функцию индуктора их синтеза.
Подобного рода регуляция свойственна и другим катаболическим системам. Синтез ферментов, индуцируемый субстратами их действия, называют индуцибельным.
Иного рода регуляция присуща анаболическим бактериальным системам. У этих систем ген-регулятор контролирует синтез неактивного репрессора-апорепрессора. При малых количествах конечного метаболита, контролируемого структурными генами данного биохимического пути (напр., какой-нибудь аминокислоты), апорепрессор не соединяется с геном-оператором и не препятствует, следовательно, работе структурных генов и синтезу данной аминокислоты. В случае же избыточного образования конечного продукта последний начинает функционировать как корепрессор. Связываясь с апорепрессором, корепрессор превращает его в активный репрессор, соединяющийся с геном-оператором. В результате транскрибирование структурных генов и синтез соответствующих соединении прекращаются, т. е. наблюдается репрессия системы. В процессе расхода клеткой избыточного конечного метаболита активный репрессор вновь превращается в апорепрессор, ген-оператор освобождается и структурные гены вновь приобретают активность, т. е. происходит дерепрессия системы.
Т. о., генетическим системам обоего рода - катаболическим (индуцибельным) и анаболическим (репрессибельным) - свойственна регуляция по типу обратной связи: накопление и расход конечного продукта регулирует его синтез анаболическими системами; в катаболических системах в роли регулятора выступает субстрат действия синтезируемых ферментов.
Сдвиги в ходе клеточных синтетических процессов, вследствие к-рых могут возникать ненаследуемые изменения свойств Б. одного и того же генотипа, могут быть выражены в различной степени в зависимости от окружающих условий. Резко нарушенные условия существования могут приводить к выключению Функции отдельных структурных генов или их гиперфункции, что в свою очередь может привести к значительным морфологическим изменениям, несбалансированному росту и, в конечном счете, к гибели клеток.
Комплекс свойств Б., выявляемых в данных условиях существования, называют фенотипом. Фенотип Б. хотя и зависит от окружающей среды, но контролируется генотипом, т. к. характер и степень возможных для данной клетки фенотипических изменений определяется набором генов, т. е. генотипом.
Как структурные, так и регуляторные гены Б. локализуются в бактериальной хромосоме и в сумме образуют генетический аппарат Б. Помимо этого, Б. могут нести внехромосомные генетические детерминанты - плазмиды (см.), к-рые, как правило, не являются жизненно необходимыми для клетки. Напротив, активация функций нек-рых из них (напр., бактериоцнно генов) губительна для бактериальных клеток, не несущих плазмид. Вместе с тем плазмидные элементы придают Б. ряд свойств, представляющих значительный интерес с точки зрения инфекционной патологии. Так, плазмпдными детерминантами может быть обусловлена множественная устойчивость к лекарственным веществам (см. R-фактор), выработка α-гемолизина и других бактериальных токсинов.
Хромосома Б., как и клеток высших организмов, локализована в ядре.
В отличие от клеток высших организмов, бактериальное ядро лишено оболочки и именуется нуклеоидом. Количество нуклеоидов в бактериальных клетках варьирует в зависимости от фазы роста культуры: число нуклеоидов у кишечных палочек максимально в быстро размножающихся культурах, находящихся в логарифмической фазе роста. В стационарной фазе роста кишечные палочки содержат по одному нуклеоиду. Хромосома Б. представляет собой молекулу ДНК, замкнутую в кольцо, с молекулярным весом порядка 1,5-2×109 дальтон.
Кольцевое строение бактериальной хромосомы установлено тремя методами: ауторадиографическим, электронномикроскопнческим и генетическим. В первом случае получены ауторадиограммы кольцевых структур бактериальной ДНК, во втором - электронномикроскопические изображения изолированной кольцевой ДНК, в третьем - установлены закономерности генетического обмена, объяснимые только кольцевым строением хромосомы. Это можно пояснить следующим условным примером. Допустим, что в процессе скрещивания Б. (конъюгации) от одной Б. к другой передаются гены, обозначенные буквами А, Б, В, Г, Д, Е. Один из использованных донорных штаммов Hfr (сокращение от англ. выражения high frequency of recombination - высокая частота рекомбинации) имеет точку начала передачи хромосомы в области гена В. В этом случае наблюдается следующий порядок передачи генов: В, Г, Д, Е, А, Б. Второй штамм Hfr начинает передачу хромосомы с гена Д и передает ее в направлении, противоположном предыдущему. Гены в этом случае передаются в следующем порядке: Д, Г, В, Б, А, Е. Экспериментально показанное сохранение последовательности передачи генов при измененном порядке их переноса легко объясняется кольцевым строением хромосомы (рис. 13).
Рис. 13. Схема последовательности передачи генетического материала при конъюгации E. coli, иллюстрирующая кольцевую структуру бактернальной хромосомы. Буквами обозначены различные гены Правая стрелка - последовательность передачи генов (В, Г, Д, Е, А, Б) реципиенту донорным штаммом 1; левая стрелка - последовательность передачи генов (Д, Г, В, Б, А, Е) реципиенту донорным штаммом 2
Методы, дающие возможность экспериментально осуществлять перенос генетического материала у Б. (конъюгация, трансдукция и трансформация), позволили построить генетическую карту бактериальной хромосомы, отражающую относительную локализацию генов. С целью генетического картирования широко используется конъюгация, при к-рой реципиенту передаются большие участки бактериальной хромосомы, а иногда и вся хромосома донора. При конъюгационном картировании применяют различные подходы: устанавливают передачу отдельных генов по времени, выявляют сцепленную передачу генов, устанавливают частоту передачи генов, не подвергаемых селекции (неселективных), расположенных проксимально и дистально относительно селекционируемого гена, и т. п. Конъюгация, однако, в большинстве случаев не обеспечивает возможности достаточно точного картирования, так как при этом рекомбинация (см.) осуществляется на относительно протяженных участках хромосомы. Точное картирование производят с помощью трансдукции, при которой передаются более короткие фрагменты хромосомы бактерии, не превышающие 0,01 ее длины. Один из основных приемов трансдукционного картирования состоит в определении возможности котрансдукции (т. е. совместной передачи) картируемого гена и гена, локализация к-рого в хромосоме известна. Наличие котрансдукции свидетельствует о близком (сцепленном) расположении анализируемых генов. С помощью трансдукции можно также устанавливать порядок расположения генов. Для этой цели используют специальный метод генетического анализа - так наз. тест трех точек, при к-ром анализ скрещиваний ведется относительно трех генов.
Трансформация для картирования используется сравнительно редко. Обработка реципиентных Б. трансформирующей ДНК дает возможность передавать только очень небольшие участки бактериальной хромосомы. Вследствие этого с помощью трансформации можно анализировать лишь гены, к-рые составляют группы сцеплений.
Генетическая карта E. coli К-12, построенная на основе многолетних генетических исследований, проведенных в различных лабораториях мира, насчитывает в наст, время несколько сот локализованных генов.
На рис. 14 представлена генетическая карта E. coli, опубликованная в 1970 г. Тейлором (A. L. Taylor) в журнале "Bacteriological Reviews" (США). Для удобства ориентации окружность генетической карты, схематически изображающая хромосому, разделена на отрезки - минуты, в сумме составляющие время, необходимое для передачи в процессе конъюгации всей хромосомы. Для кишечных палочек это время составляет ок. 90 мин. Размещенные по окружности символы обозначают соответствующие гены и расшифрованы в табл. 3, к-рая включает ок., 2000 бактериальных генов, функции к-рых в жизнедеятельности бактериальной клетки в значительной мере исследованы. Сведения о локализации генов на хромосоме Б. позволяют решать конкретные задачи практической микробиологии. Они служат необходимой предпосылкой для изучения вирулентности и патогенности Б., их устойчивости к лекарственным препаратам, возможности создания аттенуированных штаммов и для других целей. В расположении генов кишечной палочки и сальмонелл существует выраженная гомология.
В ряде случаев гены (цистроны), контролирующие отдельные стадии синтеза конечного метаболита, расположены в одном участке бактериальной хромосомы. Последовательность расположения генов при этом соответствует последовательности использования детерминируемых ими промежуточных соединений в ходе синтеза конечного метаболита. В том же участке хромосомы, где расположены структурные гены, могут располагаться и регуляторные генетические единицы, составляющие в совокупности с соответствующими структурными генами оперон (см.). Примером таких оперонов являются группы генов, обеспечивающих синтез гистидина, триптофана и т. д.
В других случаях структурные и регуляторные гены одного и того же биохимического пути размещаются в различных областях бактериальной хромосомы, примером чего могут служить гены, контролирующие синтез метионина, расщепление арабинозы, синтеза пуринов и др.
Изучение генетического обмена у Б. не ограничивается целью генетического картирования. Возможность такого обмена используется и при получении полезных для человека новых штаммов Б. В частности, рекомбинация между патогенными и непатогенными Б. может быть использована для конструирования аттенуированных штаммов, т. е. штаммов с ослабленной вирулентностью, пригодных для изготовления живых вакцин. Такие штаммы могут быть получены из патогенных бактерий (напр., из дизентерийных Б.) при замещении генетической области (или областей), определяющей их патогенность, соответствующими участками хромосомы неиатогенных Б. (напр., кишечных палочек). Для создания аттенуированных штаммов необходимо не только обеспечить возможность генетического обмена, но и предварительно изучить генетические основы патогенности, вирулентности, иммуногенности и картировать определяющие их гены. Только при этом условии может быть осуществлено конструирование полноценных вакцинных штаммов, утративших только вирулентность, но сохранивших свойства, обеспечивающие иммуногенность.
Генетический обмен у Б. осуществляется и в естественных условиях их обитания, следствием чего является рекомбинационная изменчивость Б., проявляющаяся в образовании атипичных форм. Это обстоятельство придает изучению рекомбинационного процесса практический интерес, т. к. механизм образования, патогенетическое и диагностическое значение атипичных форм - актуальнейшие вопросы инфекционной патологии.
Помимо фенотипической и рекомбинационной изменчивости, Б. свойственна мутационная изменчивость, т. е. изменчивость, обусловленная мутациями, представляющими собой структурные перестройки генов, полную или частичную их утрату (делеции), не связанные с рекомбинациями. Б. широко используются для изучения закономерностей мутационного процесса. Мутация (см.), т. е. изменение генотипа, - явление, вызываемое действием мутагенных агентов. Они являются основой для проведения всех генетических исследований, т. к. изучение функции генов, их картирование и другие генетические задачи могут быть решены только с помощью соответствующих мутантов. Характер бактериальных мутантов, формирующихся под влиянием мутагенных агентов, не зависит от механизма действия мутагенов (см.). Создавшееся же на первом этапе развития бактериальной генетики представление об адекватности мутационной изменчивости Б. используемым мутагенам, т. е. о специфическом действии последних, оказалось ошибочным, так же как ошибочной оказалась концепция о спонтанном характере мутационного процесса. Указанное представление исходило из того, что при действии агентов, вызывающих гибель основной части бактериальной популяции, исследователи получали мутации, соответствующие примененному агенту. Так, напр., действие сульфаниламидов сопровождалось выделением сульфамидорезистентных мутантов, действие фагов - выделением фагорезистентных мутантов и т. д. Работами Лурия (S. Luria), Дельбрюка (M. Delbruck), Ледерберга (J. Lederberg) и Ньюкомба (H. Newcombe) было показано, что формирование таких мутантов происходит до добавления губительно действующего агента, а последний играет лишь роль селекционирующего фактора. Мутационные изменения в бактериальных популяциях возникают во многих генах, но селекционирующие агенты отбирают лишь соответственные мутации. Так, напр., в мутирующей популяции Б. могут содержаться мутанты различного рода: ауксотрофы - неспособные синтезировать какие-либо необходимые клетке соединения; мутанты, утратившие или приобретшие способность ферментации отдельных углеводов; резистентные к антибиотикам и т. д. При высеве такой популяции на среду с антибиотиком немутировавшие особи, так же как особи, несущие мутации, не имеющие отношения к антибиотикоустойчивости, не дадут роста. Вырастут на такой среде только Б., имеющие мутации в гене, определяющем соответствующую резистентность. Это, однако, не означает, что происхождение антибиотикоустойчивых мутантов связано с воздействием селекционирующего агента. Причиной возникновения резистентных мутантов, как и мутантов, оставшихся невыявленными на среде с антибиотиком, являются мутационные события, совершившиеся до воздействия селекционирующего агента. В свою очередь это не означает, что селекционирующий агент не может обладать мутагенной активностью, но при наличии таковой он индуцирует мутации не только в генах, соответствующих механизму его действия, но и, как любой другой мутаген, в самых разнообразных генах, а селекционирует лишь соответственно измененные Б.
Несостоятельность концепции о спонтанном мутировании Б. была опровергнута на том основании, что при испытании многочисленных хим. соединений и физ. агентов, возможно, действующих на обычно культивируемые популяции Б., было установлено, что мутагенная активность свойственна чрезвычайно широкому кругу факторов, в т. ч. естественным метаболитам Б. Действие этих факторов не всегда поддается контролю, но объясняет причину возникновения так наз. спонтанных мутаций.
Согласно современной концепции, спонтанные мутации представляют собой явление того же порядка, что и экспериментально полученные мутации, именуемые индуцированными. Как те, так и другие, причинно обусловлены. Различия состоят лишь в том, что индуцируемые мутации возникают под влиянием специально примененных мутагенных агентов, агенты же, вызывающие спонтанные мутации, остаются невыясненными. Термин "спонтанные", таким образом, не отражает суть явления и применяется условно для обозначения мутаций, возникающих без специальных воздействий.
| Таблица включает в себя гены Escherichia coli и Salmonella typhimurium, изученные в генетическом отношении наиболее полно. Т. о., в таблице сведены все известные в наст, время бактериальные гены. Для удобства ориентации гены в таблице расположены соответственно детерминируемым ими признакам или процессам (напр., образование и утилизация углеводов и аминокислот, резистентность к антибиотикам, фагам и т. д.). Представленная в таблице группировка генов носит условный характер и не является попыткой строгой классификации. Биохимические реакции, происходящие в живых клетках, иногда осуществляются с использованием одних и тех же промежуточных продуктов или ферментов. Вследствие этого ген, детерминирующий синтез или структуру определенного фермента, может быть упомянут в таблице более чем один раз. Так, напр., фосфоенолпируваткарбоксилаза катализирует превращение субстратов цикла трикарбоновых кислот в фосфоенолпируват. Последний в реакциях неоглюкогеназы используется для образования углеводов. В других условиях этот же фермент участвует в образовании веществ аминокислотной природы (напр., глутаминовой и аспарагиновой кислот) или жирных кислот. В раздел "Отдельные компоненты нуклеиновых кислот и ферменты, обеспечивающие их генетическое функционирование" отнесены гены, детерминирующие углеводы - рибозу и дезоксирибозу, входящие в состав РНК и ДНК. Внутри каждой группы гены расположены в алфавитном порядке. Английское написание помещенных в III графе значений было положено в основу при составлении символов, обозначающих гены. Если значение символа не указано в III графе, смысл его объясняет графа IV. Графа IV объясняет также значение символов нек-рых генов сальмонелл, отличающихся от символов, обозначающих идентичные гены кишечных палочек. В таблице использованы материалы A. Taylor и C. Trotter, 1972 г. |
|||||
|---|---|---|---|---|---|
| Символ, обозначающий ген E. coli и его синонимы | Символ, обозначающий ген Salmonella | Наименование символа, способствующее его запоминанию | Признак (или продукт), контролируемый данным геном, либо эффект мутации в данном гене | Локализация идентифицированных генов на генетической карте (в минутах соответствующей карты) | |
| E. coli | Salmonella | ||||
| I | II | III | IV | V | VI |
| Углеводы | |||||
| ara A | Арабиноза | L-Арабинозоизомераза | 1 | ||
| ara B | Арабиноза | L-Рибулокиназа | 1 | ||
| ara B | Арабиноза | Утилизация | 3 | ||
| ara C | Арабиноза | Регуляторный ген | 1 | ||
| ara D | Арабиноза | L-Рибулоза-5-фосфат-4-эпимераза | 1 | ||
| ara E | Арабиноза | L-Пермеаза арабинозы | 55 | ||
| ara I | Арабиноза | Инициатор | 1 | ||
| ara O | Арабиноза | Оператор | 1 | ||
| bgl A (β-gl A) |
β-Глюкозиды |
Арил-β-глюкозидаза |
74 |
||
| bgl B (p-gl B) |
β-Глюкозиды |
Пермеаза-β-глюкозидов |
74 |
||
| bgl C (β-gi C) |
β-Глюкозиды |
Регуляторный ген |
74 |
||
| bym A | Обход мальтозной пермеазы (mal B) | (81) ( |
|||
| clb | Целлобиоза | Утилизация | 104 | ||
| crr | Конститутивный фактор III для транспорта сахаров | 76 | |||
| dml | D-малат | Утилизация | 120 | ||
| edd | Дегидраза пути Энтнера-Дудорова | 36 | |||
| fda (ald) | Фруктозо-1,6-дифосфатальдолаза | (61) | |||
| fdp | fdp | Фруктозодифосфатаза | 85 | 1 | |
| fuc | Фукоза | Утилизация L-фукозы | 53 | ||
| gal E (gal D) |
gal E | Галактоза | Уридиндифосфат (УДФ)-галактозо-4-эпимераза | 17 | 33 |
| gal F (gal) |
Галактоза |
Модификатор УДФ-глюкозопирофосфорилазы |
65 |
||
| gal K (gal A) |
gal K |
Галактоза |
Галактокиназа |
17 |
33 |
| gal O (gal C) |
gal O |
Галактоза |
Оператор |
17 |
33 |
| gal T (gal B) |
Галактоза |
Галактозо-1-фосфату ридилтрансфераза |
17 |
||
| gal R (B gal) |
gal R |
Галактоза |
Регуляторный ген |
55 |
95 |
| gal U (UPDG) |
gal U |
Галактоза |
УДФ-глюкозопирофосфорилаза |
27 |
52 |
| gas | Газообразование при ферментации углеводов | 133 | |||
| glc | Гликолат | Утилизация гликолата; малатсинтетаза G | 57 | ||
| glg A | Гликоген | Гликогенсинтетаза | 66 | ||
| glg B | Гликоген | α-1,4-глюкан: α-1,4-глюкан-6-глюкозилтрансфераза | 66 | ||
| glg C | Гликоген | Аденозиндифосфат (АДФ)-глюкозопирофосфорилаза | 66 | ||
| glp A | Глицерофосфат | L-α-глицерофосфатдегидрогеназа (анаэробная) | 43 | ||
| glp D (gly D) |
glp D |
Глицерофосфат |
L-α-глицерофосфатдегидрогеназа (аэробная) |
66 |
112 |
| glp K | glp K | Глицерофосфат | Глицеролкиназа | 78 | 120 |
| glp T | glp T | Глицерофосфат | Система транспорта L-α-глицерофосфата | 43 | 74 |
| glp R | Глицерофосфат | Регуляторный ген | 66 | ||
| gnd | gnd | 6-Фосфоглюконатдегидрогеназа | 39 | 65 | |
| inl A | Инозит | Ферментация | 135 | ||
| inl B | Инозит | Ферментация | 82 | ||
| lac A (a, lac Ac) |
Лактоза |
Тиогалактозидтрансацетилаза |
9 |
||
| lac I (i) |
Лактоза |
Регуляторный ген |
9 |
||
| lac O (O) |
Лактоза |
Оператор |
9 |
||
| lac P (P) |
Лактоза |
Промотор |
9 |
||
| lac Y (Y) |
Лактоза |
Пермеаза β-галактозидов (M белок) |
9 |
||
| lac Z (z) |
Лактоза |
β-Галактозидаза |
9 |
||
| lct | Лактат | L-лактатдегидрогеназа | 71 | ||
| mal B (mal-5) |
mal B |
Мальтоза |
Пермеаза мальтозы |
81 |
130 |
| mal I | Мальтоза | Инициатор | 66 | ||
| mal P (mal A) |
Мальтоза |
Мальтодекстринфосфорилаза |
66 |
||
| mal Q (mal A) |
mal Q |
Мальтоза |
Амиломальтаза |
66 |
112 |
| mal T (mal A) |
Мальтоза |
Регуляторный ген для mal P, Q и mal B-lam B оперонов |
66 |
||
| man | pmi | Манноза | Фосфоманнозоизомераза | 31 | 48 |
| mel A (mel 7) |
Мелибиоза |
α-Галактозидаза |
81 |
||
| mel B (mel 4) |
Мелибиоза |
Тиометилгалактозидпермеаза II |
81 |
||
| mgl P (P-MG) |
Метилгалактозид |
Пермеаза |
β-метилгалактозида |
(40) |
|
| mgl R (R-MG) |
Метилгалактозид |
Регуляторный ген |
(16) |
||
| mtl A | Маннит | Маннит-специфичный энзим II для фосфотрансферазной (ФТС) системы | 71 | ||
| mtl B | Маннит | Пермеаза маннита | 116 | ||
| mtl C | Маннит | Регуляторный ген или сайт | 71 | ||
| mtl D | mtl A | Маннит | Маннит-1-фосфатдегидрогеназа | 71 | 116 |
| pfk | pfk | Структурный или регуляторный ген дляфруктозо-6-фосфаткиназы | 78 | 124 | |
| pgi | pgi | Фосфогексоизомераза | 80 | 130 | |
| Pgl | 6-Фоефоглюкоиллактоназа | 17 | |||
| pgm | Фосфоглюкомутаза | 15 | |||
| pts Hbr (ctr, Hpr) |
pts H (car B) |
Фосфотрансферазная система - белковый кофактор |
46 |
76 |
|
| pts I (ctr) |
pts A (car A) |
Фоефотрансферазная система - фермент I |
46 |
76 |
|
| rha | Рамноза | Утилизация | 127 | ||
| rha A | Рамноза | L-рамнозоизомераза | 77 | ||
| rha B | Рамноза | L-рамнулокиназа | 77 | ||
| rha G | Рамноза | Регуляторный ген | 77 | ||
| rha D | Рамноза | L-рамнулозо-1-фосфатальдолаза | 77 | ||
| srl | Сорбит | Утилизация | 51 | ||
| tre | Трегалоза | Утилизация | 58 | ||
| uhp | Транспорт фосфорных эфиров гексоз | 72 | |||
| xyl | xyl | Ксилоза | Утилизация D-ксилозы | 70 | 116 |
| zwf | Промежуточный фермент (цвишенфермент) | Глюкозо-6-фосфатдегидрогеназа | 36 | ||
| Аминокислоты и витамины | |||||
| ala S (ala-act) |
Аланин |
Аланил-t-РНК-синтетаза |
(61) |
||
| arg A (arg B, arg 1 arg 2) |
arg B |
Аргинин |
N-ацетилглутамат-синтетаза |
54 |
95 |
| arg B (arg C) |
Аргинин |
α-N-ацетил-L-глутаматфосфотрансфераза |
79 |
||
| arg C | Аргинин |
N-ацетил-γ-глутамокиназа |
128 |
||
| arg C (arg H, arg 2) |
arg H |
Аргинин |
N-ацетилглутамин-γ-полуальдегиддегидрогеназа |
79 |
128 |
| arg D (arg G, arg 1) |
arg G |
Аргинин |
Ацетилорнитин-δ-трансаминаза |
64 |
108 |
| arg E (arg A, arg 4) |
arg A |
Аргинин |
L-орнитин-N-ацетилорнитинлиаза |
79 |
128 |
| arg F (arg D, arg 5) |
Аргинин |
Орнитинтранскарбамилаза |
7 |
||
| arg G (arg E, arg 6) |
arg E |
Аргинин |
Аргининосукцинатсинтетаза |
61 |
102 |
| arg H (arg F, arg 7) |
arg F |
Аргинин |
L-аргининосукцинатаргининлиаза |
79 |
128 |
| arg I | arg I (arg K, arg D) |
Аргинин |
Орнитинтранскарбамилаза |
85 |
0 |
| arg P | Аргинин | Пермеаза аргинина | 56 | ||
| arg R (R arg) | Аргинин |
Регулятор |
63 |
||
| arg S | Аргинин | Аргинил-Т-РНК-синтетаза | 35 | ||
| aro A | aro A | Ароматические аминокислоты | 3-Енолпирувилшикимат-5-фосфатсинтетаза | 20 | 45 |
| aro B | aro B | Ароматические аминокислоты | Дегидрохинатсинтетаза | 65 | 108 |
| aro C | aro D | Ароматические аминокислоты | Хоризмат-синтетаза | 44 | 75 |
| aro D | aro E | Ароматические аминокислоты | Дегидрогеназа | 32 | 46 |
| aro E | aro C | Ароматические аминокислоты | Дегидрошикиматредуктаза | 64 | 108 |
| aro F | aro P | Ароматические аминокислоты | 3-Дезокси-D-арабиногептулозоно-7-фосфат(ДАГФ)-синтетаза (тирозин-репрессибельный изофермент) | 50 | 87 |
| aro G | aro G | Ароматические аминокислоты | ДАГФ-синтетаза (фенилаланин-репрессибельный изофермент) | 17 | 33 |
| aro H | aro H | Ароматические аминокислоты | ДАГФ-синтетаза (триптофан-репрессибельный изофермент) | 32 | 46 |
| aro I | Ароматические аминокислоты | Функция неизвестна | 74 | ||
| aro Y | Ароматические аминокислоты | Вероятно, оператор для aro H | 32 | ||
| aro K | Ароматические аминокислоты | Оператор для aro A, tyr A | 50 | ||
| aro P | aro P | Ароматические аминокислоты | Пермеаза общая для транспорта ароматических аминокислот | 2 | 8 |
| aro T | Транспорт триптофана, фениланина и тирозина | 52 | |||
| asd (dap+hom) |
asd | Дегидрогеназа полуальдегида аспарагиновой кислоты |
66 |
112 |
|
| asn | Аспарагинсинтетаза | 74 | |||
| asp A | Аспартаза | (83) | |||
| asp B (asp) | Аспартат | Потребность в аспартате | 62 | ||
| azl | Азалейцин | Регуляция leu и ilv генов | 49 | ||
| bio A | bio A | Биотин | 2-я группа; 7-оксо-8-аминопеларгоновая кислота (7АПК)→7,8-диаминопеларгоновая кислота (ДАПК) | 18 | 33 |
| bio B | Биотин | Превращение дитиобиотина в биотин | 18 | ||
| bio C | Биотин | Блок перед пимелоил коэнзимом A | 18 | ||
| bio D | Биотин | Дитиобиотин-синтетаза | 18 | ||
| bio F | Биотин | Пимелоил коэнзим
|
18 | ||
| bio H (bio B) |
Биотин |
Блок перед пимелоил коэнзимом A | 66 |
||
| bio O | Биотин | Оператор генов bio B, bio D | 18 | ||
| bio P | Биотин | Промотор для генов bio B... bio D | 18 | ||
| bir | Аккумуляция биотина (Biotin retention) | Транспорт биотина, аккумуляция и регуляция | 79 | ||
| brn P | Аминокислоты C разветвленной углеродистой цепью (Branched chain) | Транспорт изолейцина, лейцина и валина | 2 | ||
| brn Q | Аминокислоты с разветвленной углеродистой цепью | Транспорт изолейцина, лейцина и валина | 9 | ||
| cys A | cys A | Цистеин | Пермеаза сульфата и тиосульфата | (47) | 76 |
| cys B | Babc | Цистеин | Плейотропная мутация, относящаяся к биосинтезу цистеина | 27 | 52 |
| cys C | cys C | Цистеин | Аденозин-5´-сульфатфосфаткиназа | 52 | 90 |
| cys D | Цистеин | Аденозин-5´-трифосфатсульфурилаза | 90 | ||
| cys E | cys Eab | Цистеин | Цистеин-синтетаза; серинтрансацетилаза | 73 | 116 |
| cys G | cys G, I | Цистеин | Сульфатредуктаза, II стадия | 65 | 108,90 |
| cys H | cys H | Цистеин | Аденозин-3´-фосфат-5´-сульфатфосфатредуктаза | (53) | 90 |
| cys J | Цистеин | Сульфатредуктаза, I стадия | 90 | ||
| cys P | Цистеин | Пермеаза сульфатов и сульфатредуктаза | (53) | ||
| cys Q | Цистеин | Сульфитредуктаза | (53) | ||
| ddl | D-аланин: D-аланинлигаза | 2 | |||
| dhu A | Утилизация D-гистидина | 75 | |||
| dsd A | dsd | D-серин | D-сериндезаминаза | 45 | 70 |
| dsd C | dsd | D-серин | Регуляторный ген | 44 | 70 |
| eda (lcga, kdg) |
D-серин | 2-кето-3-дезоксиглюконат-6-фосфатальдолаза |
36 |
||
| flr A | Фторлейцин | Регуляция leu и ilv генов | 90 | ||
| flr B | Фторлейцинрезистентность | Регуляция leu или ilv генов или обоих | 26 | ||
| gad R | Регуляторный ген для gad S | 72 | |||
| gad S | Декарбоксилаза глутаминовой кислоты | 72 | |||
| glm S | Глюкозамин | L-глутамин: D-фруктозо-6-фосфатаминотрансфераза | 74 | ||
| gdh | Дегидрогеназа глутаминовой кислоты | 129 | |||
| glt A (glut) |
glt |
Глутамат |
Потребность в глутамате, цитратсинтетаза |
16 |
34 |
| glt C | Глутамат | Оператор | 73 | ||
| glt E | Глутамат | Глутамил-т-РНК-синтетаза | 72 | ||
| glt H | Глутамат | Потребность | 20 | ||
| gtl M | Глутамат | Глутамил-т-РНК-синтетаза | (38) | ||
| git R | Глутамат | Регулятор для пермеазы глутамата | 81 | ||
| git S | Глутамат | Пермеаза глутамата | 73 | ||
| gly A | gly A | Глицин | Сериноксиметилтрансфераза | 48 | 78 |
| gly S (gly-act) |
Глицин |
Глицил-т-РНК-синтетаза |
70 |
||
| gly T (sup A36, su 36, sum A) |
Глицин |
Глицил-т-РНК II |
79 |
||
| gly U (sum B) |
Глицин |
Глицил-т-РНК I |
55 | ||
| gly V | Глицин | Глицил-т-РНК III | (86) | ||
| his A | his A | Гистидин | Изомераза | 39 | 65 |
| his B | his B | Гистидин | Имидазолглицерофосфатдегидраза и гистидинолфосфатаза (бифункциональный фермент) | 39 | 65 |
| his C | his C | Гистидин | Имидазолацетофосфаттрансаминаза | 39 | 65 |
| his D | his D | Гистидин | Гистидинолдегидрогеназа | 39 | 65 |
| his E | his E | Гистидин | Фосфорибозил-АТФ-пирофосфогидролаза | 39 | 65 |
| his F | his F | Гистидин | Циклаза | 39 | 65 |
| his G | his G | Гистидин | Фосфорибозил-АТФ-пирофосфорилаза | 39 | 65 |
| his H | his H | Гистидин | Амидотрансфераза | 39 | 65 |
| his I | his I | Гистидин | Фосфорибозил-АМФ-фосфогидролаза | 39 | 65 |
| his J | Гистидин | Белок j, связывающий D-гистидин | 75 | ||
| his O | his O | Гистидин | Оператор | 39 | 65 |
| his P | Гистидин | Пермеаза | 75 | ||
| his R | Гистидин | Регуляция | 122 | ||
| his S | Гистидин | Гистидил-т-РНК-синтетаза | 78 | ||
| his T | Гистидин | Депрессия гистидинового пути | 75 | ||
| his U | Гистидин | Депрессия гистидинового пути | 120 | ||
| his W | Гистидин | Депрессия гистидинового пути | 73 | ||
| hut C | Утилизация гистидина | Репрессор | 33 | ||
| hut G | Утилизация гистидина | Формининоглутаматгидролаза | 33 | ||
| hut H | Утилизация гистидина | Гистидаза | 33 | ||
| hut I | Утилизация гистидина | Имидазолонпропионатгидролаза | 33 | ||
| hut M | Утилизация гистидина | Промотор для hut I, G, C | 33 | ||
| hut P | Утилизация гистидина | Промотор hut U, H | 33 | ||
| hut Q | Утилизация гистидина | Оператор для hut U, H | 33 | ||
| hut R | Утилизация гистидина | Резистентность hut U, H к репрессии катаболитом | 33 | ||
| hut U | Утилизация гистидина | Уроканаза | 33 | ||
| ile S | Изолейцил-т-РНК-синтетаза | 1 | |||
| ilv A (ile) |
ilv A |
Изолейцин-валин |
Треониндезаминаза |
75 |
122 |
| ilv B | ilv B | Изолейцин-валин | Синтетаза I α-ацетогидроксильной кислоты | 75 | |
| ilv C (ilv A) |
ilv C |
Изолейцин-валин |
Редуктоизомераза α-окси-β-кетокислоты |
75 |
122 |
| ilv D (ilv B) |
ilv D |
Изолейцин-валин |
Дегидраза |
75 |
123 |
| ilv E (ilv C) |
ilv E |
Изолейцин-валин |
Трансаминаза B |
75 |
122 |
| ilv F | Изолейцин-валин | Возможно, синтетаза II ацетогидроксильной кислоты | 48 | ||
| ilv O | Изолейцин-валин | Оператор для генов ilv A, D, E | 75 | ||
| ilv P | Изолейцин-валин | Оператор для гена ilv B | 75 | ||
| ilv Q | Изолейцин-валин | Распознавание индуцирующего участка для ilv C | 75 | ||
| ilv S | Изолейцин-валин | Изолейцил-т-РНК-синтетаза | 3 | ||
| ilv Y | Изолейцин-валин | Положительный элемент контроля индукции ilv C | 75 | ||
| leu A | leu A | Лейцин | α-Изопропилмалатсинтетаза | 2 | 3 |
| leu B | leu B | Лейцин | β-Изопропилмалатдегидрогеназа | 2 | 3 |
| leu C, D | Лейцин | Изомераза | 3 | ||
| leu O | Лейцин | Оператор | 3 | ||
| leu S | leu S | Лейцин | Лейцил-т-РНК-синтетаза | 14 | 26 |
| leu T | Лейцин | Транспорт лейцина | 52 | ||
| lys A | lys | Лизин | Декарбоксилаза диаминопимелиновой кислоты | 55 | 95 |
| lys C (apk) |
Лизин |
Лизинаспартокиназа III |
80 |
/td> | |
| met A (met 3) |
met A (met I) |
Метионин |
Гомосерин O-транссукцинилаза |
80 |
128 |
| met B (met-1, met1) |
met B |
Метионин |
Цистатионинсинтетаза |
78 |
128 |
| met C | met C | Метионин | Цистатионаза | 58 | 100 |
| met D | Метионин | Утилизация D-метионина | 6 | ||
| met E (met-B12) |
met E |
Метионин |
N5-метилтетрагидроптероилтриглютаматгомоцистеинметилаза |
76 |
122 |
| met F (met-2, met2) |
met F |
Метионин |
N5, N10-метилтетрагидрофолатредуктаза |
78 |
128 |
| met G | Метионин | Метионил-т-РНК-синтетаза | 67 | ||
| met H | Метионин | Кобаламинзависимая гомоцистеин-N5-метилтетрагидрофолаттрансметилаза | 128 | ||
| met J | met J | Метионин | Резистентность к аналогам метионина (возможно, регуляторный ген) | 78 | 128 |
| met K | met K | Метионин | S-аденозилметионинсинтетазная активность | 57 | 95 |
| met L | Метионин | Метионинаспартокиназа II | 78 | ||
| met M | Метионин | Гомосериндегидрогеназа II | 78 | ||
| met P | Метионин | Пермеаза метионина (резистентность к α-метилметионину) | 5 | ||
| nad A (nic A) |
nic A |
Никотинамидадениндинуклеотид |
Потребность в никотиновой кислоте |
17 |
33 |
| nad B(nic B) | Никотинамидадениндинуклеотид |
Потребность в никотиновой кислоте |
49 |
||
| nic B | Никотинамид | Потребность в никотинамиде | 82 | ||
| nad C (nic) |
Никотинамидадениндинуклеотид |
Хинолинатфосфорибозилтрансфераза |
2 |
||
| pab A | n-Аминобензоат | Потребность | 65 | ||
| pab B | n-Аминобензоат | Потребность | 30 | ||
| pan | npan A | Пантотеновая кислота | Потребность | 3 | 7 |
| pan B | Пантотеновая кислота | α-Кето-изовалериановая кислота→кетопантоевая кислота | 7 | ||
| pan C | Пантотеновая кислота | Пантоевая кислота→пантотеновая кислота | 7 | ||
| pdx A | Пиридоксин | Потребность | 1 | ||
| pdx B | pdx B | Пиридоксин | Потребность | 44 | 75 |
| pdx C | Пиридоксин | Потребность | 20 | ||
| phe A | phe A | Фенилаланин | Дегидраза префеновой кислоты | 50 | 87 |
| phe O | Фенилаланин | Оператор | 50 | ||
| phe R | Фенилаланин | Регулятор для phe A | 96 | ||
| phe S (phe-act) |
Фенилаланин |
Фенилаланил-т-РНК-синтетаза |
33 |
||
| poa | Пролиноксидаза | 24 | |||
| pro A (pro1) |
pro A |
Пролин |
Блок перед стадией образования полуальдегида α-глутамата |
7 |
10 |
| pro B (pro2) |
pro B |
Пролин |
Блок перед стадией образования полуальдегида α-глутамата |
8 |
10 |
| pro C (pro3, pro2) |
pro C |
Пролин |
Вероятно, Δ-пирролин-5-карбоксилатредуктаза |
10 |
10 |
| put A | Пролин | Утилизация; пролиноксидаза | 42 | ||
| put B | Пролин | Утилизация; пирролин-5-карбоксилатдегидрогеназа | 42 | ||
| put C | Пролин | Утилизация; конститутивный синтез put A, put B ферментов | 42 | ||
| put R | Пролин | Утилизация; нечувствительность ферментов put A и put B к катаболитной репрессии | 42 | ||
| ier A | ser A | Серин | Дегидрогеназа 3-фосфоглицериновой кислоты | 56 | 95 |
| ser B | ser B | Серин | Фосфосеринфосфатаза | 90 | 0 |
| ser C (pdx F) |
ser C |
Серин | 3-Фосфосерин-2-оксоглутаратаминотрансфераза |
20 |
73 |
| ser O | Серин | Оператор | 20 | ||
| ser S | Серин | Серил-т-РНК-синтетаза | 20 | ||
| thi A (thi) |
thi A |
Тиамин |
Синтез тиазола |
79 |
128 |
| thi B | thi B | Тиамин | Тиаминфосфатпирофосфорилаза | (78) | 82 |
| thi C | Тиамин | Тиазольный тип | 17 | ||
| thi D | Тиамин | Только тиамин | 74 | ||
| thi E | Тиамин | Тиазольный тип | 85 | ||
| thi F | Тиамин | Тиазольный тип | 86 | ||
| thi G | Тиамин | Тиамин или тиазольный остаток | 128 | ||
| thi O | Тиамин | Вероятно, оператор для генов thi A и thi B | (78) | ||
| thr A (HS, thr D) |
thr A |
Треонин |
Аспартокиназа 1-гомосериндегидрогеназа, 1 комплекс |
0 |
0 |
| thr B | thr B | Треонин | Гомосеринкиназа; гомосеринфосфат | 0 | 0 |
| thr C | thr C | Треонин | Треонинсинтетаза; β-аспартилфосфат→гомосерин | 0 | 0 |
| thr D | Треонин | Аспартиловая кислота→β-аспартилфосфат | 0 | ||
| tna A (ind) |
Триптофаназа |
73 |
|||
| tna R (Rtna) |
Регуляторный ген |
73 |
|||
| trp A (tryp-2) |
trp C |
Триптофан |
Триптофансинтетаза, A-белок |
27 |
52 |
| trp B (tryp-1) |
trp D |
Триптофан |
Триптофансинтетаза, B-белок |
27 |
52 |
| trp C (tryp-3) |
trp E |
Триптофан |
Индол-3-глицерофосфатсинтетаза |
27 |
52 |
| trp D (try E) |
trp B |
Триптофан |
Фосфорибозилантранилаттрансфераза |
27 |
52 |
| trp E (try D) |
trp A |
Триптофан |
Антранилатсинтетаза |
27 |
52 |
| trp O | trp O | Триптофан | Оператор | 27 | 52 |
| trp P | trp P | Триптофан | Пермеаза триптофана | 27 | 52 |
| trp R (R try) |
trp R |
Триптофан |
Регулятор |
90 |
0 |
| trp S | Триптофан | Триптофанил-т-РНК-синтетаза | 65 | ||
| tyr A | tyr A | Тирозин | Дегидрогеназа префеновой кислоты | 50 | 87 |
| tyr O (fpr) | Тирозин | Оператор для генов aro F и tyr A | 87 | ||
| tyr R | tyr R | Тирозин | Регулятор для генов tyr A и aro F, G | 28 | 52 |
| tyr S | Тирозин | Тирозил-т-РНК-синтетаза | 32 | ||
| vat S (val-act) |
Валин |
Валил-т-РНК-синтетаза |
85 |
||
| Утилизация и синтез других соединений | |||||
| ace A (icl) |
Ацетат |
Утилизация ацетата изоцитратлиаза |
80 |
||
| ace B (mas) |
Ацетат |
Утилизация ацетата малатсинтетаза A |
80 |
||
| ace E (ace E1) |
Ацетат |
Потребность в ацетате; пируватдегидрогеназа (декарбоксилазный компонент) |
2 |
||
| ace F (ace E2) |
Ацетат |
Потребность в ацетате; пируватдегидрогеназа (редуктаза липоевой кислоты-трансацетилазный компонент) |
2 |
||
| ape | Дефицит энзима, осуществляющего гидролиз N-ацетил-фенилаланин-β-нафтилового эфира | 19 | |||
| ato A | Ацетоацетат | Трансфераза коэнзима A | 42 | ||
| ato B | Ацетоацетат | Тиолаза II | 42 | ||
| ato C | Ацетоацетат | Регулятор | 42 | ||
| chi A (nar A) |
chi A |
Хлорат |
Плейотропные мутации, ответственные за нитратхлоратредуктазу и водородлиазную активность |
18 |
33 |
| chi B (nar B) |
chi B |
Хлорат |
Плейотропные мутации, ответственные за нитратхлоратредуктазу и водородлиазную активность |
77 |
122 |
| chi C (nar C) |
chi G |
Хлорат |
Структурный ген нитратредуктазы |
26 |
52 |
| chi D (nar D, nar F) |
chi D |
Хлорат |
Нитратхлоратредуктаза |
17 |
33 |
| chi E (nar E) |
chi E |
Хлорат |
Нитратредуктаза |
18 |
33 |
| chi F | chi F | Хлорат | Структурный ген для форматдегидрогеназы | 28 | 33 |
| chi G | chi G | Хлорат | Форматнитратная редуктаза | 0 | 82 |
| crp (cap) |
crp |
Рецепторный белок для циклического АМФ |
64 |
108 |
|
| oxr | Синтез метилглиоксаля | 7 | |||
| dad | Дегидрогеназа D-аминокислот | 50 | |||
| dad R | Регуляторный ген для деаминаз D-аминокислот | 26 | |||
| dap A | dap A | Диаминопимелат | Синтетаза дигидродипиколиновой кислоты | 47 | 77 |
| dap B | dap B | Диаминопимелат | Редуктаза дигидродипиколиновой кислоты | 0 | 2 |
| dap G | dap G | Диаминопимелат | Тетрагидродипиколиновая кислота→N-сукцинилдиами нопимелат | 3 | 7 |
| dap D | dap D | Диаминопимелат | Тетрагидродипиколиновая кислота→N-сукцинилдиаминопимелат | 3 | 7 |
| dap E (dap E) |
Диаминопимелат |
Дезацилаза-N-сукцинилдиаминопимелиновой кислоты |
47 |
||
| dap F | Рацемаза диаминопимелиновой кислоты | 7 | |||
| dct | dct | Транспорт дикарбоксильных кислот | 69 | 116 | |
| enb (asc) | Энтерооактин | 20 | |||
| ent A | Энтерохелин | 2,3-Дигидро-2,3-дигидроксибензоатдегидрогеназа | 14 | ||
| ent B | Энтерохелин | 2,3-Дигидро-2,3-дигидроксибензоатсинтетаза | 14 | ||
| ent G | Энтерохелин | Изохоризматсинтетаза | 13 | ||
| ent D | Энтерохелин | Неизвестная ступень в превращении 2,3-дигидроксибензоата в энтерохелин | 13 | ||
| ent E | Энтерохелин | Неизвестная ступень в превращении 2,3-дигидроксибензоата в энтерохелин | 13 | ||
| ent F | Энтерохелин | Неизвестная ступень в превращении 2,3-дигидроксибензоата в энтерохелин | 13 | ||
| fab A | β-Гидроксидеканоилтиоэфир дегидраза | 22 | |||
| fab B | fab B | Биосинтез жирных кислот | 44 | 75 | |
| fad A (old-A) |
Деградация жирных кислот |
Тиолаза 1 |
77 |
||
| fad B (old-B) |
Деградация жирных кислот |
Гидроксиацил-кофэрмент-А-дегидрогеназа |
77 |
||
| fad D (old-D) |
Деградация жирных кислот | Ацил-кофермент-А-синтетаза |
35 |
||
| fdh A | Форматводородлиазный комплекс; форматдегидрогеназа | 116 | |||
| fep | Дефект в транспортной системе железа, зависимой от энтерохелина | 13 | |||
| fus (far) | Фактор EFG; удлинение белковой цепи | 64 | |||
| gur A | Глюкуронид | β-Глюку ронидаза | 31 | ||
| gur B | Глюкуронид | Утилизация метил-β-D-глюкуронида | 64 | ||
| gur C | Глюкуронид | Утилизация метил-β-D-глюкуронида | (16) | ||
| hem A | hem A | Гемин | Синтез δ-аминолевулиновой кислоты | 26 | 50 |
| hem B (ncf) |
hem B |
Гемин |
Синтез каталазы и цитохромов |
9 |
13 |
| icl | См. ace A | ||||
| icl R | Регуляция глиоксилатного цикла | 80 | |||
| kac | Аккумуляция K+ | Дефект в потреблении ионов калия | (16) | ||
| hdp AD | Зависимость по K+ | Потребность в высокой концентрации ионов калия | 16 | ||
| lip | lip | Липоевая кислота | Потребность | 15 | 26 |
| lpd | Липоилдегидрогеназа | 3 | |||
| men A | Менахинон | Потребность | 79 | ||
| mur C | Муреин | Энзим, присоединяющий α-аланин | 2 | ||
| mur E | Муреин | Энзим, присоединяющий мезодиаминопимелиновую кислоту | 2 | ||
| mur I | Муреин | Энзим, встраивающий D-аланил-В-аланин | 2 | ||
| nag A | N-ацетилглюкозамин | N-ацетилглюкозамин-6 -фосфатдеацетилаза | 15 | ||
| nag B | N-ацетил глюкозамин | Глюкозамин-6-фосфат деаминаза | 15 | ||
| nar | Нитрат редуктаза | См. chl | |||
| pho A (P) |
Фосфатаза |
Щелочная фосфатаза |
10 |
||
| pho R (pho R 1, pho) |
Фосфатаза |
Регулятор |
10 |
||
| pho S (R2 pho, R2) |
Фосфатаза |
Регулятор |
73 |
||
| pis A | Фосфолипид | Ацилтрансфераза глицерин-3-фосфата | 12 | ||
| pop A | Порфирин | Возможно, феррохелатаза | 11 | ||
| pop B | Порфирин | Вероятно, копропорфириноксидаза | 17 | ||
| pop C | Порфирин | Синтез баминолевулиновой кислоты | 4 | ||
| ppc (glu, asp) |
ppc |
Потребность в сукцинате, аспартате или глутамате; фосфоенолпируваткарбоксилаза |
79 |
128 |
|
| pps | Утилизация пирувата или лактата; фосфопируватсинтетаза | 33 | |||
| prd | Пропандиол | 1,2-Пропандиол дегидрогеназа | 53 | ||
| sdh | Сукцинатдегидрогеназа | 16 | |||
| shi A | Шикимовая кислота | Шикимат и дегидрошикиматпермеаза | 38 | ||
| spe A | Спермидин | Аргининдекарбоксилаза | 57 | ||
| spe B | Спермидин | Агматинуреогидролаза | 57 | ||
| spe C | Спермидин | Орнитиндекарбоксилаза | 57 | ||
| suc A (sue, lys+met) |
Сукцинат |
Потребность в сукцинате; α-кетоглутаратдегидрогеназа (декарбоксилазный компонент) |
16 |
||
| sue B (sue, lys+met) |
Сукцинат |
Потребность в сукцинате; α-кетоглутаратдегидрогеназа (дигидролипоилтранссукцинилазный компонент) |
16 |
||
| suc | Сукцинат+NH4 | Утилизация | 33 | ||
| let | Транскетолаза | (55) | |||
| tpi | Триозофосфатизомераза | 78 | |||
| irk A | Транспорт калия | 64 | |||
| trk B | Транспорт калия | 64 | |||
| trh C | Транспорт калия | 1 | |||
| trk D | Транспорт калия | 75 | |||
| trk E | Транспорт калия | 28 | |||
| ttr | Тетратионитредуктаза | 46 | |||
| ubi A | Убихинон | 4-Оксибензоат 3-октапренил-4-оксибензоат (ОПРБ) | 83 | ||
| ubi B | Убихинон | 2-Октапренилфенол→2 октапренил-6-метокси-1,4-бензохинон | 76 | ||
| ubi D | Убихинон | ОПОБ→2 октапренилфенол | 76 | ||
| ubi E | Убихинон | 2-Октапренил-6-метокси-1,4-бензохинон→2-октапренил-3-метил-6-метокси-1,4-бензохинон | 76 | ||
| ubi F | Убихинон | 2-Октапренил-3-метил-6-метокси-1,4-бензохинон→2 октапренил-3-метил-5-гидрокси-6-метокси-1,4 бензохинон | 15 | ||
| ubi C | Убихинон | 3-Октапренил-3-метил-5-гидрокси-6-метокси-1,4-бензохинон→убихинон-8 | 42 | ||
| unc A | Разобщение | Связанная с мембраной Mg++-Са++-зависимая аденозинтрифосфатаза | 74 | ||
| Компоненты нуклеиновых кислот и ферменты, обеспечивающие их генетическое функционирование | |||||
| cdd | Цитидиндеаминаза | 67 | |||
| cod | Цитозиндеаминаза | 105 | |||
| cya | cya (pie) | Аденилциклага | 75 | 122 | |
| deo A (tpp) | Дезоксирибоза | Тимидинфосфорилаза | 0 | ||
| deo D | (см. ген pup кишечной палочки) | ||||
| deo K | Дезоксирибоза | Дезоксирибозокиназа | 37 | ||
| deo P | Дезоксирибоза | Пермеаза дезоксирибозы | 37 | ||
| deo R | Дезоксирибоза | Конститутивный синтез ферментов генов deo A, B, C и D | 22 | ||
| dna A | Инициация синтеза ДНК |
73 |
|||
| dna B (gro P) |
Синтез ДНК |
(81) |
|||
| dna C (dna D) |
dna C |
Инициация синтеза ДНК |
89 |
2 | |
| dra (deo C, thy R) |
deo C (dra) |
Дезоксирибоза |
Дезоксирибоза-5-фосфат-альдолаза, тип II |
89 |
0 |
| drm (deo B, thy R) |
deo B (drm) |
Дезоксирибоза |
Фосфодезоксирибомутаза |
89 |
0 |
| end A (endo 1) |
ДНК-специфическая эндонуклеаза I |
57 |
|||
| end B | ДНК-специфическая эндонуклеаза I | (16) | |||
| gro N (rif, stl, stv, ron) |
РНК-полимераза: β-субъединица | 79 |
|||
| gua A (guab) |
gua B |
Гуанин | Ксантозин-5′-монофосфатаминаза | 47 |
78 |
| gua B (guaa) |
gua A |
Гуанин |
Инозин-5′-монофосфат (ИМФ)-дегидрогеназа |
47 |
78 |
| gua C | Гуанин | Гуанозин-5′-монофосфат (ГМФ)редуктаза | 89 | ||
| gua O | Гуанин | Оператор | 47 | ||
| gxu | Гуанин-ксантинфосфорибозил-трансфераза | 10 | |||
| mec | ДНК-метилаза для цитозина | (39) | |||
| nrd A (dna F) |
Рибонуклеозиддифоофат-редуктаза; субъединица B1 |
42 |
|||
| nrd B | Рибонуклеозиддифосфат-редуктаза: субъединица B2 | 42 | |||
| nuc R | Нуклеозиды | Регуляторный ген для pup, tpp, dra | 19 | ||
| pnc A (nam) |
Пиридиннуклеотидный цикл |
Никотинамид-деамидаза |
33 | ||
| pnc H | Пиридиннуклеотидный цикл | Гиперпродукция никогинамид-деамидазы | 33 | ||
| pnp | Полинуклеотидфосфорилаза | 61 | |||
| pol A (res A) |
pol A |
Полимераза |
ДНК-полимераза I |
76 |
|
| pol B | Полимераза | ДНК-полимераза II | 2 | ||
| pol C (dna E) |
Полимераза |
ДНК-полимераза III |
4 |
||
| pup | deo D | Пуриннуклеозидфосфорилаза | 90 | 0 | |
| pur A (adek, Ad4) |
pur A |
Пурин |
Аденилсукцинат-синтетаза |
34 |
135 |
| pur B (adeh) |
pur B |
Пурин |
Аденилсукциназа |
25 |
43 |
| pur C (adeG) |
pur C |
Пурин |
Фосфорибозил-аминоимидазол - синтетаза |
47 |
78 |
| pur D (adtha) |
pur D |
Пурин |
Фосфорибозилглицинамид-синтетаза |
79 |
128 |
| pur E (ade3, adef, Pur2) |
pur E |
Пурин |
Фосфорибозил-аминоимидазол-карбоксилаза |
12 |
19 |
| pur F (pur C, adeu,b) |
pur F |
Пурин |
Фосфорибозилпирофосфат - амидотрансфераза |
44 |
75 |
| pur G (adhb) |
pur G |
Пурин |
Фосфорибозилформилглицинамидин-синтетаза |
47 |
78 |
| pur H (ade1) |
pur H |
Пурин |
Фосфорибозил-аминоимидазолкарбоксамид-формилтрансфераза |
79 |
128 |
| pur I | pur I | Пурин | Аминоимидазолриботидсинтетаза | 48 | 78 |
| pur J | Пурин | ИМФ-циклогидролаза | 128 | ||
| pur A (cap, arg+ura) |
pyr A (arg D, ars, aus) |
Пиримидин |
Глутаминкарбамоилфосфатсинтетаза |
1 |
3 |
| pur B | pyr B | Пиримидин | Аспартаттранскарбамилаза | 85 | 0 |
| pur C | pyr C | Пиримидин | Дигидрооротаза | 24 | 42 |
| pur D | pyr D | Пиримидин | Дегидрогеназа дигидрооротовой кислоты | 21 | 42 |
| pur E | pyr E | Пиримидин | Пирофосфорилаза оротидиловой кислоты | 72 | 116 |
| pur F | pyr F | Пиримидин | Декарбоксилаза оротидиловой кислоты | 27 | 52 |
| pyr G | Цитидинтрифосфат (ЦТФ)-синтетаза | 90 | |||
| pyr H | Уридинмонофосфаткиназа | 7 | |||
| pyr R | Регуляция, дерепрессия аспартаттранскарбамилазы и дигидрооротат дегидрогеназы | 7 | |||
| rbs K | Рибоза | Рибокиназа | 74 | ||
| rbs P | Рибоза | Пермеаза-D-рибозы | 74 | ||
| rel (RC) |
rel |
Ослабленный (relaxed) |
Регуляция синтеза РНК |
53 |
91 |
| rns A (rns) | Рибонуклеаза | Рибонуклеаза I | 14 | ||
| rns B (rne) | Рибонуклеаза II | 57 | |||
| sts | Измененная активность рибонуклеазы II | 74 | |||
| tdk | tdk | Дезокситимидинкиназа | 27 | 52 | |
| thy | A thy | Тимидин | Тимидилатсинтетаза | 54 | 95 |
| tpp (deo A, TP) |
deo A |
Тимидинфосфорилаза |
89 |
0 |
|
| trm A | Метилаза для 5-метилурацила в т-РНК | 79 | |||
| udk | Уридинкиназа | 67 | |||
| udp | udp | Уридинфосфорилаза | 76 | 122 | |
| upp | Уридинмонофосфатпирофосфорилаза | 78 | |||
| ura P | Урацил | Пермеаза урацила | 50 | ||
| val S (val-act) |
Валин |
Валил-т-РНК-синтетаза |
85 |
||
| xth A | Экзо-три | Экзонуклеаза III | 31 | ||
| Резистентность или чувствительность к биологическим, физическим и химическим агентам | |||||
| acr A | Акридин | Чувствительность к акрифлавину, фенитиловому спирту, додецилсульфату натрия | (10) | ||
| amp A | Ампициллин | Резистентность или чувствительность к пенициллину | 83 | ||
| amt A | Резистентность к 40 mM 3-амино-1,2,4-триазолу в присутствии гистидина | 52 | |||
| azi (pea, fts A) |
azi A |
Азид |
Резистентность к азиду натрия или фенитиловому спирту; образование нитей при 42° |
2 |
3 |
| azi B | Азид | Резистентность к 3,4 mM азида натрия | 125 | ||
| bac | Осмотическая чувствительность | 110 | |||
| can | Канаванин | Устойчивость к канаванину | 56 | ||
| cet (ref, ref II) | Толерантность к колицину E2 | 90 | |||
| chr (car) |
Хром |
Чувствительность к хрому |
52 |
||
| cml A | Хлорамфеникол | Резистентность или чувствительность к хлорамфениколу | 19 | ||
| cml B | Хлорамфеникол | Резистентность или чувствительность к хлорамфениколу | 21 | ||
| eyc A | Циклосерин | Первая ступень резистентности к D-циклосерину | 84 | ||
| dar A | См. uvr D | ||||
| ery A | Эритромицин | 50-8 белок 50 S рибосомальных субъединиц | 64 | ||
| ery B | Эритромицин | Высокий уровень резистентности к эритромицину | (10) | ||
| exr | См. lex | ||||
| fol | Дегидрофолатредуктаза (3-метопримрезистентность) | 3 | |||
| ksg A | Касугамицин | РНК-метилаза для 16 S рибосомальной РНК | (1) | ||
| lar | Большой (large) | Большие клетки; радиорезистентность | 61 | ||
| lex (exr) |
Резистентность или чувствительность к x-лучам и ультрафиолету |
81 |
|||
| lin B | Линкомицин | Высокий уровень резистентности к линкомицину | (29) | ||
| lir | Повышенная чувствительность к линкомицину или эритромицину или к обоим антибиотикам | (9) | |||
| meg | Менохинон | Низкий уровень резистентности к аминогликозидным антибиотикам (дефицит менахинона) | 122 | ||
| mng | Марганец | Резистентность или чувствительность к марганцу | (35) | ||
| mtc (Mb, mbl) |
Митомицин C |
Чувствительность к акридиновым красителям, метиленовому синему и митомицину C |
10 |
||
| mtr | Метилтриптофан | Резистентность к 5-метилтриптофану | 61 | ||
| nal A | Налидиксовая кислота | Резистентность или чувствительность к налидиксовой кислоте | 42 | ||
| nal B | Налидиксовая кислота | Резистентность или чувствительность к налидиксовой кислоте | 51 | ||
| nek | Резистентность к неомицину и канамицину (30 S рибосомальный белок) | (64) | |||
| phr | Фотореактивация | Фотореактивация УФ-повреждений ДНК (УФ-чувствительность) | 17 | ||
| ras | Радиоч увствительность | Чувствительность к УФ и х-лучам | (10) | ||
| rif | rif | Рифампицин | (см. gro N), резистентность к рифампицину, стрептоварицину и стрептолидигину | 79 | 128 |
| ror A | Резистентность к х-лучам | 54 | |||
| sid | Альбомицинрезистентность; сидерохром | 7 | |||
| spc A (eps) |
spc A |
Спектиномицин |
P4 белок 30S рибосомальных субъединиц; рибосомальная резистентность к спектиномицину |
64 |
108 |
| spc B | Спектиномицин | Нерибосомальная резистентность к спектиномицину | 108 | ||
| str A | sir A | Стрептомицин | Резистентность, зависимость или чувствительность к стрептомицину; P10 белок 30S рибосомальной субъединицы | 64 | 108 |
| sir B | sir B | Стрептомицин | Низкий уровень резистентности + аукеотрофность | 7 | 78 |
| stv | Стрептоварицин | Чувствительность к стрептоварицину ДНК-зависимой РНК-полимеразы (см. rif) | 77 | ||
| tmr A | Триметопримрезистентность; дигидрофолатредуктазная активность | 1 | |||
| tmr B | Триметопримрезистентность; дигидрофолатредуктазная активность | 1 | |||
| tol A (cim, tol 2) |
Устойчивость (толерантность) |
Устойчивость к колицинам E2, E3, A и K |
17 |
||
| tol | B (tol 3) |
Устойчивость (толерантность) |
Устойчивость к колицинам El, E2, E3, A и K |
17 |
|
| tol C (col El-i, tol 8, ref 1) |
Устойчивость (толерантность) |
Специфическая устойчивость к колицину E1 |
59 |
||
| tol D | Устойчивость (толерантность) | Устойчивость к колицинам E2 и E3; ампициллинрезистентность | (20) | ||
| trz A | Резистентность к 1,2,4-триазолу | 76 | |||
| uvr A (dar 3) | uvr A | Ультрафиолет | Репарация УФ-повреждений ДНК | 130 | 80 |
| uvr B (dar 1,6) |
uvr B |
Ультрафиолет |
Репарация УФ-повреждений ДНК |
18 |
33 |
| uvr C (dar 4,5) |
uvr C |
Ультрафиолет |
Репарация УФ-повреждений ДНК |
36 |
(64) |
| uvr D (dar 2, rad, uvr 502) |
Ультрафиолет |
Репарация УФ-повреждений ДНК |
75 |
||
| uvr F | Ультрафиолет | Репарация УФ-повреждений ДНК (см. rec F) | 73 | ||
| uvr | Ультрафиолет | УФ-чувствительность | 125 | ||
| Признаки, относящиеся к бактериальным вирусам | |||||
| ata A (att P22 1) |
Прикрепление |
Место прикрепления профага P22 |
10 |
||
| atb A (att P27 1) |
Прикрепление |
Место прикрепления профага P27 |
19 |
||
| atb B (att P27 11) |
Второе место прикрепления профага P27 |
10 |
|||
| atc A (att P22 1) |
Прикрепление |
Место прикрепления профага P221 |
40 |
||
| atd A (att P61, att P14) | Место прикрепления профагов P6, или P14 в группе C сальмонелл |
85 |
|||
| aff | λ | Прикрепление | Место интеграции профага | 17 | |
| att P2 H | Прикрепление | Участок H в месте интеграции фага P2 | 38 | ||
| att P2 II | Прикрепление | Участок II в месте интеграции фага P2 | 77 | ||
| att ∅ 80 | Прикрепление | Место интеграции профага φ 80 | 27 | ||
| att 82 | Прикрепление | Место интеграции профага 82 | 17 | ||
| att 186 | Прикрепление | Место интеграции профага 186 | 50 | ||
| att 434 | Прикрепление | Место интеграции профага 434 | 17 | ||
| bfe (cer) |
Прикрепление |
Резистентность или чувствительность к фагу ВГ23 и колицинам E1, E2 и E3 |
79 | ||
| hfl | Высокая частота лизогенизации фагом λ | 84 | |||
| hsp LT | Специфичность хозяина | Система рестрикции и модицикации | 12 | ||
| hsm (hs, rm, hsp) |
hsps |
Специфичность хозяина |
Модификационная активность хозяина: ДНК-метилаза M |
89 |
135 |
| hsr (hs, rm, hsp, por) |
hsps |
Специфичность хозяина |
Рестрикционная активность хозяина: эндонуклеаза R |
89 |
135 |
| hss | Специфичность хозяина | Детерминант специфичности для активностей hsm и hsr | 89 | ||
| lam B (mal B) |
λ |
Рецептор для фага λ |
81 |
||
| mul | Мутабельность УФ-облученного фага λ | 73 | |||
| pon | P1 | Резистентность или чувствительность к фагам P1 и Mi-1 | (65) | ||
| por | PI рестрикция | (см. hsr) | |||
| rep | Репликация | Подавление литической репликации умеренных фагов | 75 | ||
| tfr A (∅ r) |
T4 |
Резистентность или чувствительность к фагам T4, T3, T7 и λ |
(7) |
||
| ton A (T1, T5, rec) |
T1 |
Резистентность или чувствительность к фагам T1 и T5 |
3 |
||
| ton B (T1 rec, exb) |
T1 |
Резистентность к фагам T1, φ 80 и колицинам B, I, Y; транспорт Ге, выделение энтерохелина |
27 |
||
| tsx (T6 res) |
T6 |
Резистентность или чувствительность к фагу T6 и колицину K |
10 |
||
| Другие признаки бактерий | |||||
| ah 1 (Ahl A, Ah 1C) |
Контроль H1 активности |
65 |
|||
| ah 2 (Ah 2) |
Контроль H2 активности |
82 |
|||
| ast | Астазия | Общая высокая мутабельность | (3) | ||
| cap S | Капсула | Регулятор синтеза капсульного полисахарида | 24 | ||
| cat | Катаболитная репрессия | 24 | |||
| che A (mot A) |
Хемотаксис |
Хемотаксическая подвижность |
36 |
||
| che B (mot B) |
Хемотаксис |
Хемотаксическая подвижность |
36 |
||
| che C | Хемотаксис | Хемотаксическая подвижность | 37 | ||
| che | Хемотаксис | Хемотаксис | 65 | ||
| cyt R | Контроль активности генов udp и cdd | 128 | |||
| div A (wrk A) | Деление | Дефект в начале образования перегородок | 128 | ||
| (cm. env A) | div C (smo A) | Деление | Дефект в клеточной оболочке | 3 | |
| env A | Оболочка (envelope) | Аномальное клеточное деление, приводящее и образованию цепи | 2 | ||
| env B | Оболочка | Аномальное образование сфероидных клеток | (68) | ||
| fla AI, AII, AIII, B, C, D, E, K, L, N, P, Q |
Отсутствие определимого жгутикового вещества |
65 |
|||
| fla F | Жгутики | Отсутствие определимого жгутикового вещества | 47 | ||
| fla G | Жгутики | Жгутиковое вещество (флагеллин), но не жгутики | 65 | ||
| fla M | Отсутствие определимого жгутикового вещества | 65 | |||
| Неохарактеризованный мембранный дефект | 28 | ||||
| gts | H1 | H-антиген | Жгутиковый антиген, фаза I | 37 | 65 |
| hug | H2 | H-антиген | II фаза H антигена | 82 | |
| lon (cap R, dir, muc) |
Удлиненная форма (long) |
Нитевидный рост, радиочувствительность и регуляция синтеза капсульного полисахарида |
10 |
||
| lps | Липополисахарид | (см. rfa) | |||
| maf | Обеспечение автономного состояния полового фактора | 1 | |||
| min | Миниклетка | Образование мелких клеток, не содержащих ДНК | 10 | ||
| mot | Подвижность | Неподвижность жгутиков | 36 | ||
| mot A B | Подвижность | Сниженная подвижность жгутиков | 65 | ||
| mut L | Мутатор | Общая высокая мутабельность | 83 | ||
| mut S | Мутатор | Общая высокая мутабельность | 52 | ||
| mut T | Мутатор | Общая высокая мутабельность, специфическая индукция АТ-ЦГ-трансверзий | 2 | ||
| mut | Мутатор | Увеличенная частота мутаций | 136 | ||
| non | Не мукоидный | Блок в капсулообразовании | 39 | ||
| nml | N-метиллизин | N-метиллизин в жгутиковом белке | 65 | ||
| oaf A | Фактор О-антигена | О-фактор 5 (ацетильная группа) | |||
| oaf C | Фактор О-антигена | О-фактор 1 в группе E сальмонелл | 22 | ||
| oaf R | Фактор О-антигена | Синтез О-антигена 122 | 20 | ||
| pig | Пигмент | Коричневые колонии | 81 | ||
| pll (ftm) |
pit |
Ворсинки |
Наличие или отсутствие ворсинок |
88 |
23 |
| ptd D | Дефицит дипептидазы | 10 | |||
| ptd N | Дефицит в энзиме, гидролизующем аминокислотные B-нафтиламиды, ди- и трипептиды и аминокислотные амиды | 40 | |||
| ptd P | Дефицит в аминопептидазе P | 122 | |||
| rec | Рекомбинация | Дефицит рекомбинационной активности, сниженная деградация ДНК | 91 | ||
| rec A | rec A | Утрата способности к генетической рекомбинации и УФ-чувствительность | 51 | 92 | |
| rec B |
Рекомбинация |
Снижение способности к генетической рекомбинации и УФ-чувствительности; субъединица экзонуклеазы V |
54 |
||
| rec C |
Рекомбинация |
Снижение способности к генетической рекомбинации и УФ-чувствительность; субъединица экзонуклеазы V |
54 |
||
| rec F (uvr F) |
Рекомбинация |
УФ-чувствительность и компетентность к генетической рекомбинации |
73 |
||
| rec G | Рекомбинация | Компетентность к генетической рекомбинации | (74) | ||
| rec H | Рекомбинация | Компетентность к генетической рекомбинации | (52) | ||
| rfa (Lps) |
rfa E |
Шероховатый (rough) |
Дефект ядра липополисахарида; дефицит проксимальной гептозы |
(71) |
106 |
| rfa F | Шероховатый (rough) | Дефект ядра липополисахарида; дефицит дистальной гептозы | 116 | ||
| rfa G | Шероховатый (rough) | Дефект ядра липополисахарида; глюкозо-1-трансфераза | 116 | ||
| rfa H | Шероховатый (rough) | Дефект ядра липополисахарида галактозо-1-трансфераза | 122 | ||
| rfa J | Шероховатый (rough) | Дефект ядра липополисахарида; глюкозо-2-трансфераза | 116 | ||
| rfa K | Шероховатый (rough) | Дефект ядра липополисахарида; дефицит ацетилглюкозамина | 116 | ||
| rfa L | Шероховатый (rough) | Дефект ядра липополисахарида; O-транслоказа | 116 | ||
| rfa P | Шероховатый (rough) | Дефект ядра липополисахарида; фосфорилирование гептозы | 115 | ||
| rfb A | Шероховатый (rough) | Тимидиндифосфат (ТДФ) глюкозопирофосфорилаза | 65 | ||
| rib B (som) |
rfb B |
Шероховатый (rough) |
ТДФ-глюкозоокси доредуктаза |
39 |
65 |
| rfb D | Шероховатый (rough) | ТДФ-рамнозосинтетаза | 65 | ||
| rfb F | Шероховатый (rough) | Цитидиндифосфат (ЦДФ)глюкозопирофосфорилаза | 65 | ||
| rfb G | Шероховатый | ЦДФ-глюкозоокси доредуктаза | 65 | ||
| rfb H | Шероховатый | ЦДФ-абеквозосинтетаза | 65 | ||
| rfb K | Шероховатый | Фосфоманномутаза man-2 | 65 | ||
| rfb L | Шероховатый | Фосфоманномутаза B | 65 | ||
| rfb M | Шероховатый | Гуанидиндифосфат (ГДФ)маннозопирофосфоридаза man-2 | 65 | ||
| rfb T | Шероховатый | O-транслоказа | 66 | ||
| rfc (rou C) |
Шероховатый |
Неполимеризованная О-повторяющаяся единица |
51 |
||
| rfe | Шероховатый | Синтез белковых цепей полисахарида у S. minnesota, S. montovideo | 122 | ||
| rft | Шероховатый | "Транзитная" TI форма | 25 | ||
| rts (ts-9) |
Электрофоретическая подвижность 50S рибоеомальных субъединиц |
78 |
|||
| smo A | Гладкая морфология колоний у конститутивных гистидиновых мутантов | 3 | |||
| smo B | Гладкая морфология колоний у конститутивных гистидиновых мутантов | 0 | |||
| vh 2 | Контроль скорости фазовой вариации | 82 | |||
| via A | Vi-антиген | 69 | |||
| via B | Vi-антиген у S. typhosa | 137 | |||
| woi | Увеличенный урожай трансдуктантов his 01242 при использовании реципиента his W1824 | 125 | |||
| Гены супрессоры | |||||
| rac | Рекомбинационная активность | Супрессор для rec B и rec C мутантного фенотипа в мерозиготах | 34 | ||
| ram. | Рибосомальная двусмысленность | Неспецифическая супрессия всех нонсенсных кодонов; P-4а белок 30S рибосомальной субъединицы | 64 | ||
| rns C (su A) |
Рибонуклеаза |
Полярный супрессор; РНК эндонуклеаза A |
74 |
||
| sbc B | Супрессор для rec B, rec C; экзонуклеаза I | 38 | |||
| suf A | Супрессор сдвига рамки считывания, оказывающий эффект на пролил-т-РНК | 116 | |||
| suf B | То же | 73 | |||
| suf C | Супрессор сдвига рамки считывания | 45 | |||
| suf D | Супрессор сдвига рамки считывания, оказывающий эффект на глицил-т-РНК | 95 | |||
| suf E | Супрессор сдвига рамки считывания | 128 | |||
| suf F | Рецессивный супрессор сдвига рамки считывания | 19 | |||
| sul | Супрессор Ion мутации | 3 | |||
| sup A36 | См. gly T | ||||
| sup B (su B) |
Супрессор |
Супрессор охра мутаций (не идентичен sup L) |
15 |
||
| sup C (su C) |
sup C |
Супрессор |
Супрессор охра мутаций (возможно, идентичен sup O) |
26 |
51 |
| sup D (SU1, SU-1) |
sup D (sup W) |
Супрессор |
Супрессор амбер мутаций |
38 |
65 |
| sup E (su11) |
sup Y |
Супрессор | Супрессор амбер мутаций |
15 |
33 |
| sup F (su111, su-3) |
sup Z |
Супрессор |
Супрессор амбер мутаций; тирозил-т-РНК |
26 |
54 |
| sup G (su-5) |
Супрессор |
Супрессор охра мутаций |
16 |
||
| sup H | Супрессор | 38 | |||
| sup K (sup T) | Супрессор | Рецессивный УГА-супрессор | 95 | ||
| sup L | Супрессор | Супрессор охра мутаций | 16 | ||
| sup M (sup 15B) |
sup M |
Супрессор |
Супрессор охра мутаций; тирозил-т-РНК |
79 |
128 |
| sup N | Супрессор | Супрессор охра мутаций | 45 | ||
| sup O | Супрессор | Супрессор охра мутаций (возможно, идентичен sup C) | 26 | ||
| sup Q | sup Q | Супрессор | Супрессор нонсенсных и делеционных мутаций leu D | 13 | 10 |
| sup R | Супрессор | Amber-супрессор | 122 | ||
| sup S | Супрессор | УГА-супрессор | 122 | ||
| sup T | Супрессор | 55 | |||
| sup U (su-7) | Супрессор | Супрессор амбер мутаций; глутамин-т-РНК | (75) | ||
| sup V (su-8) | Супрессор | Супрессор охра мутаций | (75) | ||
| sup X (su leo 500) |
Супрессор |
Супрессор мутаций leu 500 |
52 |
||
Мутации, обусловленные воздействием мутагенных агентов, возникают в результате изменения последовательности нуклеотидов ДНК, проявлением чего является утрата или изменение функции полипептида, кодируемого данным геном, или изменение свойств регуляторных единиц бактериального генома (оператор, промотор). По "протяженности" различают генные и хромосомные мутации. Первые затрагивают один ген, вторые распространяются более чем на один ген. Хромосомные мутации возникают в результате выпадения большого числа нуклеотидов (делеций). Генные мутации чаще являются точечными, т. е. заключаются в замене, вставке или выпадении одной пары нуклеотидов ДНК. Различают простые и сложные замены азотистых оснований в ДНК - транзиции и трансверзии (см. Мутация).
Б. свойственны прямые и обратные мутации. Последние часто имеют супрессорный характер. Мутагенные действия на бактериальные клетки оказывают все известные мутагены. Наиболее часто применяемыми мутагенами в бактериологических генетических исследованиях являются ультрафиолетовые лучи, проникающая радиация, моно- и бифункциональные алкилирующие агенты, аналоги оснований и ряд других.
Исследования последних лет, осуществленные на Б., вскрыли наличие генетически детерминированных систем, обеспечивающих репарацию повреждений генетического материала (ДНК). Этими исследованиями начато новое направление в генетике и молекулярной биологии. Данные, полученные при изучении бактериальной репаративной активности, привели к пересмотру ряда представлений о механизмах действия мутагенных агентов, формировании, фиксации и фенотипическом выражении мутационных изменений.
Библиогр.: Анатомия бактерий, пер. с англ., под ред. Г. П. Калины, М., 1960; Иерусалимский Н. Д. Основы физиологии микробов, М., 1963, библиогр.; Метаболизм бактерий, пер. с англ., под ред. В. А. Шорина, М., 1963, библиогр.; Многотомное руководство по микробиологии, клинике и эпидемиологии инфекционных болезней, под ред. Н. Н. Жукова-Вережникова, т. 1, с. 58 и др., М., 1962; Пешков М. А. Цитология бактерий, М.-Л., 1955, библиогр.; он же, Сравнительная цитология сине-зеленых водорослей, бактерий и актиномицетов, М., 1966; Роуз Э. Химическая микробиология, пер. с англ., М., 1971, библиогр.; Станиславский Е. С. Бактериальные структуры и их антигенность, М., 1971, библиогр.; Bergey's manual of determinative bacteriology, ed. by R. E. Buchanan a. N. E. Gibbons, Baltimore, 1975, bibliogr.; Annual Review of Microbiology, v. 1-26, Stanford, 1957-1972; Bacteria, ed. by I. C. Gunsalus a. R. Y. Stanier, v. 1-5, N. Y.-L., 1960-1964; Helmstetter C. E. Sequence of bacterial reproduction, Ann. Rev. Microbiol., v. 23, p. 223, 1969, bibliogr.; Kaempfer R. a. Meselson M. Studies of ribosomal subunit exchange, Cold Spr. Harb. Symp. quant. Biol., v. 34, p. 209, 1969; Korn E. D. Cell membranes, structure and synthesis, Ann. Rev. Biochem., v. 38, p. 263, 1969; Nomure M. Bacterial ribosome, Bact. Rev., v. 34, p. 49, 1970; Osborn M. J. Structure and biosynthesis of the bacterial cell wall, Ann. Rev. Biochem., v. 38, p. 501, 1969; Replication of DNA in microorganisms, Cold Spr. Harb. Symp. quant. Biol., v. 33, 1968; Ryter A. Association of the nucleus and membrane of bacteria, Bact. Rev., v. 32, p. 39, 1969; Topley W. W. a. Wilson G. S. Principles of bacteriology and immunity, v. 1-2, Baltimore, 1964.
Генетика Б. - Браун В. Генетика бактерий, пер. с англ., М., 1968, библиогр.; Жакоб Ф. и Вольман Э. Пол и генетика бактерий, пер. с англ., М., 1962; Захаров И. А. и Квитко К. В. Генетика микроорганизмов, Л., 1967; Сборник методик по генетике микроорганизмов, под ред. Р. Клауса и У. Хейса, пер. с англ., М., 1970, библиогр.; Скавронская А. Г. Мутации у бактерий, М., 1967, библиогр.; Taylor A. Z. a. Trotter C. D. Linkage map of Escherichia coli strain K-12, Bact. Rev., v. 36, p. 504, 1972, bibliogr.; Curtiss R. Bacterial conjugation, Ann.Rev. Microbiol.,v. 23, p. 69, 1969; Hartman P. E., Hartman Z. a. Stahl R. Classification and mapping of spontaneous and induced mutations in the histidine operon of Salmonella, Advanc. Genet., v. 16, p. 1, 1971, bibliogr.; Proceedings of the 12-th international congress of genetics, v. 3, Tokyo, 1968; Sanderson K. E. Genetics of the Enterobacteriaceae, Advanc. Genet., v. 16, p. 35, 1971, bibliogr.
Источники:
- Большая медицинская энциклопедия. Том 2/Главный редактор академик Б. В. Петровский; издательство «Советская энциклопедия»; Москва, 1975.- 608 с. с илл., 8 л. вкл.
|
ПОИСК:
|
© Анна Козлова подборка материалов; Алексей Злыгостев оформление, разработка ПО 2001–2019
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'