АУТОАЛЛЕРГИЧЕСКИЕ БОЛЕЗНИ
Расстановка ударений: АУТОАЛЛЕРГИ`ЧЕСКИЕ БОЛЕ`ЗНИ
АУТОАЛЛЕРГИЧЕСКИЕ БОЛЕЗНИ (греч. autos сам + аллергия; син.: аутоиммунные, аутоагрессивные болезни) - группа заболеваний, основным механизмом развития к-рых является реакция аутоантител и сенсибилизированных лимфоцитов с собственными тканями. Практически все клетки и ткани человека при определенных условиях могут быть объектом повреждающего действия лимфоцитов и аутоантител; поэтому клинические симптомы А. б. чрезвычайно разнообразны и могут проявляться как органными, так и системными поражениями.
Возникновение учения об аутоаллергии (см.) как причине болезней связано с именем И. И. Мечникова. В 1900-1901 гг. И. И. Мечников и его ученики экспериментально доказали возможность продукции антител к белкам собственных клеток организма.
В 1904 г. Донат и Ландштейнер (J. Donath, K. Landsteiner) обнаружили в сыворотке крови больных пароксизмальной Холодовой гемоглобинурией антитела, специфически направленные против собственных эритроцитов. В 1908 г. Видаль, Абрами, Брюле (F. Widal, P. Abrami, M. Brulé) выявили аутогемолизины у больных приобретенной гемолитической анемией. С. С. Головин в 1904 г. высказал предположение об аутоиммунном патогенезе симпатической офтальмии. Особенно широкое распространение учение об аутоаллергии получило начиная с 40-50-х годов 20 в. При многих заболеваниях установлены аутоаллергические механизмы патогенеза. Следует, однако, строго разграничивать А. б., где эти механизмы считаются ведущими, и аутоаллергические синдромы, осложняющие болезни другого генеза. Типичными примерами последних являются постинфарктный синдром, симптоматическая аутоиммунная анемия при лимфолейкозе, острая дистрофия печени при инфекционном гепатите, аутоаллергические синдромы при ожогах и лучевой болезни.
Этиология. Ткани и клетки организма приобретают аутоаллергенные (аутоантигенные) свойства в результате повреждающего воздействия различных факторов окружающей среды. Эти повреждения приводят к высвобождению и попаданию в общий кровоток физиологически изолированных компонентов клеток и тканей или к изменению антигенных свойств белковых структур (см. Аутоаллергия, Аутоантигены). Повреждающими экзогенными факторами могут быть травма, инсоляция, охлаждение, инфекция бактериальная и особенно вирусная, поскольку именно вирусы обладают способностью проникать в клетки и резко изменять структуру внутриклеточного белка. Нек-рые лекарственные вещества, обладая тропизмом к определенным клеткам крови, становятся гаптенами (см.), входящими в состав аутоантигенов.
За последние годы получила подтверждение теория общих антигенных детерминант определенных штаммов микроорганизмов и тканей человека. Наличие таких детерминант приводит к сенсибилизации не только по отношению к микробам, но и но отношению к собственным тканям с последующим их повреждением.
Выделены штаммы стрептококка группы А, имеющие общие антигены с тканью сердца человека, а также нефритогенные штаммы стрептококка, колитогенные штаммы килечной палочки.
При многих А. б. этиологические факторы остаются до наст. времени неизвестными. А. б. чаще развиваются у женщин.
Патогенез. Можно выделить три пути развития А. б. Первый путь - образование в организме аутоаллергенов (освобождение изолированных антигенов - коллоид фолликулов щитовидной железы, миелин, антигены хрусталика, яичек; денатурация тканей при ожоге, лучевой болезни и др.; образование комплексных и промежуточных антигенов). В ответ на появление аутоаллергенов включаются иммунологические механизмы, направленные на инактивацию и удаление этих аутоаллергенов. Эти механизмы, будучи в своей основе защитными, в ряде случаев вызывают повреждение клеток и тканей. Такой механизм предполагается при тиреоидите Хасимото, орхите, энцефаломиелите.
Второй путь - дефекты в контроле за иммунологическими механизмами защиты организма - объясняет теория "запретного клона" по Бернету. В норме по отношению к антигенам собственных тканей существует иммунологическая толерантность (см. Толерантность иммунологическая) и развитие клонов лимфоидных клеток, к-рые могли бы участвовать в иммунологических реакциях с собственными тканями, либо заторможено, либо эти клоны элиминированы. При патологии в силу пока неизвестных причин возможно развитие такого клона, либо такой клон появляется в результате соматической мутации лимфоцита. Клетки такого клона начинают повреждать ткани организма по механизму "трансплантат против хозяина" (см. Несовместимость иммунологическая). В реализации такого пути развития А. б. придают большое значение генетическому фактору, считая, что благодаря генетическим нарушениям функционируют так наз. запретные клоны иммунокомпетентных клеток, продуцирующих аутоантитела. В качестве фактов, подтверждающих роль генетического фактора, приводятся случаи семейного ревматизма, обнаружение ревматоидного фактора у родственников больных ревматоидным артритом, антител к тиреоглобулину у родственников больных аутоиммунным тиреоидитом, единичные наблюдения системной красной волчанки и других аутоаллергических болезней у однояйцовых близнецов. Однако этих фактов еще не достаточно, чтобы с уверенностью отнести А. б. к группе генетических.
Третий путь развития А. б. - активация иммунологических механизмов против микрофлоры, имеющей общие антигены с антигенами макроорганизма. В процессе приспособления к существованию в макроорганизме у многих микробов появились антигены, общие с антигенами хозяина. Это тормозит включение иммунологических механизмов защиты против такой микрофлоры, т. к. по отношению к своим антигенам в организме существует иммунологическая толерантность и такие микробные антигены принимаются как свои. Однако в силу каких-то различий в строении общих антигенов все же происходит включение иммунологических механизмов защиты против микрофлоры, что одновременно ведет и к повреждению собственных тканей. Предполагают участие такого механизма в развитии ревматизма в связи с наличием общих антигенов у нек-рых штаммов стрептококка группы А и в ткани сердца, язвенного колита в связи с наличием общих антигенов в слизистой оболочке толстой кишки и у нек-рых штаммов E. coli, в нек-рых случаях инфекционно-аллергической формы бронхиальной астмы в связи с наличием общих антигенов в ткани легкого и у микрофлоры, вегетирующей в дыхательных путях.
Независимо от патогенетического пути развития А. б. повреждение тканей может вызываться четырьмя иммунологическими (аллергическими) механизмами. Из них три механизма химергические, т. е. связанные с действием аутоантител, и четвертый - китергический, или клеточный (см. Аллергия). Первый механизм повреждения связан с образованием аллергических антител типа реагинов, к-рые фиксируются на поверхности клеток и при соединении с аллергеном вызывают освобождение вазоактивных аминов. Последние вызывают нарушение микроциркуляции и другие повреждения. Второй механизм - цитотоксический. Образовавшиеся антитела соединяются с соответствующими клетками и оказывают на них цитотоксическое и цитолитическое действие двумя путями. Прямой путь реализуется через активацию всех компонентов комплемента. Непрямой путь включает участие в этом процессе нейтрофилов, к-рые освобождают повреждающие факторы. Третий механизм - токсическое действие иммунного комплекса антиген + антитело. Этот комплекс фиксируется в тканях, особенно в стенках кровеносных сосудов. Преципитат фиксирует и активирует комплемент. Это ведет к аккумуляции в данной ткани нейтрофилов, к-рые фагоцитируют комплекс и при этом выделяют гидролазы и другие факторы, вызывающие повреждение тканей. Четвертый механизм - аллергическая реакция замедленного типа. Все четыре механизма могут принимать участие в повреждении тканей, однако при различных А. б. действует преимущественно один из них. Участие первого механизма в развитии А. б. незначительно. Повреждающее действие цитотоксических аутоантител (второй механизм) наиболее четко демонстрируется при аутоаллергических болезнях крови, повреждающее действие иммунных комплексов - при узелковом периартериите, системной красной волчанке; клеточный механизм - при аутоаллергическом тиреоидите, симпатической офтальмии.
Фактором, способствующим развитию А. б., является нарушение функции желез внутренней секреции. Так, напр., при А. б. часто выявляется глюкокортикоидная недостаточность.
Патологическая анатомия аутоаллергических (аутоиммунных) процессов и болезней. Морфология аутоиммунных процессов и болезней представлена двумя категориями изменений, разных по своей иммунологической сущности. Первая, изучаемая общей иммуноморфологией, связана с напряженным (или извращенным) иммуногенезом и касается в основном нммунокомпетентной системы. Изменения второй категории относятся к области частной иммуноморфологии и представлены морфологией местных иммунологических реакций, совершающихся в сенсибилизированном организме, т. е. различными видами тканевой аллергии.
Иммуноморфологическое изучение аутоиммунных процессов и болезней основано на обязательном сопоставлении данных морфологического и иммунологического (функционального) исследований. Это значит, что морфология изменений в очаге иммунной реакции оценивается параллельно с помощью иммунологических (уровень антител и антигенов в крови, моче, лимфе) и морфологических показателей состояния иммунокомпетентной системы.
Для иммуноморфологнческого изучения аутоиммунных процессов и болезней используют три метода: 1) иммуногистохимический (иммунофлюоресцентный) метод в различных его модификациях с использованием сочетания люминесцирующих антител или антигенов с радиоактивными метками и "контрастирующими" маркерами и привлечением для этого количественной оценки специфической люминесценции (микрофлюориметрии); 2) микроскопический метод (световая, поляризационная, электронная микроскопия) в сочетании с гистохимическими реакциями; 3) иммунологический метод (выявление антигенов и антител в тканях и жидкостях организма). Ведущее место среди них занимает иммуногистохимический метод, к-рый служит не только для обнаружения иммунных комплексов, но и для их "расшифровки" (идентификация антигена, антитела, комплемента).
Морфология напряженного иммуногенеза при аутоиммунных процессах и болезнях довольно стереотипна, хотя и зависит от особенностей иммунологической ситуации и длительности антигенной стимуляции. Она представлена лимфоретикулярной гиперплазией и плазмоцитарно-макрофагальной трансформацией с накоплением клеток, богатых РНК (иммунобласты, пиронинофильные клетки, плазматические клетки) и полисахаридами (PAS-клетки, макрофаги и др.), прежде всего в органах иммунокомпетентной системы (гиперплазия лимф, узлов, селезенки и др.), что отражает процессы клеточной секреции иммуноглобулинов (антителообразование) и продукцию рециркулирующих сенсибилизированных лимфоцитов. Гиперпластические реакции с накоплением лимфо-ретикулярных элементов и плазмоцитарно-макрофагальной трансформацией при аутоиммунных процессах и болезнях, как правило, выходят за пределы лимфоидной ткани. Они ярко представлены в ретикулоэндотелиальной (ретикуло-гистиоцитарной) системе печени, легких, почек, рыхлой соединительной ткани и могут имитировать картины межуточного воспаления и продуктивных васкулитов (если руководствоваться формально-морфологическими признаками). Выражением напряженного иммуногенеза следует считать и нередко встречающийся миелоз внутренних органов. Процессы клеточной пролиферации, плазмоцитарно-макрофагальной трансформации и миелоидной метаплазии сопровождаются резкими нарушениями тканевого обмена, завершающимися в ряде случаев развитием тканевого диспротеиноза (накопление PAS-положительного материала в лимф. узлах, амилоидоз селезенки, почек и т. д.).
Морфология местного повреждения в связи с иммунологической реакцией определяется при аутоиммунных процессах и болезнях как природой антигена (перекрестно реагирующий, аутологичный), длительностью его циркуляции в крови, так и качеством иммунного комплекса (циркулирующий комплементсвязывающий или местнообразованный за счет структурного антигена ткани). При этом циркулирующие комплементсвязывающие иммунные комплексы способны обычно вызывать гиперергическое (иммунное) воспаление по типу немедленной аллергии, а местнообразуюгциеся иммунные комплексы, содержащие тканевой антиген, чаще ведут к развитию изменений по типу замедленной аллергии (см. Аллергия). Однако это лишь крайние морфологические выражения местных иммунологических реакций. Доказано, что при аутоиммунных процессах и болезнях, индуцированных антигеном с образованием циркулирующих в крови комплементсвязывающих иммунных комплексов, воспалительные сосудистые и тканевые изменения, завершающиеся фибриноидным некрозом, развиваются в связи с гистопатогенным действием этих комплексов, что находит подтверждение при иммунофлюоресцентном исследовании биопсий. При этом специфика развивающихся иммунных повреждений в значительной мере зависит от хим. структуры и величины иммунного комплекса. Напр., гистологические и гистохимические особенности волчаночных изменений (гематоксилиновые тельца, кариорексис, выщелачивание ядер, резкая пиронинофнлия и др.) связаны прежде всего с особенностью циркулирующего при волчанке иммунного комплекса, содержащего продукты распада клеточных ядер, нуклеопротеиды (антиген) и γG-глобулпны (антннуклеарные антитела). Специфика морфологических изменений при ревматоидном артрите также определяется особенностью аутологичного иммунного комплекса и местом его образования. Установлено, что плазматические клетки синовиальных оболочек при ревматоидном артрите вырабатывают аномальные аутоантигенные γG-глобулины, что ведет к появлению антител к этому глобулину (γМ-иммуноглобулины), образованию ревматоидного фактора, осаждению комплементсвязывающего крупномолекулярного иммунного комплекса и развитию воспалительно-некротических изменений. С парапротеиновой макромолекулярной природой иммунного комплекса связано развитие часто встречающегося при ревматоидном артрите амилоидоза.
При истинных аутоиммунных заболеваниях (болезнь Хасимото, идиопатическая аддисонова болезнь, энцефалопатия, полиневрит, множественный склероз, асперматогення и др.), индуцированных органоспецифическим аутологичным антигеном, преобладают клеточные тканевые реакции. Морфология гиперчувствительности замедленного типа в виде лимфо-гистиоцитарной и макрофагальной реакции становится в этих случаях доминирующей (лимфоцитарный тиреоидит как морфологическое выражение болезни Хасимото). Хрон. абактериальный гломерулонефрит, имеющий морфологию мембранозного или мембранозно-пролиферативного (мезангиально-мембранозного), может также рассматриваться как аутоиммунный, так как в развитии его важную роль играет структурный антиген базальной мембраны гломерулярного фильтра. При различных аутоиммунных процессах и болезнях нередки сочетания морфологии аллергии как немедленного, так и замедленного типа.
Классификация. В связи с тем, что многие проблемы этиологии и патогенеза А. б. еще недостаточно изучены, общепринятой их классификации не существует. В качестве рабочей может быть использована классификация В. И. Иоффе (1963), в к-рой предпринята попытка разделить все А. б. по характеру аутоантигенов и механизмам аллергического (иммунологического) процесса и показать степень участия аутоаллергического процесса в развитии заболевания.
Основным недостатком этой классификации является нечеткое и неполное для современного уровня знаний изложение механизма аутоаллергических процессов. По этой классификации первую группу составляют истинные аутоиммунные болезни. Сюда включены заболевания, вызванные нарушением физиологической изоляции антигенов, по отношению к к-рым в организме нет иммунологической толерантности. Роль же аутоантител, к-рые, как правило, удается выявить в сыворотке больных, неизвестна, т. к. тканевые изменения имеют характер аллергической реакции замедленного типа. К этой группе с известной долей вероятности можно отнести следующие болезни: симпатическую офтальмию (см.), аутоаллергический тиреоидит Хасимото (см. Хасимото болезнь), демиелинизирующие процессы - энцефаломиелит (см.), рассеянный склероз (см.), нек-рые формы полиневрита (см.), орхита (см.), идиопатическую аддисонову болезнь (см.).
Ко второй группе относятся приобретенная гемолитическая анемия (см.), тромбоцитопеническая пурпура (см. Пурпура тромбоцитопеническая) и коллагеновые болезни (см.). Антигены при этих заболеваниях не обладают органной специфичностью. Патогенез связан с нарушением гомеостатического контроля иммунологических механизмов. Несомненно, что не все А. б., включаемые в эту группу, имеют в своей основе нарушение гомеостаза иммуногенеза. Так, напр., группа коллагенозов включает ряд нозологических форм, по-видимому, с различным механизмом и различной степенью нарушения гомеостатических механизмов иммуногенеза. Наиболее доказательна его ведущая роль при системной красной волчанке (см.).
К третьей группе А. б. относятся гломерулонефрит (см.), гепатит (см.), агранулоцитоз (см.). Сюда включены болезни, при к-рых аутоантигенность тканей приобретается за счет повреждающего действия внешних факторов (микробов, вирусов, лекарств) с образованием комплексных и промежуточных аутоаллергенов. К этой группе можно отнести также ревматизм (см.) и вакцинальный энцефаломиелит (см.).
Более широкая классификация А. Д. Адо (1970) включает не только А. б., но и аутоаллергические реакции (табл.). В основу этой классификации положены представления о характере аутоаллергенов (аутоантигенов), участвующих в аутоаллергическом процессе, и о самых общих чертах его патогенеза. По патогенезу все аутоаллергические реакции разделены на две группы: 1) истинные, вызываемые активно образованными в организме аутоантителами и сенсибилизированными лимфоцитами; 2) ложные, вызываемые введением в организм готовых антител.
В иммунологических механизмах повреждения тканей участвуют все указанные выше четыре механизма. По характеру аутоаллергенов истинные аллергические болезни и реакции разделены на первичные и вторичные.
Диагностика. Клиническим выражением напряжения иммуногенеза является увеличение лимф, узлов и селезенки. Помимо типичных для каждой А. б. клинических признаков, большое значение для диагностики придается выявлению аутоантител в сыворотке больного. Последние могут быть выявлены различными, определенными для каждого заболевания тестами. При аутоаллергических гемолитических анемиях применяют прямой и непрямой тесты Кумбса (см. Кумбса реакция). Для выявления противотканевых аутоантител применяют реакцию связывания комплемента (см.), реакцию преципитации в геле но Оухтерлоню (см. Преципитация), реакцию пассивной гемагглютинации по Бойдену (см. Бойдена реакция). При нек-рых А. б. в сыворотке выявляются особые белки, по-видимому, имеющие отношение к аутоантителам, напр. ревматоидный фактор при ревматоидном артрите, волчаночный фактор при системной красной волчанке. Результатом действия противоядерных антител при последнем заболевании следует считать образование волчаночных (LE) клеток. Ориентировочное значение в диагностике имеет гипергаммаглобулинемия. Нередко, особенно в диагностике коллагенозов, применяется анализ материала биопсии тканей.
| Аллергены | Аутоаллергические болезни и реакции | |||
|---|---|---|---|---|
| истинные | ложные | |||
| первичные | вторичные | |||
| неинфекционные | инфекционные | |||
| Клетки собственных тканей и их продукты (сперма, миелин, тиреоглобулин и др.) | Эпидидимит, энцефаломиелит, тиреоидит Хасимото и др. | |||
| Продукты повреждения тканей, "глубинные" антигены клеток и пр. | Постинфарктный синдром | |||
| Антибиотики и другие лекарственные средства | Лекарственные тромбоцитопении, анемии и др. | |||
| ДНК, нуклеопротеиды, гистоны | Коллагенозы | |||
| Комплексные аллергены (клетки + микроб) | Ревматизм | |||
| Промежуточные антигены системы вирус-клетка | Вакцинальный энцефаломиелит, рассеянный склероз и др. | |||
| Гомо- и гетероаллергены | Гомо- и гетероцитотоксические реакции (нефрит, гепатит и др.) | |||
При многих А. б. можно получить положительную кожную аллергическую реакцию замедленного типа на соответствующий тканевой гомоантиген.
Однако широкого применения в клинической практике этот метод пока не получил.
Прогноз. Наиболее общей чертой большинства А. б. является их тяжелое прогрессирующее течение, приводящее к необратимым нарушениям функции соответствующего органа или системы. Исключение составляют нек-рые лекарственные гемопатии, имеющие благоприятный прогноз при отсутствии повторных контактов с соответствующими лекарствами. Введение в терапию А. б. кортикостероидов значительно продлило жизнь многих больных.
Принципы лечения. Практически при всех А. б. приходится прибегать к лечению кортикостероидными гормонами, к-рые действуют как на основной механизм развития болезни, подавляя продукцию аутоантител, так и на вторичные изменения благодаря противовоспалительному действию и замещению недостатка эндогенных кортикостероидов. Схемы лечения различны для каждого заболевания. Как правило, необходимо длительное лечение в сочетании со средствами, снижающими возможность развития побочных реакций. Благоприятные результаты достигнуты, в частности, при комбинированном лечении кортикостероидами в сочетании с производными хинолина (делагил, резохин и др.).
При установлении диагноза лекарственных гемопатий необходимо прекращение контакта с антигеном (гаптеном). При идиопатических формах гемолитической анемии и тромбоцитопении в ряде случаев показана спленэктомия.
В последние годы изучается вопрос лечения А. б. цитостатическими препаратами (новэмбихин, тиоТЭФ и др.) и иммунодепрессантами типа 6-меркаптопурина.
Профилактика. В связи с неясностью многих вопросов этиологии и патогенеза А. б. абсолютно действенных мер их профилактики пока нет. Предположительно можно говорить о профилактическом значении ограничения чрезмерных воздействий антигенных раздражителей, таких как вакцинация, лекарственная терапия, переливание крови, особенно в периоды наиболее лабильной реактивности организма.
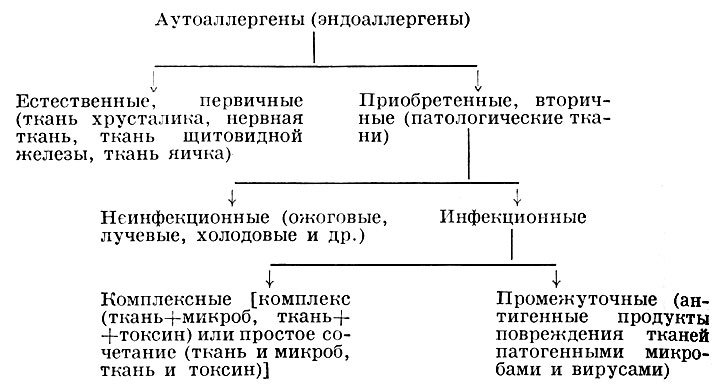
Схема классификации аутоаллергенов
Имеет значение также борьба с бытовым и производственным травматизмом, рациональное лечение хрон. общих и очаговых инфекций, ограничение инсоляции, предупреждение переохлаждения. Для профилактики А. б. особенно важна тщательная оценка реактивности организма при выборе момента плановых оперативных вмешательств, бальнео- и физиотерапии.
Библиогр.: Адо А. Д. Общая аллергология, М., 1970; Дыгин В. П. Аутоиммунные заболевания в клинике внутренних болезней, Л., 1970; Иммунопатология в клинике и эксперименте и проблема аутоантител, под ред. П. Мишера и К. О. Форлендера, пер. с нем., М., 1963; Иоффе В. И. Иммунопатология - проблема экспериментальной и клинической медицины, Вестн. АМН СССР, № 11, с. 3, 1963; Крайп Л. Клиническая иммунология и аллергия, пер. с англ., М., 1966; Лямперт И. М. Этиология, иммунология и иммунопатология ревматизма, М., 1972; Современные проблемы иммунологии и иммунопатологии, под ред. А. А. Смородинцева и др., Л., 1970; Струков А. И. и Бегларян А. П. Патологическая анатомия и патогенез коллагеновых болезней, М., 1963; Тареев Е. М. и др. Коллагенозы, М., 1965; Bendixen G. Classification of hypersensitivity in relation to clinical disease, Ann. intern. Med., v. 64, p. 668, 1966, bibliogr.
Патологическая анатомия аутоиммунных процессов и болезней - Вернет Ф. М. Клеточная иммунология, пер. с англ., М., 1971; Руководство по иммунологии, под ред. О. Е. Вязова и Ш. Х. Ходжаева, с. 43 и др., М., 1973; Серов В. В. и Зубжицкий Ю. Н. Принципы и возможности морфологического изучения иммунопатологических процессов, Арх. патол., т. 33, № 9, с. 3, 1971, библиогр.; Steffen C. Allgemeine und experimentelle Immunologie und Immunpathologie, Stuttgart, 1968.
Источники:
- Большая медицинская энциклопедия. Том 2/Главный редактор академик Б. В. Петровский; издательство «Советская энциклопедия»; Москва, 1975.- 608 с. с илл., 8 л. вкл.
|
ПОИСК:
|
© Анна Козлова подборка материалов; Алексей Злыгостев оформление, разработка ПО 2001–2019
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'