АТЕРОСКЛЕРОЗ
Расстановка ударений: АТЕРОСКЛЕРО`З
АТЕРОСКЛЕРОЗ.
Содержание
Атеросклероз (atherosclerosis, греч. athērē кашица + sklērōsis уплотнение, затвердение) - распространенное хрон. заболевание, характеризующееся специфическим поражением артерий эластического и мышечно-эластического типа в виде очагового разрастания в их стенках соединительной ткани в сочетании с липидной инфильтрацией внутренней оболочки, что приводит к органным или (и) общим расстройствам кровообращения. В зависимости от степени А. и его локализации в сосудистой системе формируются определенные клинические проявления, часть из к-рых выделяется в отдельные синдромы и даже нозологические формы (напр., ишемическая болезнь сердца).
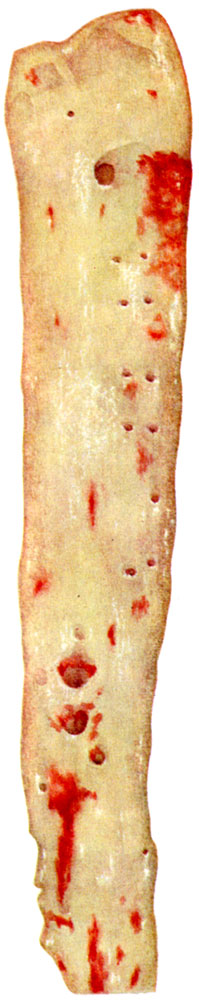
К ст. Атеросклероз. Рис. 1. Начальный липоидоз грудной и брюшной аорты (тотальное окрашивание Суданом III)
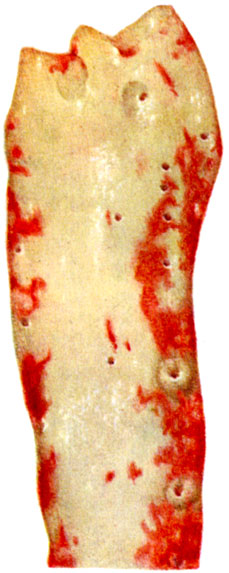
К ст. Атеросклероз. Рис. 1. Начальный липоидоз грудной и брюшной аорты (тотальное окрашивание Суданом III). Рис. 2-5. Разные типы атеросклеротических изменений в грудной аорте. Рис. 2. Отложение липидов во внутренней оболочке, образование первых фиброзных бляшек в области устьев задних межреберных артерий. Видны остатки ритмической структуры (тотальное окрашивание Суданом III)
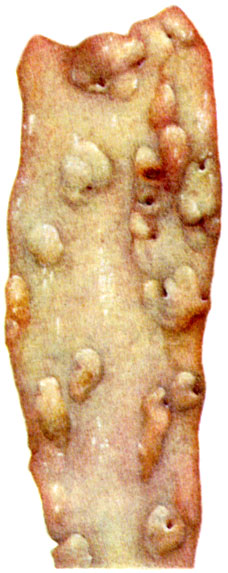
К ст. Атеросклероз. Рис. 2-5. Разные типы атеросклеротических изменений в грудной аорте. Рис. 2. Отложение липидов во внутренней оболочке, образование первых фиброзных бляшек в области устьев задних межреберных артерий. Видны остатки ритмической структуры (тотальное окрашивание Суданом III). Рис. 3. Фиброзные атеросклеротические бляшки (нативный препарат)
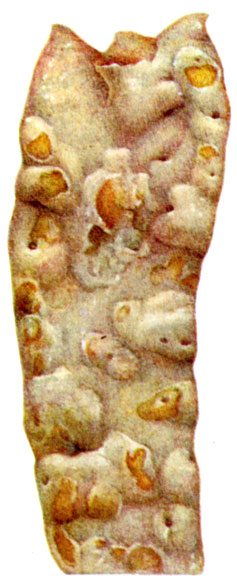
К ст. Атеросклероз. Рис. 2-5. Разные типы атеросклеротических изменений в грудной аорте. Рис. 4. Фиброзные атеросклеротические бляшки с отложени альция в виде пластинок на вершине бляшек (нативный препарат)
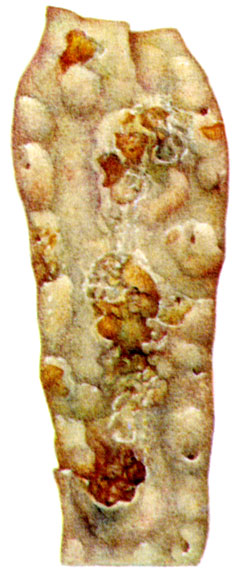
К ст. Атеросклероз. Рис. 2-5. Разные типы атеросклеротических изменений в грудной аорте. Рис. 5. Фиброзные бляшки с кальцинозом и изъязвлением (нативный препарат)

К ст. Атеросклероз. Рис. 6. Различные типы изменений в грудной и брюшной аорте с присоединившимся тромбозом (нативный препарат)
Заболевания, в основе к-рых лежит А., являются наиболее частыми причинами инвалидности и смертности в большинстве стран мира. Распространение А. в странах Европы и Сев. Америки значительно шире, чем во материалам вскрытий.
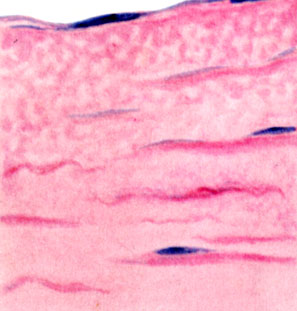
К ст. Атеросклероз. Рис. 1. Отек венечной артерии у юноши 18 лет (окраска гематоксилин - эозином)

К ст. Атеросклероз. Рис. 2. Фибринозная пленка на поверхности неизмененной внутренней оболочки венечной артерии у мужчины 32 лет (окраска трихромом по Массону)
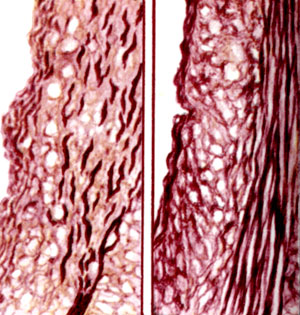
К ст. Атеросклероз. Рис. 3. Расщепление и фрагментация внутренней эластической мембраны в венечной артерии (слева) в области мышечно - эластического утолщения внутренней оболочки и в аорте (справа) в области ритмической структуры. Большое количество вновь образованных эластических волокон в утолщенной внутренней оболочке (окраска фукселином Вейгерта)
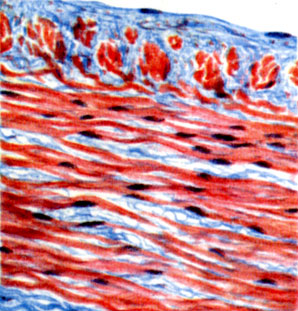
К ст. Атеросклероз. Рис. 4. Пролиферация гладких мышц с образованием продольного слоя (верхняя треть рисунка) во внутренней оболочке венечной артерии (окраска трихромом по Массону)
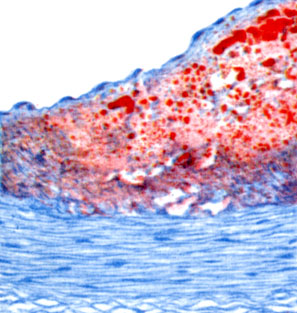
К ст. Атеросклероз. Рис. 5. Ожирение гладкомышечных волокон в области мышечно-эластического утолщения внутренней оболочки венечной артерии. Справа вверху и в центре - образование свободных капель Жира (окраска жировым красным О)
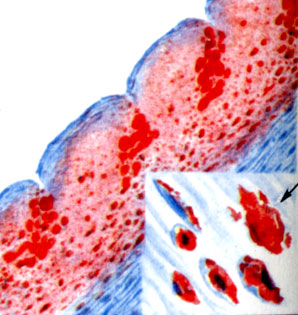
К ст. Атеросклероз. Рис. 6. То же, что и на рис. 5 в области ритмической структуры аорты. Справа внизу - разные стадии ожирения гладкомышечных волокон; стрелкой указана погибшая клетка с высвобождением жира (окраска жировым красным О)
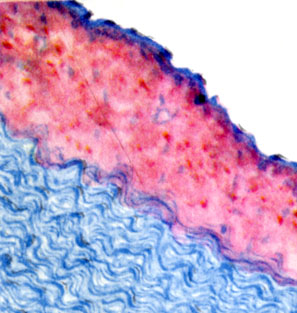
К ст. Атеросклероз. Рис. 7. Липидная бляшка в венечной артерии (окраска жировым красным О)
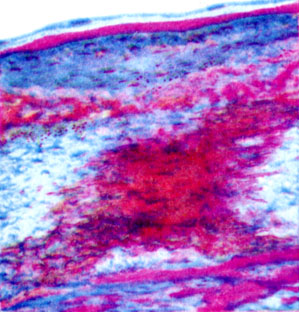
К ст. Атеросклероз. Рис. 8. Замурованные массы фибрина в покрышке атеросклеротической бляшки. Глубокие слои бляшки пропитаны богатой белком жидкостью (окраска трихромом по Массону)
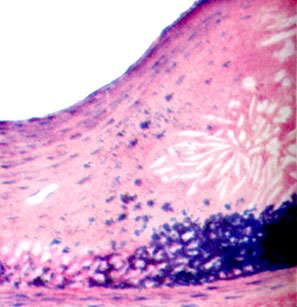
К ст. Атеросклероз. Рис. 9. Старая атеросклеротическая бляшка с кристаллами холестерина и атероматозом в центре и отложением солей кальция - справа внизу (окраска гематоксилин-эозином)
История
В 1755 г. Галлером (A. Haller) для обозначения очагов отложения жировых масс в стенке артерий был предложен термин "атерома", а в 1761 г. Морганьи (G. B. Morgagni) и позже Крювелье (J. Cruveilher, 1829) были описаны патологические изменения артерий в виде уплотнения их стенок. В 1833 г. Лобштейн (J. F. Lobstein) ввел понятие "артериосклероз", вкшее различные по своей этиологии и патогенезу процессы, общими для к-рых были склеротические изменения, утолщение и дезорганизация сосудистой стенки. В 1892 г. Вирхов (R. Virchow) предложил термин "endarteriitis deformans nodosa", подчеркнув этим воспалительную природу заболевания, вовлечение в процесс внутренней оболочки сосудистой стенки с деформацией последней и очаговый (узловой) характер процесса. Термин "атеросклероз" был предложен в 1904 г. Маршаном (F. Marchand). Этот термин получил широкое распространение, т. к. удачно подчеркивал свойственное заболеванию сочетание изменений в стенках артерий: отложение кашицевидных жировых масс и развитие соединительной ткани в стенке артерий. С введением этого термина, после появления первых эксперимента ных работ Н. Н. Аничкова и С. С. Халатова и последующих исследований Н. Н. Аничкова, произошло выделение А. в самостоятельную форму из собирательного понятия "артериосклероз".
Этиология и патогенез
На протяжении более 100 лет предлагались разнообразные теории развития А. Теория дискразии Рокитанского (К. Rokitansky, 1850), по к-рой первопричиной всех изменений являются отложения фибрина в сосудистой стенке и на ее поверхности, не получившая в середине 19 в. широкого распространения, была вновь выдвинута в 50-х годах 20 в. Дьюгидом (J. B. Duguid, 1946). Отдельные положения ее нашли подтверждение в работах многих авторов. Мейер (W. W. Meyer, 1949), Бредт (H. Bredt, 1969) и другие исследователи как бы возродили теорию Вирхова, признавая первичными при А. не нарушения липидного обмена, а ранние изменения сосудистой стенки. Липиды при этом рассматриваются не как причина, а лишь как индикаторы склеротического процесса в стенке артерий. Теория Тома (R. Thoma, 1886, 1923), рассматривающая А. как компенсаторно-репаративное явление в ответ на утрату артериями мышечного тонуса и эластических свойств, частично была поддержана И. В. Давыдовским, к-рый относит А. не к медицинским, а к биологическим проблемам возрастной инволюции организма. По И. В. Давыдовскому, А. - "проблема геронтологическая, широкого плана"; нозологическая сущность А. вообще отвергается, а вопросы его этиологии и патогенеза переносятся в раздел биологических проблем геронтологии. Большинство клиницистов эту концепцию не разделяет, поскольку обнаружение фиброзных бляшек у лиц моложе 15-20 лет вряд ли может расцениваться как проявление старения. Однако правомерность отождествления А. и липоидоза внутренней оболочки аорты у детей сама по себе подвергается сомнению (А. П. Авцын, 1972). Все же установлено, что на фоне общей тенденции к увеличению продолжительности жизни заболеваемость А. возросла и поражаются все более молодые контингенты населения, особенно мужского пола.
Среди концепций происхождения А. наибольшее признание еще недавно имела теория холестериновой инфильтрации, основывающаяся на экспериментальных исследованиях Н. Н. Аничкова и С. С. Халатова (1912) и последующих работах Н. Н. Аничкова и его школы. Было обнаружено, что скармливание в течение длительного времени кроликам больших доз холестерина приводит к развитию у них гиперхолестеринемии и массивному отложению холестерина и его эстеров в интиму аорты. Это рассматривалось как экспериментальный А. (см. Липоидозы) - модель заболевания, приближающаяся к А. у человека, поскольку ранее было показано, что липиды во внутренней оболочке артерий при этом заболевании в основном представлены холестерином и холестеринэстерами. Однако для получения холестериноза артерий у других животных, особенно всеядных (собаки, крысы), одного введения холестерина оказалось недостаточно. У человека облигатная связь между экзогенным холестерином, гиперхолестеринемией, с одной стороны, и выраженностью А., с другой, отсутствует. Другие варианты этой теории отводят решающее значение не экзогенному холестерину, а эндогенным нарушениям его синтеза и ассимиляции или увеличению отношения холестерин/фосфолипиды. Согласно инфильтрационной теории Пейджа (J. Page, 1954) при А. происходит нарушение прохождения липопро- теинов через сосудистую стенку, задержка их во внутренней оболочке с последующим высвобождением липидов, преимущественно холестерина. Причины этого явления: 1) изменение состава крови (гиперхолестеринемия), увеличение количества нек-рых липопротеинов; 2) нарушения проницаемости самой артериальной стенки.
Проникновение как больших, так и малых молекул через эндотелий артерии внутрь ее стенки происходит через межклеточные промежутки или щели, к-рые открываются при растяжении артерии во время систолы. В норме степень открытия щелей ограничивается межклеточными контактами и перемычками эндотелия, допускающими проникновение в неизмененную стенку артерий только кислорода, воды, электролитов, глюкозы, альбумина и нек-рых липопротеинов, необходимых для покрытия метаболических потребностей.
Электронномикроскопическое исследование эндотелия артерий при А. выявило значительное набухание и удлинение межклеточных перемычек, чрезмерное открытие межклеточных щелей, что приводит к увеличению фильтрации веществ из крови в стенку артерий и обусловливает проникновение через эндотелий крупных молекул и частиц, включая липопротеины, хиломикроны, лейкоциты. Если скорость фильтрации липидов превышает скорость их вымывания из артериальной стенки дренажными системами внутренней стенки, то формируется "атерома". При повышении внутрисосу- дистого давления не только увеличивается фильтрация липидов во внутреннюю оболочку, но и повышается вероятность нарушений дренажа за счет сдавления vasa vasorum при пе- рерастяжении артерии. Раскрытие межклеточных щелей может происходить также в результате шелушения и некроза эндотелиальных клеток при действии комплекса антиген - антитело, а также под влиянием аминов, кининов, различных ферментов и других факторов.
Новыми данными теории, в к-рой решающая патогенетическая роль отводится нарушениям обмена липидов, являются данные Фредриксона (D. S. Fredrickson, 1967) с соавт. о пяти типах гиперлипемии; из них второй - четвертый являются атерогенными. Распространению "липидной" теории А., по-видимому, способствовало два обстоятельства: возможность создания экспериментальной модели, формально отождествляющей А. с единственным патогенетическим фактором - экзогенной гиперхолестеринемией (что делает эту модель удобной для изучения), и доступность исследования в клинических условиях липидов крови как возможных факторов развития А. (по аналогии с экспериментальной моделью). В результате детально изучен обмен различных липидов, однако значение его нарушений для А. остается во многом неясным. Несмотря на появление за последние 50-60 лет огромного количества исследований, все же не удалось разработать не только универсальной, но даже более или менее приемлемой теории А. В наст, время более изучен гистогенез А., т. е. характер наблюдаемых морфологических изменений, время и последовательность их развития, тогда как этиология и патогенез этого заболевания остаются не вполне выясненными. Было принято считать, что А. - полиэтиологическое заболевание, т. е. целый ряд эндо- и экзогенных факторов способствует возникновению и развитию процесса. Однако сколько-нибудь убедительных доказательств того, что каждый из этих "этиологических" факторов в отдельности приводит к развитию А., нет. Это скорее "риск-факторы" в развитии А., способствующие его прогрессированию или возникновению клинических проявлений.
В наст. время считают, что в развитии А. играют роль следующие факторы.
1. Гиперхолестеринемия (см.), гиперлипемия (см. Липемия), к-рым придается ведущая роль в этиологии А. Однако патологоанатомические исследования не подтверждают коррелятивной связи между гиперхолестеринемией и выраженностью А. у человека, и имеется целый ряд данных, свидетельствующих против решающего значения этих факторов в развитии А. у человека: а) избыток экзогенного холестерина в большинстве случаев не приводит у человека к развитию гиперхолестеринемии; б) наличие гиперхолестеринемии не является облигатным для развития выраженного А.; в) известны случаи тяжелого А. у лиц с низким уровнем липидов, в т. ч. холестерина, в крови; г) если липоидоз артерий и первые фиброзные бляшки, обнаруживаемые в детском и юношеском возрасте, являются первым проявлением А., то придется считать, что подавляющее большинство детей и юношей страдает расстройствами липидного обмена. По-видимому, липоидоз артерий следует рассматривать как способствующее, но не облигатное условие.
2. Повышенное артериальное давление независимо от причины его повышения является фактором, усиливающим развитие А., что доказано на обширных патологоанатомических материалах. Усиление атеросклеротического процесса при артериальной гипертонии обусловлено не только изменениями в гемодинамике, но и повышенным накоплением в сосудистой стенке кислых муко- полисахаридов, преимущественно хондроитинсульфата B и C.
3. Гормональным факторам придается большое значение в развитии А. Принято считать, что сахарный диабет способствует его развитию, т. к. в клинике диабет часто сочетается с выраженным А. и при диабете имеются нарушения липидного обмена. Однако изучение аорты и венечных артерий лиц, умерших от "чистого" диабета, т. е. без сочетания с гипертонической болезнью или другими заболеваниями, влияющими на течение А., показало, что до 50 лет выраженность А. при диабете или находится в пределах, имеющих место у практически здоровых лиц, погибших от случайных причин, или лишь незначительно превосходит таковые. После 50 лет А. при диабете по своей тяжести не отличался от такового у лиц, умерших от А. и не страдавших диабетом. Это позволяет предположить, что у лиц молодого возраста диабет оказывает незначительное влияние на течение А., а в пожилом возрасте само возникновение диабета может быть обусловлено А. сосудов, питающих поджелудочную железу, т. е. диабет может быть вторичным по отношению к А. Однако многие вопросы взаимосвязи А. и диабета, в частности вопрос о влиянии на развитие А. противодиабетической терапии, требуют дополнительных исследований.
При повышенной функции щитовидной железы (гипертиреоз, тиреотоксикоз) клинические проявления А. обычно отсутствуют, а анатомически А. выражен значительно слабее. Гипотиреоз (эутиреоидный зоб, микседема), напротив, способствует развитию А., что используется в экс-периментальных исследованиях.
Большое значение придается половым гормонам. Если влияние андрогенов на развитие А. не вполне ясно, то эстрогены в эксперименте и у больных снижают гинерхолестеринемию, повышают коэффициент фосфолипиды/холестерин, уменьшают содержание в крови β-липопротеидов и тормозят развитие холестеринового А. у животных. Этим объясняют более позднее развитие А., особенно венечных артерий, У женщин и сглаживание различий в частоте поражения А. мужчин и женщин в старших возрастных группах (после менопаузы у женщин) или после кастрации.
Менее четкими являются данные о гормонах надпочечника; возможно их опосредованное влияние через повышение артериального давления (синдром Кушинга, болезнь Иценко-Кушинга, феохромоцитома). Известно также, что катехоламины приводят к высвобождению свободных жирных кислот из жировых Депо; иростагландин E1, напротив, подавляет этот эффект.
4. Социальные факторы играют большую роль в развитии А. Урбанизация населения и нарастание связанных с этим стрессорных и конфликтных ситуаций, нервно-психическое перенапряжение способствуют раннему возникновению и быстрому прогрессированию А., особенно в венечных артериях. Широкое распространение А., особенно в экономически развитых странах, связано, по-видимому, не с характером питания, а с возрастанием стрессорных влияний. Связь А. со стрессовыми факторами показана на примере Южной Кореи: у представителей беднейшего населения этой страны, наиболее пострадавшего от войны, на вскрытии постоянно обнаруживался А. (все же выраженный слабее, чем у европейцев), хотя основными продуктами их питания являются рис и капуста (мясо, масло и молоко употребляются редко).
Несомненно также, что для развития клинических проявлений А., особенно венечных и мозговых сосудов, имеют значение стрессорные ситуации, связанные с профессиональными условиями. Морфологически А. венечных сосудов выражен сильнее у лиц умственного, нежели физического труда, у жителей городов, нежели у сельского населения.
Для развития А. имеет значение и общая продолжительность жизни. В Шри Ланка, напр., средняя продолжительность жизни мужчин после ликвидации малярии возросла от 44 до 54 лет и одновременно заболеваемость и смертность от сердечно-сосудистых заболеваний увеличилась на 50%. Поэтому Стамлер (J. Stamler, 1961) относит А. к заболеваниям, являющимся следствием социальной эволюции.
5. Ожирение и малая физическая активность также усиливают анатомические и клинические проявления А. У лиц тучных, трудовая деятельность к-рых связана с низкой физической активностью, А. аорты и венечных артерий выражен значительно сильнее, и тяжелые клинические проявления А. встречаются у них в несколько раз чаще, нежели у лиц худощавых и физически активных.
6. Роль курения как этиологического фактора остается до сих пор неясной; в одних патологоанатомических исследованиях указывается на усиление А. венечных артерий у курильщиков, в других - эти данные не находят подтверждения. Возможно, влияние курения больше проявляется нарушениями регионарного кровотока, чем непосредственным атерогенным действием на сосудистую стенку.
В наст. время отсутствуют также какие-либо достоверные данные о влиянии количества и длительности приема алкоголя на атерогенез у человека, а экспериментальные данные противоречивы.
7. У представителей различных национальностей и этнических групп имеются значительные различия в течении А. Однако сравнительные исследования хим. состава аорты у новорожденных европейцев и банту, проведенные Майером (J. B. Meyer, 1966) с соавт., не выявили каких- либо различий. Липоидоз артерий выражен у различных национальностей примерно одинаково, однако время проявления и темпы развития фиброзных бляшек подвержены значительным колебаниям, и различия начинают проявляться уже со 2-3-й декады жизни. Возможно, это связано с влиянием различных факторов окружающей среды на реактивность сосудистой стенки. Эпидемиологические исследования А., проведенные на основании патологоанатомических данных, показали, что у лиц одних и тех же или сходных этнических групп, проживающих в различных географических зонах, имеют место значительные различия в выраженности А.; улиц различных этнических групп, проживающих в одной географической зоне ИЛИ в одном городе, выраженность и темп развития А. также различны. Т. о., по-видимому, и этнические факторы, и факторы окружающей среды оказывают влияние на развитие А., однако определить, что является решающим, при современном уровне знаний не представляется возможным.
8. Генетические, наследственные факторы также играют роль в патогенезе А., но они мало изучены. По-видимому, они имеют известное значение для развития заболевания в молодом возрасте, и особенно у мужчин.
9. Нарушение равновесия свертывающей и противосвертывающей систем крови, очевидно, также способствует прогрессированию А., поскольку фибриноген и фибрин являются постоянными компонентами бляшек.
Изложенные выше данные указывают на исключительную сложность проблемы патогенеза А. и на ведущее значение в нем нарушений артериальной стенки, способствующих накоплению в ней белковых субстанций, липоиротеннов, липидов с последующим развитием соединительной ткани. Причины этого явления остаются неизвестными. Отклонения в обмене липидов способствуют развитию процесса. Различные эндо- и экзогенные факторы могут ускорить или замедлить развитие А. В процессе возрастной инволюции вероятность интеграции отдельных вышеприведенных факторов увеличивается, что и определяет неуклонное прогрессирование А.
Патологическая анатомия
Макроскопически различают следующие виды атеросклеротических изменений (в порядке возрастания их тяжести и клинической значимости).
1. Жировые полоски или пятна - участки бледно-желтого цвета, к-рые не возвышаются над поверхностью внутренней оболочки, иногда сливаются друг с другом, содержат липиды, отчетливо выявляемые при тотальной окраске сосуда красками, выявляющими жиры, в частности Суданом (цветн. табл., рис. 1 и 2).
2. Фиброзные бляшки - беловатые, иногда как бы перламутровые или слегка желатинозного вида, возвышающиеся над поверхностью интимы, чаще всего овальные и округлые образования различной толщины и протяженности, сливающиеся друг с другом в сплошные поля, что придает внутренней поверхности сосуда неровный, бугристый вид (цветн. табл., рис. 2-4). Фиброзные бляшки в глубине содержат то или иное количество липидов.
3. Фиброзные бляшки с изъязвлением, кровоизлияниями и наложением тромботических масс (рис. 4, в, и цветн. табл., рис. 5 и 6).
4. Кальциноз или атерокальциноз - отложение подчас большого количества кальциевых солей в фиброзных бляшках (цветн. табл., рис. 4). Все эти изменения могут существовать одновременно в различных сочетаниях, придавая большую пестроту и вариабельность всей картине поражения, что особенно часто наблюдается в брюшной аорте у лиц старших возрастных групп.
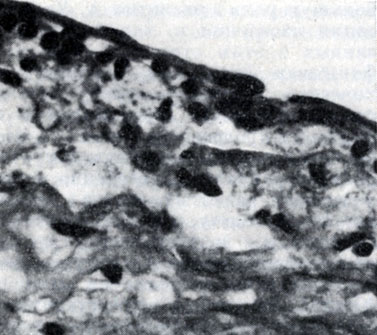
Рис. 1. Долипидная стадия атеросклероза аорты (окраска гематоксилин-эозином; ×500): а - отек интимы, клетки и волокнистые структуры разъединены отечной жидкостью (светлые участки)
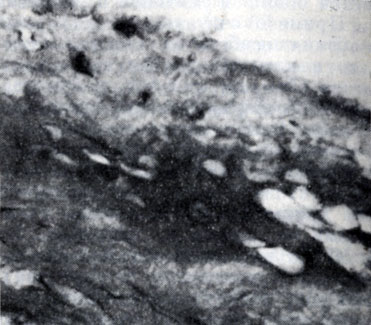
Рис. 1. Долипидная стадия атеросклероза аорты (окраска гематоксилин-эозином; ×500): б - отек и плазматическое пропитывание (на снимке более темные участки) фиброзной покрышки бляшки в аорте
Имеются определенные закономерности локализации первых проявлений А. Раньше всего атеросклеротические изменения в виде липидных пятен и полосок появляются на задней стенке грудной аорты, в месте отхождения межреберных артерий, несколько позже в брюшной аорте. Однако фиброзные бляшки раньше возникают в брюшной аорте, и количество их здесь быстро нарастает. Наиболее частой локализацией фиброзных бляшек является область бифуркации аорты, места отхождения артерий, область разветвлений, места перегибов, извитые участки сосудов (напр., изгиб внутренней сонной артерии, изгибы селезеночной артерии), участки выше места сужения (напр., выше коарктации аорты), места с неровностями внутренней оболочки (напр., участки сифилитического мезаортита). В этих участках сосудов могут быть различные нарушения гемодинамики (замедление кровотока, нарушения ламинарности потока крови, усиленное давление или удар крови о сосудистую стенку или неравномерное натяжение стенки сосуда в местах перегибов), а также нек-рые особенности в строении сосудистой стенки (утолщение эластического каркаса в области разветвлений и отхождения боковых ветвей).
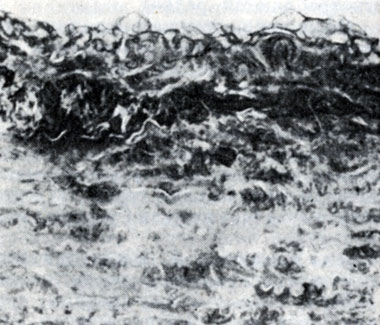
Рис. 2. Долипидная стадия атеросклероза аорты: а - накопление кислых мукополисахаридов (черного цвета) в глубине интимы (окраска по Хейлу; ×265)

Рис. 2. Долипидная стадия атеросклероза аорты: б - пристеночный тромб, состоящий в основном из тромбоцитов и фибрина (окраска трихромом по Массону; ×520)
Частым местом возникновения атеросклеротических бляшек являются также участки артериальной стенки, подвергающиеся постоянным внешним механическим воздействиям, напр. начальный отдел левой венечной артерии на стороне, прилежащей к сокращающемуся миокарду, или участки венечных артерий, перекрытые миокардиальными мостиками. В наст, время установлено, что при развитии А. липидной инфильтрации предшествует так наз. долипидная стадия процесса, к к-рой относится прежде всего очаговый, ограниченный отек интимы, встречающийся уже в юношеском возрасте; макроскопически он выглядит как полупрозрачный желатинозного вида участок овальной или округлой формы, нерезко контурированный, диаметром до 1 см, иногда располагающийся среди жировых пятен изолированно, иногда рядом с ними.
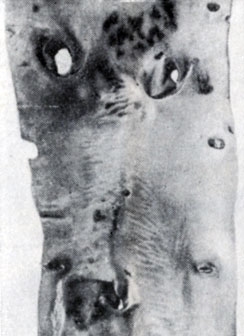
Рис. 3. Ритмические структуры аорты в начальной стадии атеросклероза, имеющие вид поперечных полосок, расположенных на ограниченных участках интимы (на рисунке справа внизу): а, - без отложения липидов в ритмической структуре)
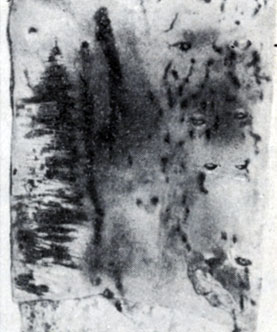
Рис. 3. Ритмические структуры аорты в начальной стадии атеросклероза, имеющие вид поперечных полосок, расположенных на ограниченных участках интимы (на рисунке справа внизу): б - отложение липидов в ритмическую структуру (на рисунке слева). Тотальная окраска Суданом IV
Микроскопически волокнистые структуры и клеточные элементы внутренней оболочки на ограниченном участке оказываются разъединенными жидкостью, богатой белком и содержащей белково-липидные комплексы (рис. 1 и цветн. табл., рис. 1). В дальнейшем распад белково-липидных соединений может привести к появлению небольших количеств свободных липидов. Эти наиболее ранние изменения И. В. Давыдовский рассматривал как следствие повышения проницаемости сосудистой стенки. Белки, входящие в состав отечной жидкости, могут выпадать в виде мелкозернистого преципитата; при более тяжелых изменениях видны выпавшие нити и хлопья фибрина. Количество кислых мукополисахаридов в основном веществе резко сокращается, они деполимеризуются. Коллагеновые и эластические волокна также оказываются вовлеченными в процесс; наблюдается их набухание, истончение, фрагментация, контуры их становятся неровными, размытыми. Изменяется способность эластических волокон давать флюоресценцию в УФ-лучах, они значительно легче подвергаются действию эластазы. На измененных эластических волокнах И. В. Давыдовский наблюдал также отложение плазменных белков. Как показали электронномикроскопические исследования, клеточные элементы, представленные во внутренней оболочке гл. обр. гладкомышечными клетками, в зоне отека могут не изменяться и лишь при значительной тяжести процесса (а возможно, большей длительности его) подвергаются гибели.
Другим проявлением долипидных изменений является усиленный синтез, накопление и полимеризация в интиме кислых, в основном сульфатированных, мукополисахаридных комплексов, что выявляется в виде очагов метахромазии основного вещества артерий (рис. 2, а). Последовательность этих двух процессов может быть различной, они, по-видимому, могут предшествовать один другому, возникать независимо друг от друга или одновременно. В наст, время установлено, что кислые мукополисахариды, особенно сульфатированные, легко соединяются с β-липопротеинами сыворотки, образуя с ними прочные комплексы, т. е. очаги накопления мукополисахаридов являются как бы зонами фиксации β-липопротеинов. Необходимо, однако, отметить, что в отношении накопления мукополисахаридов взгляды исследователей расходятся, и многие считают, что оно является вторичным по отношению к липои- дозу и что сами липиды могут связывать мукополисахариды.
К долипидным изменениям относятся также плоские пристеночные тромбы, возникающие в различных отделах артериальной системы и обнаруживаемые обычно лишь при микроскопическом исследовании на видимо неизмененной внутренней оболочке (цветн. табл., рис. 2). Тромбы могут состоять из одних тромбоцитов, одного фибрина или обоих этих компонентов (рис. 2, б). В наст, время установлено, что такие тромбы в норме постоянно образуются на поверхности внутренней оболочки у людей и животных, но, как правило, быстро подвергаются лизису. Однако иногда лизис задерживается, тромботические массы подвергаются эндотелизации, организации или гиалинизации и в дальнейшем дают начало образованию атеросклеротической бляшки.
Еще два вида изменений, к-рые хотя и не относятся в прямом смысле к долипидной стадии, имеют, по-видимому, большое значение в последующем развитии атеросклеротических изменений, особенно в венечных артериях сердца. Это, во-первых, мышечноэластическая гиперплазия внутренней оболочки артерий. В коронарных артериях она начинается уже в детском возрасте и заключается в расщеплении и фрагментации внутренней эластической мембраны и пролиферации гладких мышц через разрывы мембраны в интиму с образованием здесь продольного слоя (цветн. табл., рис. 3 и 4). Робертсон (J. H. Robertson, 1960) обнаружил эти изменения у плодов 14 нед. и старше, Док (W. Dock, 1946) - у новорожденных; липиды в измененных сосудах не содержались. Робертсон не относил эти изменения к патологическим, т. к. нет прямых доказательств перехода их в атеросклеротические бляшки, тогда как Фангмен и Хеллвиг (R. J. Fangman, C. A. Hellwig, 1947), Мун (H. D. Moon, 1957) рассматривали их как наиболее ранние проявления А., а Дауд (A. S. Daoud, 1964) с соавт. - как преатеросклеротические изменения. Последнее заключение является, по-видимому, более правильным, поскольку процесс имеет неравномерный по длине сосуда характер, в результате чего возникают своеобразные "подушки", по толщине превосходящие толщину подлежащей средней оболочки и являющиеся излюбленным местом возникновения в дальнейшем атеро-склеротических бляшек. Самые поверхностные отделы мышечно-эластических подушек состоят из тонких коллагеновых волокон. Во-вторых, к подобным изменениям относятся, возможно, так наз. ритмические структуры внутренней оболочки аорты, в основе к-рых также лежит очаговое, беспорядочное увеличение эластических структур на границе внутренней и средней оболочек с пролиферацией гладкомышечных элементов и отложением здесь в дальнейшем липидов в виде параллельных чередующихся полосок (цветн. табл., рис. 6), напоминающих следы прибоя на песчаном побережье, что, очевидно, обусловлено пульсовой волной движения крови (рис. 3).
В дальнейшем в этих местах возникают типичные атеросклеротические бляшки.
Липидная стадия А. заключается в появлении на интиме артерий небольших (0,5-1 см) пятен или полос желтоватого цвета, не возвышающихся над поверхностью внутренней оболочки (цветн. табл., рис. 1 и 2).

Рис. 4. Атеросклероз нисходящей части аорты (препарат тотально окрашен Суданом IV): а - небольшие поля липоидоза (черного цвета), располагающиеся преимущественно вблизи устьев артерий
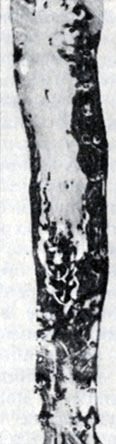
Рис. 4. Атеросклероз нисходящей части аорты (препарат тотально окрашен Суданом IV): б - площадь липоидоза (черного цвета) занимает около 60% поверхности интимы; другие виды атеросклеротических изменений отсутствуют
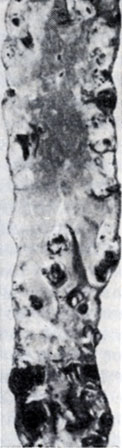
Рис. 4. Атеросклероз нисходящей части аорты (препарат тотально окрашен Суданом IV): в - часть атеросклеротических бляшек изъязвлена с кровоизлиянием и пристеночным тромбозом (участки черного цвета)
Первые липидные пятна появляются уже в раннем детском возрасте, их можно обнаружить примерно у 50% детей в возрасте до 1 года, а позднее почти у всех. Локализуются в это время они в зоне аортального кольца,в рубце на месте заросшего артериального протока и около устьев межреберных
Рис. 5. Липидная стадия атеросклероза аорты: б - распад гладкомышечных ксантомных клеток (в центре препарата) интимы с выходом липидов в межклеточное пространство (окраска жировым красным О; ×500)
артерий (рис. 4, а). В юношеском возрасте площадь, занятая липоидозом в аорте, значительно возрастает, распространяясь с грудной на брюшную аорту, где отдельные пятна могут сливаться друг с другом в сплошные поля и занимать до 60% площади интимы аорты (рис. 4, б); в это же время (после 10 лет) появляются первые липидные пятна в коронарных артериях.
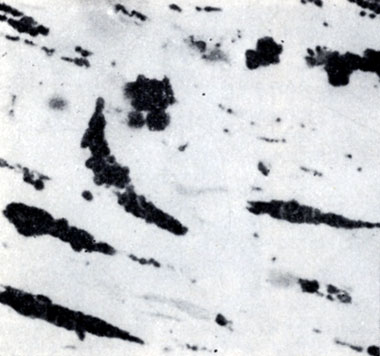
Рис. 5. Липидная стадия атеросклероза аорты: а - мышечные клетки интимы, содержащие большое количество липидных включений - клетки Лангханса (окраска жировым красным О; ×500)
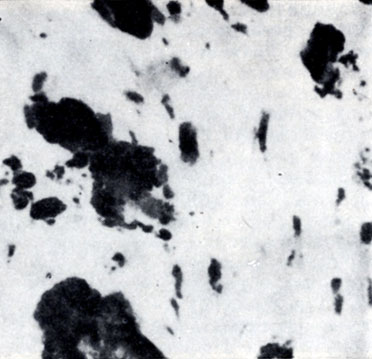
Рис. 5. Липидная стадия атеросклероза аорты: б - распад гладкомышечных ксантомных клеток (в центре препарата) интимы с выходом липидов в межклеточное пространство (окраска жировым красным О; ×500)
Микроскопически липоидоз представлен двумя процессами. Первый из них - появление липидов в цитоплазме клеток интимы, в так наз. клетках Лангханса (рис. 5, а). В наст. время установлено, что эти клетки имеют миогенное происхождение, при электронномикроскопическом исследовании они имеют клеточную базальную мембрану, а в цитоплазме их обнаруживаются миофиламенты, т. е. элементы, характерные для гладких мышц и отсутствующие у мононуклеарных клеток тканевой или гематогенной природы. Этим клеткам принадлежит основная роль в обеспечении структурной и функциональной сохранности сосудистой стенки; многие авторы считают, что именно они образуют коллагеновые и эластические волокна, синтезируют основное вещество сосудистой стенки и принимают активное участие в ее метаболизме, причем одним из важнейших энергетических механизмов является утилизация поступающих из крови β- липопротеинов. Количество липидных включений в цитоплазме гладкомышечных клеток может варьировать в широких пределах - от единичных небольших включений с зубчатыми контурами на электронограммах в начале процесса до полного заполнения тела клетки с образованием ксантомных клеток или, точнее, миогенных пенистых клеток (цветн. табл., рис. 5 и 6). Капли липидов достигают 2 мкм в диаметре; на электронограммах имеют вид вакуоли, окруженной двойной мембраной, или гомогенных включений, не имеющих мембран. Иногда капли липидов можно видеть также в цистернах эндоплазматического ретикулума. Последний имеет подчеркнутый рисунок, что может рассматриваться как проявление повышенной метаболической активности. В больших липидных пятнах наблюдается пропитывание интерцеллюлярных пространств жидкостью, содержащей альбумины плазмы, β-липопротеины, к-рые легко выявляются иммунофлюоресцентным методом. При тяжело протекающем процессе здесь обнаруживаются также нити и хлопья фибрина, располагающегося между перегруженными липидами клетками. В дальнейшем, если не устраняется причина, вызвавшая накопление липидов в миогенных клетках внутренней оболочки, последние погибают, и жировые массы переходят в окружающее межклеточное пространство (рис. 5, б, и цветн. табл., рис. 6).
Другой процесс липоидоза, определяемый микроскопически, - отложение свободных липидов (возможно, частично в виде липопротеинов) во внутреннюю оболочку артерий с диффузным пропитыванием и иногда как бы заболачиванием ее на большем протяжении (цветн. табл., рис. 7), что наблюдается в детском и юношеском возрасте.
По-видимому, этот ранний липоидоз является отражением особенностей обмена сосудистой стенки в этом возрасте, и, несомненно, имеются широкие возможности его обратного развития. Такой липоидоз является скорее физиологическим, нежели патологическим явлением. Кроме того, фиброзные бляшки всегда носят ограниченный характер, что также свидетельствует о том, что обширные поля липоидоза в основном подвергаются обратному развитию и лишь частично являются источником дальнейшего развития атеросклероза.
Эндотелий у человека, по-видимому, не играет значительной роли в образовании липидных пятен. Иногда в его цитоплазме видны отдельные липидные включения, но их появление можно рассматривать как следствие прохождения липидов крови в сосудистую стенку. В условиях же эксперимента (скармливание животным гидрогенизированного кокосового масла) Р. И. Соколова и В. И. Метелица уже в первые дни эксперимента наряду с изменением эластики наблюдали резкое набухание и вакуолизацию эндотелия аорты без отложения липидов (рис. 6), что, возможно, является отражением реакции эндотелия на повышенное содержание липидов в крови.
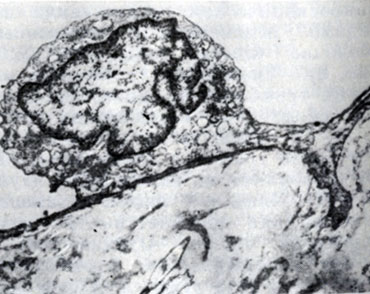
Рис. 6. Набухание эндотелия аорты кролика в первые дни воспроизведения экспериментального атеросклероза (скармливание животным гидрогенизированного кокосового масла). Электронограмма
Гистогенез фиброзной бляшки. Каждый из вышеописанных видов изменений (очаговый отек внутренней оболочки, пристеночный тромбоз, липидные пятна) в отдельности или в сочетании друг с другом может привести к образованию фиброзной бляшки. Очаговый отек внутренней оболочки, очевидно, может подвергнуться обратному развитию, не оставив после себя никаких следов. С другой стороны, тканевые структуры в этой области могут подвергнуться дезинтеграции. При этом метаболизм мышечных клеток нарушается (что приводит к накоплению в них липидов), на поверхность внутренней оболочки в этом месте из тока крови могут осесть тромбоциты и выпасть нити фибрина. Так начинается фибропластический процесс с последующим очаговым формированием соединительной ткани, в к-рой описанный цикл нарушений повторяется. В нек-рых бляшках можно обнаружить следы этих повторных нарушений, замурованные остатки фибрина (рис. 7 и цветн. табл., рис. 8). Организация пристеночных отложений фибрина также может быть основой для образования фиброзной бляшки, тем более что в подлежащих тканях при этом также имеют место метаболические нарушения в клетках и межуточном веществе интимы. Ограниченный отек стенки и пристеночный тромбоз могут существовать изолированно или сочетаться друг с другом, развиваясь в различной последовательности, а также сочетаться с липоидозом, что в еще большей степени способствует формированию фиброзных бляшек.

Рис. 7. Замурованные остатки фибрина (черного цвета) в поверхностных (а) и глубоких (б) слоях атеросклеротических бляшек аорты (окраска трихромом по Массону; а - ×200; б - ×80)
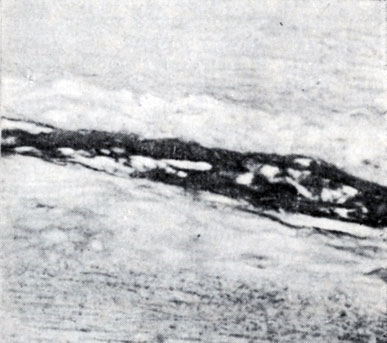
Рис. 7. Замурованные остатки фибрина (черного цвета) в поверхностных (а) и глубоких (б) слоях атеросклеротических бляшек аорты (окраска трихромом по Массону; а - ×200; б - ×80)
Прежнее безоговорочное признание липидных пятен единственным исходным видом изменений, принимающих участие в образовании фиброзных бляшек, в наст, время рядом авторов подвергается сомнению, а нек-рыми вообще отвергается. По-видимому, все же можно считать, что липидные пятна, во всяком случае часть из них, не подвергаются обратному развитию и превращаются в фиброзные бляшки. Избыточное накопление липидов в гладкомышечных клетках может быть связано с различными обстоятельствами: избыточное содержание липидов или необычный состав их в сыворотке крови, нарушенная способность клеток утилизировать поступившие липиды или комбинация этих факторов. Дальнейшее прогрессирование липоидоза обусловлено, по-видимому, тем, что причины, его вызвавшие, не были устранены и продолжают оказывать действие, или тем, что очаг липоидоза возник в зоне вышеописанных долипидных изменений. В пользу этого говорит уменьшение или полное исчезновение окислительных ферментов, малат- и пальмитатдегидрогеназы в зоне начальных липидных накоплений. Угнетение окислительных ферментов сопровождается также уменьшением АТФ-азной активности, связанной с транспортом, накоплением и, вероятно, метаболизмом липидов. Электронномикроскопические исследования показали, нто как только гладкомышечные клетки начинают накапливать липиды, наблюдается уменьшение АТФ-азы, связанной с мембранами, по сравнению с АТФ-азой, связанной с миозином, хотя последняя также оказывается сниженной. Уоттс (H. F. Watts, 1971) высказывает предположение, что АТФ-аза участвует в процессах активации жирных кислот перед их окислением; снижение ее активности нарушает этот процесс, что в свою очередь приводит к нарушению метаболизма миотонных клеток, и они теряют способность утилизировать поступающие жиры. Проводится аналогия между жировой дистрофией гладкомышечных клеток, наблюдаемой в миометрии или в узлах лейомиом, и накоплением жиров в миогенных клетках внутренней оболочки. В дальнейшем перегруженные липидами клетки погибают и липиды переходят в окружающие ткани, где они располагаются в основном веществе и вдоль эластических волокон. Высвободившиеся экстрацеллюлярные липиды, белки, особенно фибриноген, пропитывающий бляшку, выпавший фибрин оказывают фибробластическое, склерозирующее действие, выражающееся в инфильтрации этой области лимфоидными клетками, фибробластами, небольшим количеством полиморфных лейкоцитов, тканевыми и гематогенными моноцитами и в увеличении количества вначале аргирофильных, а затем коллагеновых волокон, что рано наблюдается на электронограммах как у человека, так и в эксперименте. Вокруг очага липоидоза возникает зона молодой соединительной ткани, богатой клеточными элементами, кислыми мукополисахаридами, вновь образованными сосудами, коллагеновыми и, в меньшем числе, эластическими волокнами, к-рая наползает на зону поражения, окружает ее, отделяет от просвета сосуда. Эластические волокна в бляшке представлены тонкими, беспорядочно разбросанными в ее толще волоконцами, ориентированными преимущественно вдоль продольной оси сосуда. Они легко подвергаются дистрофическим изменениям и распаду, что выражается в слабой и неравномерной окрашиваемости их, набухании, фрагментации, неровности контуров и т. д. Часто в поверхностных слоях бляшки количество эластических волокон особенно велико и они могут образовывать здесь сплошную полосу. Наличие неполноценных эластических волокон в бляшке способствует кальцификации ее (см. ниже). Коллагеновые волокна в бляшке также легко подвергаются дистрофическим изменениям, распаду и гиалинозу. Высвободившиеся липиды подвергаются вторичному фагоцитозу макрофагальными клетками и моноцитами и, по-видимому, частично через вновь образованные сосуды уносятся с током крови, т. е. имеют место явления делипидизации бляшки. По мере созревания соединительной ткани количество клеточных элементов сокращается, коллагеновые волокна становятся толще, гиалинизируются и возникает типичная фиброзная бляшка, состоящая из бедной клеточными элементами грубой соединительной ткани, часто гиалинизированной на большом протяжении, из эластических волокон и того или иного количества жировых масс с кристаллами холестерина в центре.
Атеросклеротические изменения на стадии фиброзной бляшки обратному развитию практически не подвергаются, поскольку процесс делипидизации не сопровождается уменьшением площади, занятой фиброзными бляшками. Однако последние становятся более плоскими, менее выступают в просвет сосуда, что имеет известное значение в улучшении гемодинамики. С другой стороны, в бляшках, в к-рых идет процесс рассасывания липидов, нередко наблюдается усиленное отложение солей кальция.
Развитие атеросклероза может временно остановиться, но чаще оно неуклонно прогрессирует, хотя скорость нарастания процесса может быть различной. Возникают новые бляшки, они сливаются в сплошные поля, в покрышку старых бляшек вновь могут откладываться липиды или она пропитывается богатой белком жидкостью, что приводит к новым изменениям. На поверхности фиброзных бляшек или в углублениях между ними оседают тромбоциты и выпадают массы фибрина, к-рые организуются, эндотелизируются, способствуя тем самым нарастанию процесса, придавая ему значительную пестроту. Известное значение в прогрессировании атеросклеротического процесса играют кровоизлияния из вновь образованных сосудов бляшки, часто имеющих строение тонкостенных синусоидов. Эти кровоизлияния возникают независимо от наличия дистрофических, атероматозных и язвенных изменений в бляшке. Следы их в виде отложений гемосидерина обнаруживаются в подавляющем большинстве фиброзных атеросклеротических бляшек даже у лиц молодого возраста. Являясь вторичными изменениями, кровоизлияния вместе с тем способствуют дальнейшему прогрессированию А., поскольку сопровождаются выходом в ткани липопротеинов и белков плазмы, в т. ч. фибриногена.
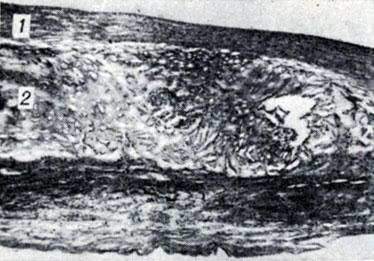
Рис. 8. Сформированная фиброзная бляшка аорты с хорошо выраженной фиброзной покрышкой-'шапочкой' (1),под которой располагаются атероматозные массы (2) (окраска гематоксилинэозином; ×25)
Если первоначально накопление липидов было обильным, то возможен атероматоз - в результате гибели липофагов и высвобождения большого количества липидов в окружающие ткани с некрозом их; образуется полость, заполненная жировыми массами и тканевым детритом, отделенная от просвета сосуда тонкой прослойкой соединительной ткани ("фиброзная шапочка", рис. 8). Гистохимический анализ липидов показывает, что они включают в себя фосфолипиды, располагающиеся обычно по периферии, эстерифицированный холестерин, кристаллы холестерина и в значительно меньших количествах свободные жирные кислоты, сфингомиелин, ненасыщенные эфиры триглицеридов, лецитин, цефалин, фосфоглицериды.
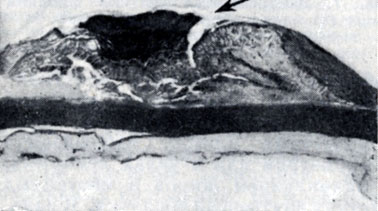
Рис. 9. Изъязвленная атероматозная бляшка аорты с пристеночным тромбозом (указано стрелкой). Окраска гематоксилин-эозином; ×45
Расстройства кровообращения в бляшках, распад липофагов и тканей, инфильтрированных жиром, некроз и секвестрация фиброзной покрышки приводят к изъязвлению бляшки с выпадением атероматозных масс в просвет сосуда, расслаиванием краев язвы кровью, обширными наложениями тромботических масс на язвенной поверхности (рис. 9 и цветн. табл., рис. 6), что иногда приводит к закрытию просвета сосуда. Попадание атероматозного детрита в ток крови приводит к эмболиям в дистальных отделах кровяного русла; в эмболических массах можно видеть кристаллы холестерина. Заживление язв происходит путем образования на их поверхности тонкой пленки фибрина, к-рая подвергается организации и эндотелизации с краев дефекта.
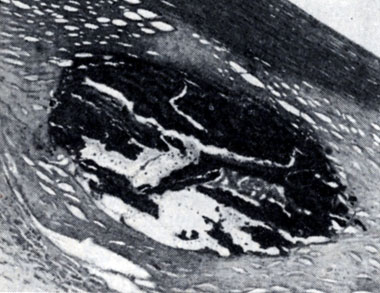
Рис. 10. Кальциноз аорты. Массивный очаг обызвествления в центре атеросклеротической бляшки под ее фиброзной покрышкой (окраска гематоксилин-эозином; ×95)
Кровоизлияния в бляшку, изъязвление ее, образование тромботических наложений - все это объединяется общим понятием "осложненные изменения" и свидетельствует о тяжелом, прогрессирующем течении А.
В гиалинизированные, дистрофические и некротические ткани, в жировой детрит, в участки измененных эластических волокон происходит отложении солей кальция. Можно выделить три типа кальциноза при А.
1. При наличии атероматозного распада обызвествление бляшек происходит по типу образования кристаллического очага, расположенного в основании бляшки, в месте формирования атеромы (рис. 10). При этом в мелкозернистой кашицеобразной массе, состоящей из белковых субстанций, кристаллов холестерина, капель нейтральных жиров и жирных кислот, появляются отложения извести, вначале в виде мелких крупинок, затем сливающихся в крупные конгломераты (цветн. табл., рис. 9). Кнаружи от этого очага откладываются соли кальция, связанные с органическим веществом сосудистой стенки, по-видимому, с мукополисахаридами. В нек-рых случаях отложения солей кальция в бляшке сливаются с таковыми в средней оболочке.
2. Отложение солей кальция в виде отдельных зерен или глыбок в области покрышки бляшки. По мере прогрессирования процесса здесь образуются сплошные отложения, к-рые имеют вид щитка или тонкой пластинки, лежащей на вершине бляшки.

Рис. 11. Изменения средней оболочки сосуда в области атеросклеротической бляшки; выраженная васкуляризация средней оболочки (2), склероз адвентиции с наличием лимфоидных инфильтратов (2) (окраска гематоксилин-эозином; ×52)
3. Диффузное пропитывание ткани мелкими пылинками или зернами солей кальция, располагающимися вдоль вновь образованных эластических волокон. При этом массивного очага кальциноза в основании или в покрышке бляшки не образуется. Отложение солей кальция в бляшке связано прежде всего с изменениями эластических волокон, входящих в ее состав. Набухание, фрагментация, разрушение эластических волокон в бляшке постоянно имеют место. Деструкция эластических волокон сопровождается высвобождением и накоплением в бляшке кислых сульфатированных мукополисахаридов (хондроитинсульфаты A и C), имеющих сродство к солям кальция и легко связывающих их. Кроме того, в молодых фиброзных бляшках вообще имеется большое количество кислых мукополисахаридов, что создает условия для отложения солей кальция. Дополнительным фактором является распад жировых веществ с высвобождением жирных кислот, к-рые связывают соли кальция с образованием нерастворимых кальциевых мыл. Способностью связывать кальций обладают также белки плазмы, и часть кальция находится здесь в связанном состоянии. При транссудации в бляшку белков плазмы последние, особенно фибриноген и выпадающий фибрин, также могут связывать кальций и инкрустироваться солями кальция. В частности, не исключена возможность, что образование "щитка" извести на поверхности бляшки связано не только с наличием здесь слоя эластических волокон, но и с пропитыванием тканей белками крови и с дистрофическими изменениями в покрышке бляшки и отложением солей кальция.
Кальциноз второго и третьего типа также, по-видимому, связан с нарушениями свойств эластических волокон, входящих в состав бляшки.
Фиброзные бляшки, осложненные изменения, кальциноз объединяются под общим названием "возвышающихся" изменений, в отличие "от чистого" липоидоза, при к-ром липидные пятна не выступают над поверхностью внутренней оболочки. Хотя при А. основные изменения развиваются во внутренней оболочке, средняя оболочка также вовлекается в процесс. Это происходит в силу целого ряда обстоятельств. Во-первых, раз возникшая фиброзная, а тем более кальцинированная бляшка оказывает чисто механическое давление на среднюю оболочку артерии; во-вторых, утолщенная, измененная интима является барьером на пути диффузии питательных веществ и кислорода, следствием чего является гипоксия средней оболочки. Адамсом (C. W. M. Adams, 1967) было показано, что это приводит к снижению активности тетразолиевой редуктазы, АТФ-азы и эстеразной активности в гладкомышечных элементах средней оболочки; наблюдающаяся одновременно возросшая активность лактатдегидрогеназы, как компенсаторное или адекватное гипоксии явление, имеет, по-видимому, незначительный эффект, поскольку не сопровождается усилением НАД-H2-редуктазной активности и не может играть значительной роли в транспорте электролитов; в-третьих, на среднюю оболочку распространяются явления неспецифического воспаления, она оказывается пронизанной вновь образованными сосудами и инфильтратами из лимфоидных, гистиоцитарных и фибробластических элементов (рис. 11). Все это вместе взятое приводит к атрофии и истончению средней оболочки, к разрушению ее эластического каркаса, развитию вместо него фиброзной ткани, неполноценной в функциональном отношении. Одновременно здесь наблюдаются обширные отложения извести по ходу разрушенных эластических пластин средней оболочки аорты или внутренней эластической мембраны артерий мышечного типа. В сосудах среднего и небольшого калибра (почечные, брыжеечные, коронарные, вне- и внутричерепные) массивные фиброзные бляшки приводят к сужению просвета, подчас очень значительному (рис. 12), с нарушением кровоснабжения соответствующих органов вплоть до полного выключения его с образованием ишемических инфарктов.
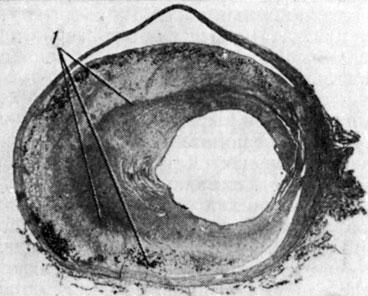
Рис. 12. Стенозирующая фиброзная бляшка коронарной артерии; на границе со средней оболочкой отложение солей кальция (2) (окраска гематоксилин-эозином; ×4,5)
Особенности поражения отдельных сосудов. Аорта в наибольшей степени поражается в брюшном отделе, хотя липоидоз в чистом виде раньше и в большем количестве появляется в грудной аорте. Это, по мнению ряда авторов, свидетельствует о том, что не все липидные пятна претерпевают в дальнейшем фиброзное превращение. Липоидоз в аорте обычно выражен значительно сильнее, нежели в других сосудах; площадь, занятая им, достигает в среднем к 30 годам жизни 20% поверхности интимы у мужчин и 30% - у женщин, тогда как в других сосудах не превышает 4-5% поверхности внутренней оболочки. Осложненные изменения, а также кальциноз возникают в брюшной аорте значительно раньше и достигают большей выраженности. Частота и особенно протяженность изъязвлений в аорте, особенно в брюшной, значительно большая, нежели в других артериях, напр. в коронарных и почечных, где этот вид изменений занимает очень небольшую площадь. В аорте в значительно большей степени, нежели в других сосудах, имеет место положительная корреляция между протяженностью и выраженностью изменений и возрастом.
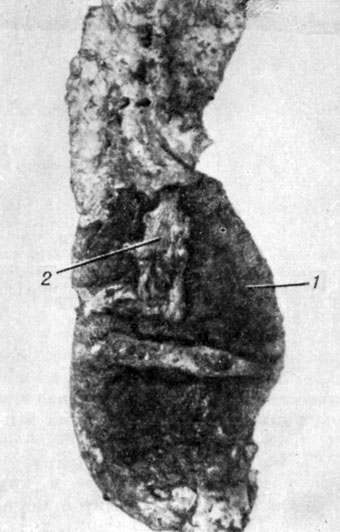
Рис. 13. Аневризма (2) брюшной аорты с тромбозом (2)
В результате разрушения эластического каркаса просвет аорты может расширяться, диффузно или на отдельных участках, с образованием аневризм различных размеров, иногда с разрывом последних в окружающую ткань (см. Аневризма аорты).
Нередко возникают обширные тромботические наложения на внутренней поверхности аневризмы (рис. 13). В области изъязвлений возможно проникновение крови между слоями сосудистой стенки с расслоением ее на значительном протяжении и развитием расслаивающих аневризм (см. Аневризма расслаивающая). В результате этих изменений длина, ширина, вес аорты с тяжелыми атеросклеротическими изменениями всегда больше, нежели неизмененной или мало измененной аорты. В возрасте 70-80 лет у 1-2% мужчин и 2-3% женщин атеросклеротические изменения в аорте отсутствуют или ограничиваются лишь липоидозом.
Коронарные артерии у различных людей поражаются чрезвычайно неравномерно. В одной и той же возрастной группе можно наблюдать неизмененные или мало измененные артерии и артерии с резко выраженными изменениями; поэтому корреляция с возрастом выражена значительно слабее, нежели в аорте. Мышечно-эластический слой в коронарных артериях очень развит, и, возможно, с этим связано раннее возникновение здесь атеро-склеротических изменений.
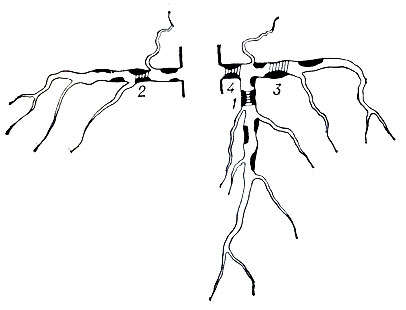
Рис. 14. Места наиболее частой локализации фиброзных бляшек (черного цвета) и участков тромбоза коронарных артерий (заштрихованы). Частота локализации тромбоза обозначена цифрами 1-4 (наибольшая - цифрой 1, наименьшая - 4)
Липоидоз в коронарных артериях обычно выражен слабо, и его площадь не превышает 3-4% поверхности внутренней оболочки; изъязвления также, как правило, занимают небольшую площадь (ок. 1% поверхности интимы). Напротив, кальциноз характерен для венечных сосудов и, по-видимому, играет значительную роль в развитии коронарной недостаточности. Кальциноз атеросклеротических бляшек является здесь преобладающим типом этого вида изменений, преимущественно протекает по первому типу и часто сочетается с кальцинозом внутренней эластической мембраны. Очаги кальциноза в отдельных бляшках прогрессируют, сливаются друг с другом в обширные поля, и подчас коронарная артерия на значительном протяжении превращается в плотную обызвествленную трубку. Из трех основных ветвей коронарных артерий атеросклеротические изменения раньше всего возникают и достигают наибольшего развития в передней межжелудочковой ветви левой коронарной артерии и в правой коронарной артерии (рис. 14), в огибающей ветви площадь поражения значительно меньше. Частота стенозов в трех основных ветвях коронарных артерий имеет прямую связь с выраженностью кальциноза: площадь кальциноза в передней межжелудочковой артерии в два раза превышает таковую в двух других артериях, и сужение просвета более чем на 50% наблюдается в этой артерии в два раза чаще, нежели в двух других ветвях. Если имеется неравномерное развитие артерий, то самые выраженные изменения наблюдаются в наиболее развитой артериальной ветви, т. е. в той, к-рая несет наибольшую функциональную нагрузку. Первые фиброзные бляшки обычно появляются в самых начальных отделах передней межжелудочковой артерии, в дальнейшем они наиболее выражены в начальной трети или половине артерии, где часто наблюдается циркулярное расположение сливающихся бляшек, простирающихся на значительном протяжении по длиннику сосуда, тогда как в дистальных отделах изменения обычно ограничиваются отдельными бляшками. Для коронарных артерий особенно характерно участие пристеночных отложений фибрина между бляшками в прогрессировании процесса. Тромбоз коронарных артерий, как показало изучение серийных срезов, обычно возникает на месте разрыва фиброзной покрышки атеросклеротической бляшки.
У лиц, умерших от коронарной недостаточности или перенесших инфаркт миокарда, А. артерий выражен значительно сильнее, нежели у лиц, не страдавших при жизни коронарной недостаточностью. Уже в возрасте до 40 лет у 100% лиц первой группы в коронарных артериях имеются возвышающиеся изменения, тогда как во второй группе даже в возрасте после 60 лет у 2-4% лиц изменения в коронарных артериях отсутствуют. Площадь возвышающихся изменений у последних примерно в два раза меньшая, а стеноз коронарных артерий с сужением более 50% просвета сосуда встречается в 9-10 раз реже, нежели у лиц первой группы. Имеется отчетливое различие в выраженности коронарного А. у лиц физического труда и у лиц, работа к-рых связана с малой физической активностью; у первых площадь возвышающихся изменений значительно меньшая, стенозы коронарных артерий, инфаркт миокарда и постинфарктные рубцы встречаются реже, чем у вторых. У лиц, страдающих ожирением, атеросклеротические изменения в коронарных артериях также выражены сильнее, чем у худощавых, однако влияние ожирения сказывается значительно слабее, нежели низкая физическая активность. У лиц, курящих табак в большом количестве, кальциноз при коронарном А. выражен сильнее.
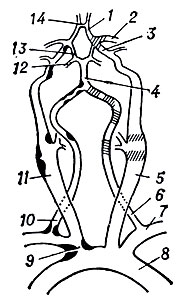
Рис. 15. Места наиболее частой локализации атеросклеротических изменений (черного цвета) и участков тромбоза (заштрихованы): 1 - передняя мозговая артерия; 2 - средняя мозговая артерия; 3 - внутренняя сонная артерия; 4 - базилярная артерия; 5 и 11 - общая сонная артерия; 6 и 10 - позвоночная артерия; 7 - подключичная артерия; 8 - дуга аорты; 9 - плече-головной ствол; 12 - задняя мозговая артерия; 13 - задняя соединительная артерия; 14 - передняя соединительная артерия
Сосуды головного мозга. Согласно данным А. Н. Колтовер с сотр., значительно чаще и тяжелее поражаются внечерепные отделы артерий, при этом в сонных артериях процент поражения в несколько раз выше, чем в позвоночных. Реже наблюдается А. сосудов основания мозга и крайне редко встречаются атеросклеротические изменения внутримозговых сосудов и сосудов конвекситальной поверхности мозга. Во внечерепных отделах сонных артерий (рис. 15) по площади атеросклероза первое место занимает синус внутренней сонной артерии, второе - общая сонная, третье - изгиб внутренней сонной артерии; ствол внутренней сонной артерии вовлекается в процесс крайне редко. Те же закономерности локализации отмечаются в частоте атеросклеротических стенозов. Из различных видов изменений преобладают фиброзные бляшки; окклюзия и осложненные поражения (атероматоз, кровоизлияния в бляшку, пристеночные тромбы) обнаруживаются в небольшом проценте случаев по сравнению со стенозами и, как правило, локализуются в синусе внутренней сонной артерии. Преимущественная локализация кальциноза - изгиб внутренней сонной артерии.
Для внечерепных отделов позвоночных артерий характерны изолированные стенозирующие бляшки в месте отхождения их от подключичных артерий. Значительно реже, приблизительно с равной частотой, поражаются ствол и сифон позвоночных артерий. Окклюзии (тромботические и нетромботические) во внечерепных отделах позвоночных артерий обнаруживаются редко, локализация их - изгиб, реже проксимальные отделы. Осложненные изменения (атероматоз и кровоизлияния в бляшку) встречаются в небольшом количестве случаев. Только во внечерепных отделах в небольшом проценте наблюдений (приблизительно с равной частотой в сонных и позвоночных артериях) выявляются относительно редкие формы патологии артерий - удлинение, извитость и перегибы под острым углом, к-рые, по мнению А. Н. Колтовер и Н. В. Верещагина, возникают в связи с возрастными .изменениями у лиц, страдающих гипертонией. Возможно, эти изменения связаны и с атеросклеротическим стенозом проксимальных отделов сосудов, с к-рым они нередко сочетаются. Их преимущественная локализация, в отличие от всех видов атеросклеротических изменений, в стволе внутренней сонной и позвоночной артерии перед входом в череп. В сосудах основания мозга А. выражен в значительно меньшей степени, чем во внечерепных. Чаще всего обнаруживаются изменения в виде изолированных фиброзных, иногда стенозирующих бляшек. Характерной является симметричность поражений парных артерий. Среди внутричерепных артерий чаще поражаются внутренние сонные артерии и базилярная артерия, второе место занимают поражения средних мозговых и позвоночных артерий, реже в процесс вовлекаются задние и передние артерии мозга. Во внутримозговых сосудах А. чаще всего встречается в артериях подкорковых узлов, таламусе и варолиевом мосту в виде фиброзных бляшек, реже липоидоза.
У лиц с нарушениями мозгового кровообращения степень и распространенность атеросклеротических изменений сосудов мозга выражены значительно сильнее. В процесс вовлекается большое количество сосудов, просвет к-рых нередко стенозируется множественными бляшками; значительно возрастает число осложненных изменений, а также тромбоз отдельных сосудов. Однако и в этих случаях отмечается большая вариабельность атеросклеротических изменений. Преобладают тяжелые поражения внечерепных отделов сонных и позвоночных артерий, нередко с образованием продолженных обтурирующих тромбов в сонных артериях. Среди сосудов основания мозга чаще страдают средние мозговые; базилярная и задние мозговые артерии поражаются реже.
Почечные артерии. В почечных артериях основные изменения возникают в области устьев. Основным типом изменений являются фиброзные бляшки; осложненные изменения и кальциноз встречаются редко, а площадь, занятая ими, обычно невелика. Зоны ветвления поражаются редко, распространение атеросклеротических изменений незначительное. Правая и левая артерии поражаются в одинаковой степени. Имеется прямая сильно выраженная корреляция между площадью атеросклеротических изменений в брюшной аорте и частотой стенозов основных артерий почек. У лиц, страдавших артериальной гипертензией, частота стенозов почечных артерий с сужением просвета на 70-75% является более высокой, чем среди лиц с нормальным артериальным давлением, т. е. коррелятивная связь между артериальной гипертензией и сужением почечных артерий является положительной и резко выраженной (коэффициент корреляции + 0,81). В дополнительных артериях почек (они встречаются примерно в 30% случаев) атеросклеротические изменения выражены слабее, а стенозы наблюдаются значительно реже.
Возрастная эволюция атеросклероза
Данные о возрастной эволюции могут быть получены лишь на основании изучения патологоанатомических материалов, т. к. никакие другие методы не дают возможности определить начало атеросклеротического процесса и его дальнейшую эволюцию. Данные, приводимые ниже, собраны в различных географических зонах СССР; они получены в результате изучения 10 тыс. аорт и коронарных артерий (А. М. Вихерт, В. С. Жданов и Е. Е. Матова, 1970).
В брюшной аорте атеросклеротические изменения имеются у всех умерших старше 10 лет независимо от возраста. В возрасте 10-19 лет примерно в 16% обнаруживаются фиброзные бляшки, а после 50 лет фиброзные бляшки в аорте встречаются в 95-99% случаев. Осложненные изменения и кальциноз в аорте мужчин появляются обычно в третьем десятилетии жизни, у женщин - начиная с четвертого десятилетия; после 60 лет эти виды изменений встречаются более чем в 50% наблюдений. Частота фиброзных бляшек, осложненных изменений и кальциноза в аорте женщин несколько меньше, чем у мужчин; у женщин в сосудах чаще наблюдается только липоидоз.
В венечных артериях у лиц в возрасте 10-29 лет атеросклеротические изменения обнаруживаются реже, чем в аорте,- примерно в 77% случаев, но фиброзные бляшки встречаются чаще, чем в аорте. После 40 лет у 1-2% умерших атеросклеротические изменения отсутствуют, у 5-7% лиц имеются лишь липидные пятна, у остальных - фиброзные бляшки. Кальциноз в венечных артериях встречается уже с третьего десятилетия жизни, осложненные изменения - с четвертого десятилетия. У мужчин старше 50 лет и женщин старше 60 лет кальциноз встречается более чем в половине наблюдений, частота осложненных изменений не превышает 25% . Как осложненные изменения, так и кальциноз в возрасте до 70 лет чаще встречаются у мужчин.
Общая площадь атеросклеротических изменений брюшной аорты, занимающая в возрасте 10-19 лет 12,4% поверхности внутренней оболочки у мужчин и 20,1% - у женщин, увеличивается до 72% (как у мужчин, так и у женщин) в возрасте 70-79 лет; в дальнейшем средняя площадь, занятая А., не увеличивается. Наибольшую площадь у лиц в возрасте до 40 лет занимают липидные пятна, после 40 лет - фиброзные бляшки.
Липидные пятна у лиц в возрасте 10-19 лет занимают 9,9% внутренней оболочки аорты у мужчин и 17,1% - у женщин. Площадь их у мужчин к 30-39 годам увеличивается до 20,2%, после чего начинает уменьшаться и к 80-89 годам составляет 2,9% поверхности внутренней оболочки. У женщин липидные пятна в аорте занимают наибольшую площадь в 20-29 лет (30,2%). Фиброзные бляшки в молодом возрасте (10-29 лет) занимают не более 2,5% поверхности внутренней оболочки аорты. После 30 лет площадь их увеличивается и к 70-79 годам достигает 52% внутренней оболочки как у мужчин, так и у женщин. Площадь осложненных изменений и кальциноза в молодом возрасте составляет не более 0,2-0,3% внутренней оболочки аорты. Площадь осложненных изменений с возрастом увеличивается у мужчин до 9,7%, у женщин - до 5,7% . Площадь кальциноза у мужчин достигает 10,6% внутренней оболочки, у женщин - 19,7%.
Общая площадь атеросклеротических изменений венечных артерий увеличивается с 2-3% поверхности внутренней оболочки у мужчин и женщин 10-19 лет до 60-62% в возрасте 80-89 лет. Преобладающим видом изменений в венечных артериях являются фиброзные бляшки, к-рые у мужчин старше 20 лет и женщин старше 30 лет занимают наибольшую площадь. Липидные пятна во всех возрастных группах занимают не более 3-4% внутренней оболочки. Площадь фиброзных бляшек увеличивается с каждым десятилетием жизни. В возрасте 10-19 лет они занимают у мужчин 1,2% внутренней оболочки, в 80-89 лет - 43,6%. У женщин до 70 лет фиброзные бляшки в венечных артериях занимают меньшую площадь, чем у мужчин. Площадь осложненных изменений мало меняется с возрастом и занимает не более 0,4% площади внутренней оболочки. Площадь кальциноза увеличивается с 0,2% в молодом возрасте до 14,9% у мужчин и 13,4% - у женщин после 80 лет.
Возрастная динамика и морфологические особенности А. обусловлены многими факторами, что находит свое выражение в чрезвычайно больших индивидуальных различиях в степени выраженности А. даже в однородной по возрасту и полу группе людей. Во всех группах имеет место прогрессирующее с возрастом развитие А. в изученных сосудах, однако темпы развития атеросклеротического процесса различны. Наиболее тяжелый А. наблюдается у лиц, страдавших гипертонической болезнью, ишемической болезнью сердца, у больных сахарным диабетом в возрасте старше 50 лет. Напр., практически здоровые люди, умершие на восьмом десятилетии жизни, имеют примерно такие же атеросклеротические изменения, как и умершие от проявлений А. в пятом-шестом десятилетии жизни. Наименее выражен А. у лиц, страдавших тиреотоксикозом, циррозами печени, хрон. пневмонией, хрон. туберкулезом легких. С увеличением возраста различия в выраженности А. между группами лиц, страдающих различными заболеваниями, уменьшаются. Обращают на себя внимание довольно значительные различия внутри изученных групп. Так, в группе лиц, умерших на восьмом десятилетии жизни, изменения легкой степени (площадь возвышающихся поражений занимает не более 15% поверхности внутренней оболочки в брюшной аорте) отмечались в 4,8% случаев, средней степени (площадь поражений равна 16-50%) - в 25,3% и тяжелой степени - в 69,9%; у практически здоровых людей эти изменения отмечались соответственно в 15,9; 39,1 и 45% случаев.
Приведенные материалы свидетельствуют, что возрастная динамика А. имеет весьма существенные различия; они обусловлены рядом факторов, в частности факторами, связанными с полом, трудовой деятельностью, состоянием питания, генетическими предпосылками. Значение возраста в развитии А. у человека весьма велико, но не может быть признано определяющим.
Изменения гемодинамики при атеросклерозе
Характер гемодинамических расстройств при А. определяется его локализацией, степенью и протяженностью поражения сосудистой системы. В стадии липидной инфильтрации внутренней оболочки артерий нарушения общей гемодинамики обычно отсутствуют, т. к. гидродинамические условия кровотока почти не изменены. Однако уже в этой стадии и в большей степени в период образования фиброзных бляшек за счет изменения реактивности пораженных сосудов могут наблюдаться преходящие артериальные спазмы, приводящие к ишемии соответствующих органов. Изменения сосудистой реактивности при А. (вплоть до парадоксальных ангиоспастических реакций на сосудорасширяющие физиологические и фармакологические воздействия) нередко определяют острые нарушения органного кровообращения и в более поздних стадиях болезни.
Периферическое сопротивление кровотоку в местах локализации фиброзных бляшек возрастает. Общее периферическое сопротивление при локальных поражениях даже крупных, напр. бедренных, артерий существенно не изменяется, однако оно может быть повышенным при распространенном А. с уплотнением артериальных стенок. Более частой причиной увеличения общего периферического сопротивления при А. является рефлекторное повышение тонуса мышечных артерий при локализации атеросклеротического поражения в аорте и сонных артериях (барорецепторные рефлексогенные зоны)и в связи с уменьшением минутного объема в фазе декоАшенсации сердца при А. венечных артерий. Оно увеличивается также при нефрогенной артериальной гипертензии, возникающей за счет повышения активности системы ренин-ангиотензин в случае атеросклеротического поражения почечных артерий.
Работа сердца возрастает при увеличении сопротивления кровотоку в аорте, а также при обусловленной А. артериальной гипертензии. Это приводит к гипертрофии левого сердца, обычно умеренной. При А. коронарных артерий сердца с крупноочаговым или очагово-диффузным склерозом миокарда сократительная деятельность желудочков сердца (гл. обр. левого) нарушается как за счет уменьшения массы сократительных волокон, так и за счет асинергии левожелудочкового сокращения (см. Ишемическая болезнь сердца). Вследствие этого изменяется фазовая структура сердечного цикла: удлиняются период напряжения, фазы асинхронного и изометрического сокращения, укорачивается период изгнания крови из левого желудочка; скорость повышения внутрижелудочкового давления часто снижается, а конечное диастолическое давление повышается. Кроме того, значительные нарушения общей гемодинамики могут развиться в связи с нарушениями сердечного рнтма при ишемическом повреждении центров автоматизма и проводящей системы сердца (см. Аритмии сердца, Блокада сердца).
Артериальное давление в центральных сосудах наиболее характерно изменяется при А. аорты. У здоровых людей эластичность аорты играет важную роль в формировании и систолического, и диастолического давления. Кинетическая энергия массы крови, выбрасываемой в аорту при систоле сердца, в связи с периферическим сопротивлением кровотоку частично расходуется на тепловой эффект и в значительной степени преобразовывается в потенциальную энергию давления; существенная часть энергии давления при систолическом растяжении аорты и крупных эластических артерий превращается в упругие силы натяжения артериальных стенок. Последний процесс, за вычетом нек-рых потерь энергии на образование тепла, обратим: в более длительный, чем систола, период диастолы давление в сосудистой системе создается энергией упругого сокращения растянутых стенок аорты, и ток крови в сосудах продолжается. При атеросклеротическом поражении аорты с ее уплотнением и уменьшением эластичности систолическая растяжимость стенок аорты резко снижается; вследствие этого уменьшается доля систолического давления, превращаемая в энергию упругого растяжения аорты, и величина систолического давления возрастает. Если сердечная мышца не поражена, то увеличение мощности сердечного сокращения, требуемое для преодоления дополнительного сопротивления в ригидной аорте, также способствует повышению систолического давления. Уменьшение упругих сил сокращения аорты в период диастолы приводит к снижению диастолического давления, иногда очень выраженному. т. о., изменения артериального давления при А. аорты характеризуются повышением систолического, снижением диастолического и, главное, значительным возрастанием пульсового давления (разницы между систолическим и диастолическим давлением).
У многих больных даже при выраженном поражении аорты диастолическое давление все-таки существенно не понижается и даже может быть несколько повышенным (оставаясь, однако, ниже 100 мм рт. ст.). В ряде случаев это достигается учащением числа сердечных сокращений и уко-рочением диастолы. Чаще сохранение нормальных значений и нек-рое повышение диастолического давления обусловлены рефлекторным повышением тонуса периферических артерий и увеличением вследствие этого общего периферического сопротивления. Однако, в отличие от условий с нормальной растяжимостью аорты, прирост периферического сопротивления кровотоку в большей степени сказывается на величине систолического давления, т. к. доля кинетической энергии сердечного выброса, преобразуемая в энергию давления, значительно возрастает, а переход энергии систолического давления в силы упругого растяжения аорты изменяется мало. Вследствие этого характерный для А. аорты рост пульсового давления остается достаточно выраженным и артериальная гипертензия носит преимущественно систолический характер.
Значительное повышение диастолического давления наблюдается редко и всегда требует тщательного исключения гипертонической болезни. Диастолическую гипертензию при А. могут обусловить следующие причины. 1. Нарушение функции барорецепторов синокаротидной и аортальной рефлексогенных зон при значительном атеросклеротическом поражении сонных артерий и грудной аорты. В сложной системе стабилизации уровня артериального давления эти рецепторы осуществляют функцию обратной связи, обеспечивая тем больший поток афферентной импульсации, тормозящей сосудодвигательный центр, и, следовательно, тем больший депрессорный эффект, чем больше давление, растягивающее стенки аорты и сонных артерий. Так, в эксперименте перерыв сигнализации от барорецепторов этих зон приводит к стойкому повышению артериального давления за счет повышения тонуса периферических артерий и роста общего периферического сопротивления кровотоку. 2. Нарушение функции сосудодвигательного центра за счет его ишемии при атеросклеротическом поражении мозговых артерий. 3. Хрон. ишемия почек при атеросклеротическом поражении почечных артерий. При этом развивается нефрогенная артериальная гипертензия типа Гольдблатта (см. Гипертензия артериальная).
Снижение упругих свойств аортальных стенок при А. обычно приводит к расширению аорты. Т. к. степень поражения по длине аорты неодинакова, то под влиянием кровяного давления возможны локальные ее расширения - аневризмы. Особенность геометрии восходящей аорты, стенки которой испытывают наибольший гемодинамический удар при систоле сердца, а также тенденция к большей степени поражения А. брюшной аорты обусловливают и более частую локализацию аневризмы в этих участках и большую клиническую значимость таких аневризм (см. Аневризма аорты).
Атеросклеротическое сужение просвета артерии приводит к снижению давления по длине пораженного сосуда, тем большему, чем больше степень сужения. При локализации атеросклеротических бляшек в подключичных, плечевых артериях или Деформирующем склерозе и уплотнении стенок этих сосудов, а также при сужении их просвета за счет аневризмы аорты величина давления, измеренного на плече, может значительно отличаться от величины давления в аорте. При этом нередко отмечается асимметрия величин давления на руках. В таких случаях большая из регистрируемых величин отражает величину центрального давления с меньшей погрешностью.
Регионарный кровоток нарушается особенно значительно при А. органных артерий. Дистальнее места атеросклеротической окклюзии уменьшается и линейная, и объемная скорость кровотока. По уравнению Пуазейля объемная скорость кровотока через сечение сосуда пропорциональна четвертой степени величины его радиуса. т. о., уменьшение радиуса сосуда в два раза при неизмененном перепаде давлений между аортой и капиллярами приводит к уменьшению объемной скорости кровотока в бассейне пораженной артерии в 16 раз. Отсюда можно ожидать, что снижение кровотока за счет фиброзных изменений интимы будет особенно значительным при атеросклеротическом поражении артерий малого калибра, в к-рых относительные изменения радиуса велики даже при малых размерах фиброзной бляшки. Фактическое снижение кровотока дистальнее атеросклеротической бляшки может быть даже большим, чем предусматривается уравнением Пуазейля, за счет изменения геометрии сечения сосуда на участке поражения. Это приводит к нарушениям ламинарности тока крови, образованию турбулентных завихрений и возрастанию потерь энергии кровотока на трение. К дополнительным потерям энергии на трение приводит также снижение эластических свойств пораженной артерии при склерозе стенок, что не учитывается уравнением Пуазейля.
При циркулярном расположении бляшек в артерии, а также при склеротическом уплотнении ее стенок утрачивается одна из важнейших функций сосуда - активное изменение просвета, регулирующее изменение притока крови в зависимости от потребностей органа.
Степень органных расстройств кровообращения не всегда пропорциональна степени атеросклеротической окклюзии приводящих артерий и существенно зависит от архитектоники артериальной сети соответствующих областей. Напр., широкое анастомозирование бассейнов внутренних сонных артерий между собой и с бассейнами позвоночных и наружных сонных артерий обеспечивает компенсацию мозгового кровообращения даже при значительном сужении просвета одной из внутренних сонных артерий. При медленном развитии атеросклеротического поражения возможно развитие коллатерального кровоснабжения ишемизированной зоны, что нередко имеет место, напр., при А. артерий конечностей. Наибольшие изменения кровообращения наблюдаются при А. артерий органов, в к-рых тип артериального кровоснабжения приближается к "конечному", т. е. при слабом развитии межартерпальных анастомозов, особенно если формирование бляшки происходит быстро.
Снижение скорости кровотока и нарушение структуры интимы артерий в зоне поражения являются основными предпосылками к тромбообразованию в случае повышения коагуляционных свойств крови (см. Тромбоз). Этим объясняется частота тромбоэмболических осложнений при А., приводящих к инфарктам органов и являющихся нередко непосредственной причиной смерти лиц, страдающих А.
Клиническая картина и диагностика атеросклероза различной локализации
По классификации, предложенной А. Л. Мясниковым (1955, 1960), в течении атеросклероза выделялось два периода: начальный (обозначенный как доклинический) и период клинических проявлений. Выделению первого из них придавалось принципиальное значение для разработки способов ранней диагностики А. и проведения своевременных лечебно-профилактических мероприятий. В качестве критериев для распознавания доклинического периода указывались нервно-сосудистые нарушения в виде наклонности к общим или регионарным артериальным спазмам, гиперхолестеринемия и изменение содержания фосфолипидов и липопротеидов с нарушением фракционного состава последних. Однако эти нарушения, как указывал А. Л. Мясников, "еще не говорят, конечно, о наличии А. и могут пройти, так и не приведя к атеросклеротическим изменениям". В периоде клинических проявлений различались три последовательные стадии: ишемическая (небольшие нарушения функции органов за счет обратимых дистрофических изменений в них, вызванных ишемией); некротическая, или тромбо-некротическая (характерны клинические симптомы, обусловленные очаговыми мелкими или крупными некрозами в органах, различные для разных локализаций А.), и фиброзная, проявляющаяся снижением функции пораженных органов за счет развития в них рубцовых изменений с атрофией паренхимы. Очевидно, что изложенные стадии характеризуют степень связанных с А. поражений органов, а не стадии развития А. как общей болезни, на что указывал и сам А. Л. Мясников.
По существу, классифицировались осложнения А. Однако других, лучших классификаций атеросклероза пока не предложено. В то же время известно, что степень органных нарушений не всегда соответствует степени атеросклеротического поражения соответствующих артерий; возможно развитие инфарктов в органах (некротическая стадия) при минимальном поражении приводящих артерий и без предшествующей ишемической стадии.
При подходе к А. как к заболеванию всего организма клиническую ценность представляет тот раздел классификации А. Л. Мясникова, в к-ром отражена, в соответствии со взглядами Б. Н. Аничкова, волнообразность анатомических изменений в сосудах - смена фаз накопления липидов в стенках сосудов и вымывания липидов. Соответственно этим процессам выделяются фаза прогрессирования А. (активная), фаза стабилизации А. (неактивная) и фаза регрессирования. Б. В. Ильинский (1956) установил, что гиперхолестеринемия и снижение лецитин-холестеринового коэффициента обычно совпадают с фазой морфологического прогрессирования болезни и с нарастанием клинических проявлений А. органных сосудов. Эти данные нашли подтверждение в последующих исследованиях, и в настоящее время возможна диагностика фаз А. по клиническим проявлениям и изменению уровня липидов и липопротеинов (в частности, β-липопротеинов).
Многие годы А. может протекать бессимптомно, и его прижизненная диагностика может быть лишь случайной (при ангиографии или операциях на сосудах, проводимых по поводу других заболеваний). В индивидуальных вариантах течения А. его клинические проявления в виде наклонности к артериальным спазмам далеко не всегда являются ранними и соответствующими начальному периоду поражения сосудов или периоду "пресклероза". Иногда клиника острых ишемических расстройств в органах проявляется поздно - уже на фоне значительного поражения артерий, к-рое могло быть установлено раньше инструментальными методами исследования. Это обстоятельство значительно повышает диагностическую роль инструментальных исследований (рентгенологических, сфигмографии, ЭКГ и др.).
В интересах ранней диагностики А., особенно при массовых профилактических осмотрах, периоды течения болезни целесообразно рассматривать в порядке повышения возможности и достоверности распознавания А. 1. Доклинический (бессимптомный) период: клинические проявления отсутствуют, инструментальные исследования сосудов патологии не выявляют. Содержание липидов в крови нормальное. Гиперхолестеринемия или повышение фракции β-липопротеинов в этот период должны расцениваться как показатели повышенного риска развития атеросклероза, обосновывающие необходимость наблюдения за соответствующими лицами и принятия мер индивидуальной профилактики. 2. Латентный клинический период. В этом периоде изменения физических свойств артерий или их гемодинамической функции выявляются только инструментальными методами исследования. Другие клинические признаки отсутствуют. Параллельное выявление нарушений липидного обмена повышает достоверность связи обнаруженного сосудистого поражения с А. 3. Период неспецифических клинических проявлений характеризуется симптомами преходящих ишемических расстройств в органах (ишемическая стадия по А. Л. Мясникову), такими же, как при гипертонической болезни или ангионеврозах (с к-рыми и проводится дифференциальная диагностика), но сочетающимися с признаками атеросклеротического поражения сосудов, выявляемыми инструментально, либо с устойчивыми характерными изменениями липидного обмена. Уже в этом периоде могут наблюдаться инфаркты в органах и очаговый склероз (фиброзная стадия по А. Л. Мясникову), к-рые также не строго специфичны для А. (наблюдаются при злокачественной артериальной гипертензии, эритремии, васкулитах), но А. является наиболее частой их причиной. 4. Период хронической артериальной окклюзии. Характеризуется обязательными ишемическими расстройствами в зонах сосудистого поражения при определенной общей физической нагрузке или функциональной на-грузке соответствующих органов: стенокардией напряжения (или ее эквивалентами) при коронарном А., перемежающейся хромотой при окклюзии сосудов конечностей, брюшной жабой при поражении брыжеечных артерий и т. д. В этом периоде фиброзные изменения в органах отмечаются часто, и диагностика А. не представляет особых затруднений, т. к. дифференциальный диагноз проводится гл. обр. только со значительно реже встречающимися васкулитами.
В зависимости от локализации А. (аорта, артерии сердца, мозга, почек, брыжейки, нижних конечностей) существуют различные клинические проявления в каждом из перечисленных периодов.
Атеросклероз венечных артерий сердца
В латентный период коронарный А. выявляется лишь в части случаев методами измерения объема коронарного кровотока, напр. с помощью радиоциркулографии (см.) или по относительному уменьшению прироста коронарного кровотока в ответ на физическую нагрузку. Для косвенной оценки последнего обычно используется электрокардиография (см.) с дозированной физической нагрузкой на велоэргометре или тредбане. О недостаточности кровоснабжения отдельных участков миокарда при нагрузке судят по нарушениям процессов электрической реполяризации миокарда, отражающихся смещением сегмента S-T и изменениями зубца Т в соответствующих отведениях ЭКГ. Начальным клиническим проявлениям соответствуют чаще всего приступы стенокардии (см.), периодические нарушения ритма или проводимости в связи с ишемией миокарда, центров автоматизма или проводящей системы сердца (см. Аритмии сердца, Блокада сердца). Начиная с этого периода формируется клиника ишемической болезни сердца (см.) с характерными для нее клиническими проявлениями (см. Инфаркт миокарда, Кардиосклероз). Для уточнения наличия, локализации и степени атеросклеротического поражения коронарных артерий применяется коронарография (см.).
Атеросклероз аорты
В то время как по секционным данным атеросклеротические изменения в аорте регистрируются, как правило, со второго десятилетия жизни, начальные клинические проявления появляются нередко только к шестому или седьмому десятилетию. Однако изменения физических свойств пораженной аорты (латентный клинический период) наступают значительно раньше. Если учесть, что аорта поражается чаще других артерий, эти изменения представляют наибольшие возможности для ранней инструментальной диагностики А. при массовых обследованиях.
Наиболее показательно для атеросклероза аорты увеличение скорости распространения пульсовой волны в аорте до 12-20 м/сек, к-рое тем больше, чем больше по длине аорты выражено уплотнение ее стенок. При гипертонической болезни без А. скорость распространения пульсовой волны увеличивается незначительно, что может служить дифференциально-диагностическим признаком. Характерны изменения сфигмограммы: быстрый подъем, заостренная вершина, крутой спуск с уменьшением амплитуды дополнительных волн на катакроте. Позже отмечается рост пульсового давления (разницы между систолическим и диастолическим давлением). Рентгенологическое исследование может быть малоинформативным даже в период выраженных клинических проявлений, однако чаще уже в латентном периоде отмечается удлинение аортальной дуги; рентгенокимография выявляет неравномерность амплитуды колебаний аортальной стенки и деформацию зубцов, "немые зоны" на участках резкого склероза стенок и их обызвествления. Очаговый кальциноз дуги аорты, трудно распознаваемый с помощью перечисленных методик, может быть обнаружен специальным рентгенологическим исследованием с применением рентгенотелевидения (см. Телевидение в медицине).
В период явных клинических проявлений симптомы А. аорты обусловлены локализацией атеросклеротического процесса по длине сосуда.
Атеросклероз грудной аорты. Жалобы больных часто отсутствуют или обусловлены сопутствующим атеросклеротическим поражением артерий сердца, мозга. Нек-рую специфичность имеет аорталгия - давящие или жгучие боли за грудиной, иррадиирующие в обе руки, шею, спину, верхнюю часть живота. В отличие от грудной жабы, эти боли не имеют четкого приступообразного характера, продолжаются часами и даже сутками, периодически ослабевая и усиливаясь, нередко сочетаются с парестезиями в руках.
Происхождение аорталгии связывают с раздражением нервных окончаний Е стенке измененной аорты или раздражением параортальных нервных сплетений при перерастяжении аортальных стенок. Не исключено, что в части случаев боли связаны с нарушением коронарного кровообращения. При сужении фиброзными бляшками устьев межре- берных артерий могут отмечаться боли в спине и по периметру грудной клетки, сходные с межреберной невралгией.
В случае значительного расширения аортальной дуги возможно появление затрудненного глотания в связи со сдавлением пищевода. Если отмечается охриплость голоса (сдавление возвратного нерва) или анизокорня, необходимо исключить аневризму аорты (см.). Редко возникают жалобы, характерные для так наз. синдрома дуги аорты (см. Такаясу синдром), - головокружения, ортостатические синкопы, преходящие гемипарезы, иногда эпилептиформные судороги при резком повороте головы.
Если расширение аорты значительно, то при объективном исследовании выявляется расширение зоны перкуторного притупления на уровне II межреберья вправо от грудины на 1-3 см. Важным симптомом является так наз. ретростернальная пульсация, обусловленная удлинением и высоким стоянием дуги пораженной аорты. Очень редко наблюдается пульсация межреберий справа от грудины. Перкуссия сердца может выявить небольшое смещение его границ и нек-рое усиление верхушечного толчка за счет умеренной гипертрофии левого желудочка; большее расширение может быть за счет дилатации сердца при одновременном поражении венечных артерий с развитием кардиосклероза.
При аускультации над аортой нередко выслушивается систолический шум, происхождение к-рого связано с образованием пристеночных завихрений крови в связи с ригидностью и недостаточным расширением аорты в период систолы, неровностями внутренней ее поверхности в местах расположения бляшек, а в части случаев и со склеротическими изменениями полулунных заслонок аортального клапана. Условия для систолического завихрения крови появляются и при значительном расширении аорты. Систолический шум обычно усиливается, если больной поднимает руки и отклоняет голову назад (прием Сиротинина-Куковерова), а также после физической нагрузки. Второй сердечный тон над аортой часто усилен, акцентирован, иногда имеет металлический оттенок, к-рый появляется при обызвествлении полулунных заслонок аортального клапана.
По мере прогрессирования А. по длине аорты растет систолическое и пульсовое артериальное давление; при поражении дуги в местах отхождения плече-головного ствола и левой подключичной артерии давление и величина пульса на руках неодинаковы (на стороне поражения ниже).
Клинические признаки сердечной недостаточности появляются только при сопутствующих нарушениях коронарного кровотока.
Атеросклероз брюшной аорты - наиболее частая локализация аортального А. При значительном атеросклеротическом сужении устьев чревного ствола и других ветвей брюшной аорты последовательно нарушается моторика и секреторная функция жел.-киш. тракта, что проявляется дискинезиями гладкомышечных органов брюшной полости и нарушениями пищеварения различной степени. Недостаточное кровоснабжение поджелудочной железы может проявляться не только нарушениями ее экскреторной функции, но и симптомами сахарного диабета, протекающего обычно доброкачественно (легкая или средняя степень тяжести). При атеросклеротической окклюзии бифуркации аорты формируется клиническая картина синдрома Лериша (см. Лериша синдром).
При физикальном исследовании наибольшую информацию дает пальпация брюшной аорты, если этому не препятствует часто имеющийся метеоризм. Пальпируемая аорта производит впечатление искривленной, плотность ее неравномерна; иногда уплотнение аорты настолько значительно, что ее принимают за опухоль или аневризму. В части случаев над пораженным участком аорты, особенно при ее расширении, выслушивается систолический шум.
Распознаванию А. брюшной аорты помогает обнаружение очагов обызвествления в ее стенках при рентгенографии. На ранних стадиях (в латентный клинический период) более информативны рентгенокимография и аортография, но применяются эти методы обычно лишь в сложных дифференциально - диагностических ситуациях.
А. брюшной аорты нередко приводит к образованию аневризмы с возможным ее расслоением (см. Аневризма расслаивающая) или разрывом (см. Аневризма аорты). Грозным осложнением является тромбоз ветвей или ствола брюшной аорты. В последнем случае тромб локализуется обычно на уровне разветвления аорты, закупоривая одну или обе общие подвздошные артерии. Клинические проявления тромбоза зависят от быстроты развития, величины тромба и возможности развития коллатерального кровообращения через наружные подвздошные, подчревные и внутренние грудные артерии. Быстрое развитие тромбоза проявляется резкими болями в одной или обеих ногах (соответственно протяженности и локализации тромба), их похолоданием и резким снижением пульса на бедренных и более дистальных артериях; позже развивается гангрена ног, присоединяются расстройства функции тазовых органов (нарушения мочеотделения и дефекации). Больные обычно быстро погибают, если не производится ранняя аортотомия с удалением тромба. При медленном закрытии просвета брюшной аорты и общих подвздошных артерий клиническое течение тромбоза менее грозно, т. к. развивается коллатеральное кровообращение, однако тяжесть расстройств кровообращения в нижних конечностях и органах малого таза все-таки значительна: прогрессирует слабость в ногах, мышцы ног атрофируются, беспокоят боли в пояснице и в ногах при ходьбе, дефекация и мочеотделение затруднены, развивается импотенция. Распознавание тромбоза брюшной аорты в таких случаях основывается на признаках высокой артериальной окклюзии; при пальпации и при помощи осциллографии выявляется значительное снижение артериального пульса на ногах, артериальное давление на них резко снижено или аускультативным методом вообще не определяется. Диагноз уточняется аортографией.
Атеросклероз мезентериальных артерий
Атеросклероз мезентериальных артерий проявляется нарушениями функций пищеварительного аппарата, сходными с таковыми при А. брюшной аорты, т. к. основу этих клинических проявлений в обоих случаях составляют ишемические расстройства в органах пищеварения. Однако клиническая симптоматика при А. мезентериальных артерий более выражена, что связано со спазмами пораженных артерий, в то время как клиника изолированного поражения брюшной аорты определяется гл. обр. степенью органического сужения просвета устьев ее ветвей.
Чаще поражается верхняя мезентериальная артерия, меньше других снабженная анастомозами, с чем, возможно, в какой-то степени связано снижение секреторной функции желудка у лиц пожилого возраста.
Жалобы больных на вздутие живота, запоры, чувство давления в эпигастрии, колющие боли в животе с изменчивой локализацией (дискинезия отдельных кишечных петель), тошноту, отрыжку и др., к-рые могут быть изолированными или различно сочетающимися и обычно отмечаются через 2-4 часа после приема пищи, отражают начальные степени мезентериальной недостаточности. При выраженном атеросклеротическом поражении артерий брыжейки возможны значительные расстройства моторной функции кишечника вплоть до динамической кишечной непроходимости, тяжелых расстройств пищеварения со вторичным развитием гиповитаминозов и истощения .
Ярким клиническим проявлением А. мезентериальных артерий является брюшная жаба (см.). Ее появление всегда свидетельствует о значительной степени атеросклеротического процесса, но функциональные расстройства тонуса пораженных артерий и в этой стадии болезни играют существенную роль. Об этом свидетельствует положительный терапевтический эффект спазмолитических препаратов, смягчающих течение брюшной жабы.
Из осложнений А. мезентериальных артерий наиболее тяжелым является тромбоз с развитием инфарктов в кишечной стенке. Быстро развивающийся тромбоз проявляется нарастающими резкими разлитыми болями в животе (нередко в сочетании или с предшествующими "блуждающими" болями но всему животу) с тенденцией к локализации в эпигастральной области. Боли не купируются наркотиками, при пальпации живота мало изменяются по интенсивности; в первые часы живот остается мягким. Тромбоз верхней мезентериальной артерии нередко проявляется симптомами высокой кишечной непроходимости, в частности обильной каловой рвотой; при тромбозе нижней мезентериальной артерии чаще отмечается выделение с калом неизмененной крови. Опоздание с назначением гепарина и фибринолпзина, как правило, приводит к развитию перитонита. Хирургическое вмешательство в таких случаях нередко оказывается малоэффективным, и больные погибают.
Атеросклероз почечной артерии
Атеросклероз почечной артерии по клинической симптоматике полиморфен. При локализации бляшек в этом сосуде или при А. брюшной аорты в области отхождения почечной артерии может произойти резкое сужение просвета почечной артерии вплоть до закрытия отдельных отходящих от нее ветвей. В последнем случае в моче появляются белок, эритроциты, цилиндры. Вместе с тем заметного нарушения функции почек и повышения кровяного давления не наступает. Однако, если устье или ствол почечной артерии значительно сужены, максимальное и минимальное артериальное давление повышается. При одностороннем поражении мочевыведение может еще длительно оставаться нормальным, но в дальнейшем оно нарушается в связи с развитием артериолосклероза и артериолонекроза и во второй почке. Пока артерии одной почки не стенозированы, заболевание протекает подобно доброкачественной форме гипертонической болезни, но со стойкими изменениями в моче и стойким повышением артериального давления. При резком сужении артерий обеих почек, к-рое может развиваться одновременно либо последовательно, наступает двусторонний артериолосклероз, и заболевание принимает злокачественное течение.
При физикальном исследовании специфических симптомов стеноза почечной артерии, как правило, не выявляется; в нек-рых случаях над почечной артерией прослушивается систолический шум. Для достоверной диагностики стеноза применяются специальные исследования: изотопная ренография, внутривенная урография и аортография с контрастированием почечных артерий.
Когда А. почечной артерии осложняется ее тромбозом, остро развивается тяжелая клиническая картина, характеризующаяся триадой симптомов: сильные длительные боли в пояснице, иногда с явлениями шока, но без типичной для почечнокаменной болезни иррадиации болей в низ живота и в паховую область; стойкое повышение максимального и минимального артериального давления; появление в моче белка, эритроцитов и цилиндров. Кроме того, могут наблюдаться лейкоцитоз и ускорение РОЭ.
Атеросклероз периферических артерий
В большей степени поражаются крупные артерии, чаще в местах их разветвлений и изгибов. Субъективные симптомы поражения могут долгое время отсутствовать даже в тот период, когда распознавание А. этих артерий становится возможным по данным их простого осмотра и пальпации. При поражении артерий конечностей, особенно нижних, клинические симптомы проявляются чаще и раньше, чем при поражении артерий, снабжающих покровы головы, груди. Это обусловлено тем, что при одинаковой степени атеросклеротического стеноза (облитерирующего А.) приводящих артерий ишемические расстройства больше выражены в тканях с повышенной потребностью в кровоснабжении, напр. в мышцах при физической нагрузке.
Одним из ранних клинических проявлений А. артерий конечностей является слабость и повышенная утомляемость мышц, питающихся из пораженной артерии. Рано появляется также ощущение зябкости в конечностях, несколько позже присоединяются парестезии (ощущение ползающих мурашек, онемения) и, наконец, боли, обычно впервые появляющиеся на высоте физической нагрузки. Для атеросклеротического поражения крупных артерий ног типична так наз. перемежающаяся хромота (см.). В условиях холода, сырости и других факторов, способствующих спастическим реакциям артерий (см. Ангиоспазм), болевые ощущения возникают чаще.
При объективном исследовании, если поражаются артерии, доступные осмотру и пальпации (напр., височная, лучевая), определяется извилистость артерий (симптом "червячка"), значительное их пульсовое смещение, неравномерное уплотнение, дающее при пальпации ощущение четок или "гусиного горлышка". При А. крупных артерий ног обнаруживаются бледность и похолодание пораженной конечности, а в случаях тяжелого поражения выявляются трофические расстройства в ее дистальных участках вплоть до развития гангрены. Функциональные клинические пробы (в частности, пробы Гольдфлама, Оппеля - см. Облитерирующие поражения сосудов конечностей) выявляют недостаточность артериального притока к ноге. Пульс на дистальных артериях ослаблен или не прощупывается, артериальное давление в них снижено.
Инструментальные исследования выявляют нарушения физических свойств пораженных артерий конечностей еще в клинически латентный период. Амплитуда сфигмограмм, осциллограмм и реограмм дистальных артерий снижается. Анакрота сфигмограммы укорочена по времени, вершина основной волны нередко закруглена, дополнительные волны на катакроте сглаживаются. По мере прогрессирования процесса измерение кожной температуры выявляет различную степень ее снижения дистальнее участка поражения; на плетизмограммах стопы (или пальцев стопы) регистрируется снижение объемного пульса и уменьшение объемной скорости кровотока. Замедление линейной скорости кровотока выявляется красочным или радиоизотопным методами. Локализация и степень атеросклеротического сужения наиболее точно устанавливаются с помощью ангиографии.
Атеросклероз артерий головного мозга
Атеросклероз артерий головного мозга - нередкое явление у лиц старше 60 лет. Чаще, раньше и в более выраженной форме он наблюдается при сочетании А. с гипертонической болезнью. При поражении крупных церебральных артерий или при распространенном гиалинозе артериол, как это бывает при гипертонической болезни, отчетливо снижается память, гл. обр. на недавние события, уменьшается умственная работоспособность; больные быстро утомляются, не могут длительно сосредоточивать внимание на одном и том же, становятся эмоционально лабильными, нередко жалуются на бессонницу, головные боли, головокружение, особенно при быстром переходе из горизонтального положения в вертикальное. При выраженном А. мозговых артерий заметно изменяется личность больного, его поведение; Могут наблюдаться различные психические расстройства. Среди причин симптоматической эпилепсии позднего возраста А. мозговых артерий принадлежит одно из ведущих мест.
Локальными симптомами А. отдельных более мелких артериальных ветвей являются: дыхание Чейна-Стокса (при поражении артерий, питающих продолговатый мозг), атаксия, головокружение (при недостаточном кровоснабжении мозжечка или вестибулярного аппарата), преходящие параличи, нарушения речи, зрения, слуха и др. В развитии этих нарушений может играть роль и наклонность мускулатуры стенок артерий, пораженных А., к повышенным тоническим сокращениям.
Особенно тяжелыми осложнениями А. мозговых артерий являются: а) кровоизлияния (чаще из артерий подкорковых узлов и моста), дающие грозную картину внезапно наступающей потери сознания и развития комы, нередко со смертельным исходом (см. Инсульт); б) более медленно и постепенно развивающиеся тромбозы (чаще крупных артерий коры), ведущие к некрозу мозговой ткани с развитием в ней рубцов и полостей и сопровождающиеся параличами и другими нарушениями, но без комы и потери сознания (см. Тромбоз, сосудов головного мозга).
Психические расстройства той или иной формы и степени относятся к частым, хотя и необязательным проявлениям атеросклероза мозговых артерий. Объем и границы психических расстройств в наст, время еще недостаточно определены и во многих отношениях спорны. Не подлежит, однако, сомнению, что психические нарушения при А. отличаются значительным клиническим разнообразием, т. е. проявляются широким диапазоном психических расстройств.
Наиболее обоснованной представляется следующая их группировка: инициальные нарушения ("псевдоневрастенические", "церебрастенические", неврозоподобные), различные формы атеросклеротического слабоумия, острые психозы экзогенно-органического типа и затяжные психозы (сложные, эндоформные, т. е. напоминающие циркулярный ПСИХОЗ ИЛИ шизофрению, аффективные, бредовые и галлюцинаторно-бредовые).
Выделение инициальных психичеческих расстройств в особую группу вызвано их значением для профилактики и раннего лечения, своеобразием их клинических проявлений и тем обстоятельством, что они могут оказаться настолько малопрогреднентными или даже стабильными, что ими исчерпываются все психические изменения при А. церебральных артерий.
К начальным проявлениям относятся: 1) псевдоневрастенпческне состояния с характерными жалобами на головные боли, шум в голове, головокружение, парестезии лица, расстройства сна, повышенную утомляемость и истощаемость, снижение работоспособности при сохранности известных компенсаторных возможностей, раздражительность, невыносливость к шуму, к жаре и т. и., подавленное настроение, слезливость, забывчивость и др.; 2) состояния, характеризующиеся, кроме того, преобладанием характерологических (психопатоподобных) сдвигов то в виде нек-рого заострения, то известного стирания ранее свойственных больному черт характера; причем усиливаются прежде всего астенические компоненты личности - черты нерешительности, неуверенности в себе, тревожности, в то время как при манифестации заболевания в старческом возрасте личностные изменения могут иметь сенильноподобный оттенок, напоминающий начальный этап старческого слабоумия вследствие нарастания ригидности и эгоцентризма, черствости и скупости, равнодушия и эмоционального огрубения; 3) при более прогредиентном течении психических расстройств при А., кроме перечисленных симптомов, наблюдаются признаки нек-рого снижения уровня личности и умственной деятельности (органический психосиндром, по М. Блейлеру), в частности снижение психической активности, объема и четкости восприятий, темпа и продуктивности умственной деятельности, уровня суждений и критики; отмечается ригидность и обстоятельность мышления, оскудение представлений и понятий, ослабление памяти, особенно избирательной репродукции и запоминания нового материала, пониженное слезливо-тревожное настроение, снижение (реже расторможенность) влечений. В начальной стадии психических изменений при А. в ответ на психотравмирующие ситуации сравнительно часто развиваются реактивные депрессивные состояния умеренной тяжести.
При прогредиентном течении инициальная стадия психических изменений без четких границ переходит в состояние стойкого, обычно малообратимого оскудения (распада) всей психической деятельности, в деменцию. Нередко деменция развивается остро после нарушения мозгового кровообращения (постапоплектическая деменция).
При А. различают ряд форм (клинических типов) деменции. 1. Лакунарная (парциальная, дисмнестическая) - наиболее характерный тип деменции при А. Ей свойственны неравномерный (частичный) характер психических изменений, в т. ч. мнестических расстройств, сохранность грубой или частичной ориентировки, в основном сохранены навыки поведения и личностных реакций (так наз. ядро личности). Выделяются замедленность и затрудненность психических процессов, речи и моторики, чувство беспомощности, снижение уровня мыслительной деятельности, снижение психической активности, преобладание подавленного или тревожного настроения, склонность к слабодушным реакциям. 2. Амнестический тип деменции характеризуется преобладанием нарушений памяти, в частности наличием фиксационной амнезии (см.), амнестической дезориентировки в месте и времени и замещающих конфабуляций, т. е. развитием корсаковского синдрома различной полноты и выраженности (см. Корсаковский синдром). Этот тип деменции при А. нередко возникает вслед за нарушениями мозгового кровообрахцения или острыми психозами и в этих случаях бывает в нек-рой степени обратимым. При его развитии в старости, чаще при сочетании атеросклеротического поражения головного мозга и сенильной атрофии, может наблюдаться картина так наз. хрон. пресбиофрении (см. Старческое слабоумие). 3. При так наз. псевдопаралитической форме деменции расстройства памяти, снижение психической активности и замедление темпа психических процессов менее выражены; преобладают беспечность и тупая эйфория, говорливость и облегченность ассоциативных процессов вплоть до мориаподобного дурашливого возбуждения (см. Психоорганические синдромы). Критика и уровень суждений резко снижены. Этот тип деменции наблюдается обычно в более молодом возрасте, чаще при сопутствующей гипертонической болезни. 4. При диффузном и распространенном поражении мозговых артерий, протекающем, как правило, без инсультов, может развиваться так наз. сенильноподобная форма деменции, клиническая картина к-рой напоминает тотальную деменцию при старческом слабоумии. Этот тип деменции наблюдается часто при сочетании А. мозговых артерий с сенильной атрофией мозга. 5. Осложненная очаговой неврологической симптоматикой форма деменции возникает постапоплектически или после многократных, сопровождающихся мелкими очагами размягчения нарушений мозгового кровообращения. Ее клиническая картина находится в зависимости от локализации, количества и величины очагов. При мелкоочаговом поражении обширной корковой области развивается синдром афатоапракто-агностической (псевдоальцгеймеровской) деменции - сосудистого варианта болезни, обозначаемой как Гаккебуша-Гейера-Геймановича синдром (см.).
Все названные варианты клинической картины деменции при А. редко наблюдаются в чистом виде; чаще речь идет о комбинациях, в к-рых тот или другой клинический тип преобладает.
Острые психозы при А., проявляющиеся гл. обр. синдромами экзогенного типа реакций, отличаются вместе с тем рядом клинических особенностей: 1) синдромы измененного сознания (делириозные, аментивные, онейроидные и др.) часто бывают неполными (рудиментарными) и в синдромальном отношении нечетко очерченными, обычно обозначаемыми как "состояния спутанности"; 2) кратковременные, транзиторные психотические состояния, в особенности ночные состояния спутанности, как правило, многократно повторяющиеся; 3) часты переходы одного синдрома в другой (напр., делирия в сумеречное состояние или аменцию и т. п.); 4) острые и подострые психозы с более сложным течением, к-рое не исчерпывается синдромами помраченного сознания; возникают и другие обратимые, но не сопровождающиеся нарушением сознания - так наз. переходные (промежуточные, по Викку) синдромы аффективного, бредового или "органического" типов. При этом закономерности смены синдромов отражают основную тенденцию болезненного процесса к прогредиентному или регредиентному течению.
К затяжным психозам, наблюдающимся при А., относятся хрон. галлюцинозы, чаще всего вербальные, реже зрительные, тактильные или смешанные. Поливокальные вербальные галлюцинозы угрожающего и осуждающего содержания сопровождаются галлюцинаторным бредом, а также аффектом страха и тревоги, обычно обостряются по ночам и принимают сценический характер, но синдром галлюциноза, как правило, не усложняется. Затяжные паранойяльные психозы, чаще всего в виде бреда ревности у мужчин, могут встречаться на разных этапах течения А. мозговых артерий, даже при наличии заметного умственного снижения. Интерпретативный бред бывает в таких случаях бедным, слабо разработанным и систематизированным.
Из аффективных психозов наблюдаются преимущественно депрессивные, причем в широком диапазоне вариантов от явно органически окрашенных ("стертых", "слезливых", "жалующихся", "апатических") до так наз. эндоформных, напоминающих эндогенные (циркулярные) депрессии. Последние вызывают нередко значительные дифференциально-диагностические трудности, и их отнесение к психическим расстройствам сосудистого генеза остается сомнительным.
На ранних этапах заболевания часто наблюдаются депрессивные реакции.
Нек-рыми авторами описаны также сравнительно редкие, более сложные аффективно-бредовые, галлюцинаторно-бредовые (шизоформные) и другие варианты психических расстройств при А.
Патогенез психических расстройств при А. отличается неоднородностью и сложностью. Синдромы начального этапа, состояния деменции и острые психозы экзогенного типа имеют более прямую связь с церебральной сосудистой патологией, обнаруживают определенный параллелизм между обострениями А. и развитием психических расстройств, что повышает достоверность причинно-следственной связи между ними. В других случаях, как, напр., при галлюцинаторно-параноидных, паранойяльных и нек-рых депрессивных психозах, таких прямых корреляций между выраженностью и течением соматических и психических изменений обычно не наблюдается, но выступает роль наследственной отягощенности (прежде всего эндогенными психозами), преморбидных особенностей больных. Клинические, в частности катамнестнческие, наблюдения показали, что значительная часть этих психозов должна быть отнесена к эндогенным заболеваниям, спровоцированным и видоизмененным атеросклеротическим процессом в сосудах мозга.
Диагностические и дифференциально-диагностические трудности касаются гл. обр. этих психических форм, тем более что при широкой распространенности А. мозговых артерий в позднем возрасте сочетания его с эндогенными и другими психическими заболеваниями часты. Дифференциальный диагноз основывается на учете генеалогических и анамнестических данных, наблюдений над закономерностями течения, на синдромальном анализе и катамнестическнх наблюдениях над исходами. Дифференциально-диагностические трудности, разрешимые иногда только на основании длительного наблюдения, возникают при разграничении сенильноподобных форм деменции от смешанных сосудисто- атрофических заболеваний старческого возраста.
Атеросклероз легочных артерий
Атеросклероз легочных артерии встречается редко; как правило, он наблюдается при заболеваниях, протекающих с повышенным кровяным давлением в сосудах легких при нек-рых врожденных пороках сердца, при митральном стенозе, реже при митральной недостаточности, эмфиземе и фиброзе легких, кифосколиозе и др.), что указывает на значение механических факторов в его развитии.
Довольно быстро атеросклеротический процесс развивается в легочном стволе при первичной легочной гипертензии. Клинически он проявляется резким диффузным цианозом, дыхательной недостаточностью диффузионного типа и симптомами значительной легочной гипертензии (см. Айерсы синдром). Развитие А. легочного ствола приводит к необратимости легочной гипертензии, на фоне к-рой он возникает, к быстрой инвалидизации и смерти больных. Поэтому как патогенетическая, так и, по возможности, каузальная терапия легочной гипертензии (в т. ч. хирургическая коррекция) должна быть ранней.
Рентгенодиагностика атеросклероза
Рентгенодиагностика атеросклероза имеет целью установить наличие, распространенность и степень атеросклеротического поражения сосудов. Рентгенологическими признаками А. аорты являются ее расширение, удлинение, усиление интенсивности ее тени и отложение извести в ее стенках. При просвечивании, особенно с помощью рентгенотелевндения, удается видеть краевую каемку из обызвествлений по контуру сосуда. Во время систолы левого желудочка вся грудная аорта смещается влево и кверху, что свидетельствует о снижении эластичности ее стенок.
На рентгенокнмограмме и электрокимограмме отмечается деформация зубцов по контуру аорты,снижение амплитуды пульсации и полное ее отсутствие в местах наибольшего обызвествления. Рентгенологически чаще выявляется поражение брюшной, чем грудной, аорты. Исследование брюшной аорты производится преимущественно в боковой проекции.
Для уточнения локализации и протяженности поражения применяют аортографию (см.) и артериографию (см.). Относительно ранним признаком А. при ангиографии является уменьшение степени контрастирования по краю сосуда и наличие краевых дефектов. Симптом неравномерного контрастирования аорты определяется при расположении атеросклеротических бляшек на передней или задней стенках.
При резко выраженном атеросклеротическом процессе выявляются большой протяженности краевые и центрально расположенные дефекты по ходу сосуда. Контур становится изломанным, неровным, фестончатым. Наряду с сужением сосуда могут быть видны участки расширения его просвета. В отдельных случаях при далеко зашедшем А. с окклюзией сосуда определяется конической или цилиндрической формы культя сосуда с развитой сетью коллатерального кровообращения. Для определения гемодинамических нарушений учитывают скорость контрастирования сосуда, расположенного дистальнее места поражения, и длительность задержки контрастного вещества в проксимальных его отделах.
Прогноз
В отношении жизни и трудоспособности больных прогноз в значительной степени определяется локализацией процесса.
Развитие единичных атеросклеротических бляшек в крупных коронарных артериях при полной интактности всех прочих сосудов может привести к тяжелому инфаркту миокарда со смертельным исходом, причем к такому исходу болезнь может привести уже при первом клиническом проявлении А.
С другой стороны, известны распространенные и обширные формы А. во многих сосудах, совместимые с жизнью в течение длительного времени даже с сохранением трудоспособности. Важным фактором, определяющим прогноз при А., является тренированность сосудистых реакций, зависящая от образа жизни больного, соотношения физической и умственной деятельности и других причин. Острые нарушения регионарного кровообращения в мозгу, сердце и других органах при одной и той же локализации и степени выраженности А. более вероятны при гиподннамнческом образе жизни, при сочетании А. с другими заболеваниями - сахарным диабетом, деформирующим спондилезом шейного отдела (при А. мозговых сосудов), микседемой и особенно с гипертонической болезнью, т. к. последняя способствует прогрессированию А., а также неблагоприятно влияет на состояние сердечно-сосудистого аппарата.
Профилактика
Так как А. протекает волнообразно, со сменой фаз активации и регрессирования процесса, важное значение имеет не только первичная его профилактика (предупреждение самого заболевания), но и вторичная - предупреждение прогрессирования А. и его осложнений.
Первичная профилактика в основе своей должна быть массовой и предполагает прежде всего уменьшение влияния тех патогенных факторов, к-рые сопутствуют техническому прогрессу и урбанизации населения.
В этом отношении представляются важными мероприятия по охране окружающей, среды, устранение шума в городах и на предприятиях, обеспечение трудящихся условиями для отдыха вне территорий промышленных объектов, чему способствует, в частности, укорочение рабочей недели. Значительную роль в первичной профилактике А. призвана играть сан.-просвет. работа, к-рая должна начинаться в контингентах населения юношеского возраста пропагандой основных мер личной профилактики А., таких как регулярные занятия физкультурой (с объяснением патогенного влияния гиподинамии), соблюдение правильного режима труда и отдыха с достаточной продолжительностью сна; проведение дней отдыха в загородных условиях, спортивные игры, туризм; соблюдение умеренности в еде и разнообразия питания (объяснение патогенной роли избыточного калоража пищи и неблагоприятного влияния ожирения); исключение курения.
К первичной профилактике А. относятся также меры предупреждения и своевременного лечения способствующих развитию А. заболеваний эндокринной системы - гипотиреоза, сахарного диабета и других болезней обмена веществ, профилактика гипертонической болезни. Лица, уже страдающие такими заболеваниями, а также лица с наследственной отягощенностью по А. должны соблюдать перечисленные меры личной профилактики особенно тщательно, более строго ограничивать содержание в пище животных жиров, калораж к-рых должен составлять не более 15% всего калоража пищи. При выявлении нарушений липидного обмена с профилактической целью могут быть назначены препараты йода и гипохолестеринемические средства. Инструментальные исследования сосудов с целью раннего выявления А. (в латентный период) у таких лиц должны проводиться чаще, чем в других группах населения, и в более раннем возрасте (с 25-30 лет).
Вторичная профилактика А. - предупреждение фаз его прогрессирования - складывается из обязательного включения всех мер первичной профилактики и назначения предупредительных курсов лечения специальным диететическим режимом, препаратами йода и средствами гипохолестеринемического, антикоагулянтного и сосудорасширяющего действия.
Значительная роль в профилактике н лечении А. принадлежит днете и лечебной физкультуре.
Лечение
Лечение А. должно быть комплексным, включающим медикаментозное, диетическое, санаторно-курортное лечение, лечебную физкультуру, а при необходимости и хирургические методы (см. Атеросклероз, хирургическое лечение).
Медикаментозное лечение направлено на нормализацию липидного обмена, процессов свертывания крови и метаболизма в сосудистых стенках. При наличии нарушений нерзной или эндокринной регуляции обмена назначаются препараты, нормализующие деятельность регуляторных систем: седативные или тонизирующие средства, по показаниям - тиреоидин (по 0,03-0,05 г 2-3 раза в день), небольшие дозы эстрогенов. Одновременно назначаются средства, способствующие снижению содержания холестерина в крови. К ним относятся препараты ненасыщенных жирных кислот; липотропные средства (метионин, липокаин и особенно холин-хлорид) и вещества гипохолестеринемического действия: бета-ситостерин, конкурентно препятствующий всасыванию холестерина из кишечника; атромид, мисклерон, клофибрат, ката-липид, тормозящие синтез эндогенного хо-лестерина; холестирампн, стимулирующий экскрецию холестерина с желчными кислотами. Дозирование этих препаратов и длительность их назначения индивидуализируются в зависимости от переносимости лекарств больными и величины достигнутого терапевтического эффекта, определяемого по динамике клинических симптомов и уровня липидов крови. Клинический эффект, в частности в виде уменьшения церебральных ишемических расстройств, дают препараты йода, а также диоспонин (содержащий водорастворимые стероидные сапонины). Применяются кальцийодин (сайодин), йодид калия в виде 3% раствора или 0,1% раствор чистого йода с йодидом калия (5-10 капель в молоке 2-3 раза в сутки) внутрь. Применение препаратов йода желательно курсами по 3-5 нед. 2-3 раза в году. Для более легкого подбора дозы, не вызывающей явлений йодизма, предпочтителен 3% раствор йодида калия, назначаемый в индивидуальных вариантах от 1 чайн. л. до 3-4 стол. л. в день.
Гипохолестеринемическое действие свойственно также витамину С, никотиновой к-те, но показания к витаминизации при атеросклерозе определяются в основном их нормализующим влиянием на метаболизм сосудистой стенки. С лечебной целью аскорбиновую к-ту используют в высоких суточных дозах (до 1,0-1,5 г в сутки); дозы других назначаемых при А. витаминов, в частности B2, B6, также должны превышать суточную потребность. Дозирование никотиновой к-ты ограничено нередко плохой переносимостью препарата из-за его вазоактивных свойств (чувство жара, пот, пятнистая гиперемия кожи, наступающие в связи с сосудорасширяющим эффектом).
Комплексное лечение А. включает также назначение препаратов, препятствующих развитию регионарных расстройств кровообращения, к-рые гл. обр. и определяют прогноз болезни напр., коронаролитиков при ишемической болезни сердца, средств, расширяющих мозговые артерии при их поражении, и т. д., а также антикоагулянтов при угрозе тромботических осложнений.
Лечебное питание. Предложен ряд лечебных столов, в основе к-рых лежит: а) ограничение на 10-15% общей калорийности пищи (для лиц с избыточным или нормальным весом); б) уменьшение в рационе животных жиров и богатых холестерином продуктов (мозги, яичный желток, икра, жирные сорта мяса и рыбы), а также витамина D, поваренной соли и экстрактивных веществ (бульоны, уха); в) включение в рацион в относительно больших количествах продуктов, богатых липотропными веществами (творог, хорошо вымоченная сельдь, треска, овсянка и др.), растительных масел (подсолнечное, кукурузное, льняное, хлопковое), овощей, фруктов, богатых растительной клетчаткой. Строгость диеты зависит от большей или меньшей выраженности нарушений обмена веществ больного. При избыточном весе целесообразно назначение разгрузочных дней (яблочных, кефирных, творожных, компотных и др.). В дневном рационе должно содержаться 30-40 г полноценных белков (мясо, рыба, нежирные молочные продукты, яичный белок).
Лечебная физкультура. Систематическая мышечная деятельность является одним из средств профилактики А.; она нивелирует диспропорцию между гиподинамией и нервно- психическим напряжением. При наличии А. физические упражнения применяются с лечебной целью или как составная часть реабилитационных мероприятий после инфаркта миокарда, инсульта, после оперативных вмешательств на сердце и сосудах. За исключением острого периода регионарных расстройств кровообращения, противопоказаний для назначения лечебной физкультуры при А. нет.
Клинико-физиологической основой действия физических упражнений при А. служит их способность стимулировать энергетический обмен в сторону активации ферментативного окисления и липидного обмена, а также возможность с помощью физической тренировки компенсировать нарушенные функции, повышать уровень функционирования сердечнососудистой системы, уменьшать явления гипоксии пораженных органов и тканей. Физическая дозированная тренировка замедляет коагуляцию крови и повышает функцию противосвертывающих механизмов, активно влияет на развитие коллатерального кровообращения в миокарде, способствует приспособлению коронарного кровообращения к обменным потребностям миокарда, снижает уровень холестерина в крови.
В латентный период А. рекомендуется утренняя гигиеническая гимнастика, ходьба; в выходные дни и в период отпуска - туризм, спортивные игры, гребля, катание на лыжах, коньках, физический труд на воздухе и пр. В период выраженных клинических проявлений А. назначаются прежде всего лечебная гимнастика и прогулки пешком. В процедуре лечебной гимнастики целесообразно использовать дыхательные упражнения, упражнения с дозированным усилием мышц рук и ног для улучшения периферического кровообращения. При этом определенный подбор физических упражнений обеспечивает не только общеукрепляющее действие на организм больного, но и специальную тренировку пораженного органа в зависимости от преимущественной локализации атеросклеротического процесса в сердце, головном мозге, при атеросклеротических окклюзиях периферических артерий.
Учитывая опасность чрезмерной физической нагрузки в периоде атеросклеротической окклюзии артерий (стенокардия напряжения, перемежающаяся хромота), необходимо соблюдать умеренность и постепенность в повышении физической нагрузки в соответствии с клиническими проявлениями и течением А.
Клинические наблюдения и специальные физиологические и биохимические исследования (телеэлектрокардиография, баллистокардиография, реовазография, тесты с физической нагрузкой, исследования липидных фракций и линопротоинов крови и др.) показывают, что лечебная физкультура, совершенствуя адаптационные процессы в организме больного А., способствует повышению его физической работоспособности и более быстрой трудовой и социальной реабилитации.
Показания к санаторно-курортному лечению - см. Санаторно-курортный отбор.
Лечение психических расстройств при А. должно быть сочетанным, т. е., кроме применения психотропных препаратов, большое значение сохраняет лечение основного сосудистого заболевания, направленное на улучшение питания и кровоснабжения головного мозга, а также на устранение сердечной недостаточности. Такая терапия особенно важна при острых психозах, сопровождающихся нарушением сознания. В начальных стадиях имеют значение организация правильного режима труда, быта и отдыха, питание, а также рациональная психотерапия. В зависимости от психического состояния больных находят применение транквилизаторы, нейролептики и антидепрессанты по общепринятым в психиатрии показаниям. Однако психотропные средства могут вызвать декомпенсацию сосудистого процесса, поэтому назначения наиболее сильнодействующих препаратов избегают и подбирают препараты постепенно и осторожно; следует избегать высоких дозировок, применяемых при других психических заболеваниях.
Библиогр.: Анестиади В. и Зота Е. Атеросклероз и эластика артерий, Кишинев, 1970, библиогр.; Аничков Н. Н. Новые данные по вопросу о патологии и этиологии артериосклероза (атеросклероза), Рус. врач, т. 14, № 8, с. 184, К" 9, с. 207, 1915; Банщиков В. М. Атеросклероз сосудов мозга с психическими нарушениями, М., 1967, библиогр.; Вихерт А. М. и Жданов В. С. О ритмических структурах интимы аорты, Арх. патол., т. 32, № 7, с. 68, 1970; Вихерт А. М., Жданов В. С. и Матова Е. Е. Динамика развития атеросклеротических изменений в аорте и коронарных артериях у практически здоровых людей, там же, № 2, с. 44; Вихерт А. М. и др. Характеристика возрастной динамики атеросклероза аорты и венечных артерий сердца по секционным материалам различных городов, Труды 4-го Всесоюз. съезда патологоанат., с. 334, М., 1967; Вольф Д. Б. Усиленная физическая деятельность в профилактике и лечении атероза, атеросклероза и облитерирующего атеросклероза, в кн.: Спорт, мед., Труды 12-го Юбилейного международ. конгр. спорт, мед., с. 327, М., 1959; Давыдовский И. В., Гулина Л. А. и Озарай А. И. К патогенезу атеросклероза в свете морфологических данных, Арх. патол., Д. 24, № 7, с. 10, 1962, библиогр.; Климов А. Н. Гиперлипопротеинемия и роль ее в патогенезе атеросклероза, Пат. физиол. и эксперим. тер., т. 16, № 5, с. 3, 1972, библиогр.; Мясников А. Л. Гипертоническая болезнь и атеросклероз, М., 1965, библиогр.; Мясников Л. А. и Касаткина Л. В. Роль основного вещества артерий в патогенезе атеросклероза, Кардиология, т. 12, № 4, с. 128, 1972, библиогр.; Рахальский Ю. Е. К вопросу о расстройствах сознания при атеросклерозе сосудов мозга, в кн.: Вопр. клин, и патогенеза психических нарушений при сосуд, забол. головного мозга, под ред. В. М. Банщикова, с. 58, М., 1963, библиогр.; Штернберг Э. Я. Некоторые закономерности психических нарушений при сосудистых поражениях мозга, Вестн. АМН СССР, № 6, с. 22, 1967; Штернберг Э. Я. и Шумский Н. Г. К патогенезу так называемых эндоформных сосудистых психозов, в кн.: Геронтология й гериатрия, под ред. д. ф. Чеботарева, с. 367, Киев, 1?71; Adams C. W. M. Vascular histochemistry in relation to the chemical nnd structural pathology of cardiovascular disease, L., 1967, bibliogr.; Alsen V. Endoforme Psychosyndrome bei cerebralen Durchblutungsstörungen, Arch. Psychiat. Nervenkr., Bd 200, S. 585, 1960, Bibliogr.; Anitschkow N. u. Chalatow S. Über experimenteile Cholesterinsteatose und ihre Bedeutung fiir die Entstenung einiger pathologischer Prozesse, Zbl. allg. Path. path. Anat., Bd 24, S. 1, 1913; Atherogenesis, Proceedings of the first iternational symposium on atherogenesis, inrombogenesis and pyridinolcarbamate treatment, ed. by T. Shimamoto a. F. Numano, Amsterdam, 1969; Atherosclerosis, ed. by R. J. Jones, N. Y., 1970; Atherosclerosis, ed P. G. Schettler a. G. S. Boyd, Amsterdam-N. Y., 1969; Comparative atherosclerosis, ed. by J. C. Roberts a. o., N. Y. a. o., 1965; Constantinides P. The role of endothelial injury in arterial rombosis and atherogenesis, Fortschr. Kardiol., Bd 4, S. 67, 1970; Daoud A. a. o. "Preatheroma" phase of coronary atherosclerosis in man, Exp. molec. Path., v. 3, p. 475, 1964, bibliogr.; Fredrickson D. S., Levy R. J. a. Leer R. S. Fat transport in lipoproteins an integrated approach to mechanism and disorders, New Engl. J. Med., v. 276, p. 34, 94, 148, 215, 273, 1967, bibliogr.; Giertsen J. C. Atherosclerosis in an autopsy series, Acta path, microbiol. scand., v. 67, p. 305, 1966, bibliogr.; Haust M. D. The morphogenesis and fate of potential and early atherosclerotic lesions in man, Hum. Path., v. 2, p. 1, 1971, bibliogr.; Kehrer H. E. Die cerebrale Gefass-Sklerose, Stuttgart, 1959; Meyer J. B. a. o. Chemical composition of the aorta, coronary and cerebral arteries of Europeans and Bantu, Amer. Heart J., v. 71, p. 68, 1966, bibliogr.; Meyer W. W. Die Bedeutung der Eiweissablagerungen in der Histogenese arteriosklerotischer Intimaveranderungen der Aorta, Virchows Arch. path. Anat., Bd 316, S. 268, 1949, Bibliogr.; Moon H. D. Coronary arteries in fetuses, infants and juveniles, Circulation, v. 16, p. 263, 1957; Rodbard S. Physical factors in arterial sclerosis and stenosis, Fortschr. Kardiol., Bd 4, S. 72, 1970, Bibliogr.; Taylor H. E. The role of mucopolysaccharides in the pathogenesis of intimal fibrosis and atherosclerosis of the human aorta, Amer. J. Path., v. 29, p. 871, 1953, bibliogr.; Vlodaver Z., Kahn M. H. a. Neufeld H. N. The coronary arteries in early life in three different ethnic groups, Circulation, v. 39, p. 541, 1969; Watts H. F. Basic aspects of the pathogenesis of human atherosclerosis, Hum. Path., v. 2, p. 31, 1971, bibliogr.
Источники:
- Большая медицинская энциклопедия. Том 2/Главный редактор академик Б. В. Петровский; издательство «Советская энциклопедия»; Москва, 1975.- 608 с. с илл., 8 л. вкл.
|
ПОИСК:
|
© Анна Козлова подборка материалов; Алексей Злыгостев оформление, разработка ПО 2001–2019
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'