АСПАРАГИНОВАЯ КИСЛОТА
Расстановка ударений: АСПАРАГИ`НОВАЯ КИСЛОТА`
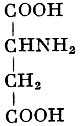
АСПАРАГИНОВАЯ КИСЛОТА (α-аминоянтарная кислота, 1-амино-этан-1,2-дикарбоновая кислота) - природная аминокислота; важнейшая составная часть белков. Структурная формула:
L-аспарагиновая кислота вращает плоскость поляризации света вправо:
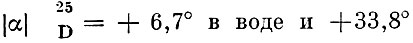
в 5н. HCl. Из всех природных аминокислот у А. к. наиболее выражены кислотные свойства, ее изоэлектрическая точка лежит при pH = 2,8; соответственно, константы кислотной диссоциации - pK = 1,88, pK2 = 3,65. А. к. впервые была получена при кислотном гидролизе амида А. к. - аспарагина (см.), а затем и из гидролизатов белков [Риттгаузен (H. Ritthausen), 1868]; формула А. к. установлена Либихом (J. Liebig) в 1833 г. А. к. наряду с другими аминокислотами является важнейшей составной частью белков. В составе белков, в свободном состоянии, а также в виде аспарагина и других производных широко распространена в органах и тканях различных организмов. Среди производных А. к. следует упомянуть N-ацетил-А. к., к-рая в заметных количествах содержится в тканях мозга, а также в других тканях. А. к, может синтезироваться в организме человека и животных из других веществ и, т. о., относится к заменимым аминокислотам (см.). Однако для нек-рых микроорганизмов А. к. является необходимым фактором роста и обязательно должна присутствовать в питательной среде. Являясь одним из промежуточных продуктов обмена азотистых веществ, А. к. играет важнейшую роль в обмене веществ. Особенно большую роль наряду с глутаминовой кислотой она играет в реакциях переаминирования (см.), перенося аминогруппы на кетокислоты, образуя ряд других аминокислот, превращаясь при этом в щавелевоуксусную к-ту и связывая, т. о., пути азотистого обмена с окислительными превращениями безазотистых соединений (см. Азотистый обмен, Окисление биологическое). В этих же реакциях А. к. образуется из щавелевоуксусной к-ты после присоединения к ней аминогруппы, отдаваемой какой-либо из других аминокислот.
Образуя аспарагин, А. к. выполняет важную роль, связывая, обезвреживая и перенося аммиак в тканях животных и растений. При расщеплении аспарагина под действием фермента аспарагиназы (К. Ф. 3. 5. 1. 1) выделяется аммиак и образуется А. к.
У бактерий А. к. распадается на аммиак и фумарат или синтезируется из названных продуктов под действием фермента аспартазы (L-аспартат-аммиак-лиазы; К.Ф.4.3.1.1). У микроорганизмов распространено также декарбоксилирование А. к. под действием декарбоксилаз А. к. (см. Декарбоксилирование).
А. к. участвует в образовании в организме ряда биологически важных соединений. Так, А. к. является источником 3-го (азотного) и 4, 5 и 6-го (углеродных) атомов пиримидинового кольца, к-рое образуется из А. к. и карбамилфосфата через стадии карбамиласпарагиновой, дигидрооротовой и оротовой кислот. При образовании пуриновых нуклеотидов А. к. в присутствии ГТФ аминирует инозиновую к-ту, превращая ее в адениловую к-ту (АМФ) с промежуточным образованием аденилянтарной к-ты. В цикле образования мочевины А. к. аминирует цитруллин, образуя аргининянтарную к-ту, которая далее распадается на аргинин и фумаровую к-ту.
Библиогр.: Браунштейн А. Е. Биохимия аминокислотного обмена, с. 173, М., 1949; Майстер А. Биохимия аминокислот, пер. с англ., М., 1961; Greenstein J. P. a. Winitz M. Chemistry of the amino acids, v. 3, N.Y.-L., 1961; Meister A. Biochemistry of the amino acids, N. Y.- L., 1965.
Источники:
- Большая медицинская энциклопедия. Том 2/Главный редактор академик Б. В. Петровский; издательство «Советская энциклопедия»; Москва, 1975.- 608 с. с илл., 8 л. вкл.
|
ПОИСК:
|
© Анна Козлова подборка материалов; Алексей Злыгостев оформление, разработка ПО 2001–2019
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'