АРТЕРИАЛЬНЫЙ ПРОТОК
Расстановка ударений: АРТЕРИА`ЛЬНЫЙ ПРОТО`К
АРТЕРИАЛЬНЫЙ ПРОТОК [ductus arteriosus (PNA); ductus arteriosus (Botalli) (BNA); син. боталлов проток] - кровеносный сосуд, соединяющий во внутриутробном периоде легочный ствол с аортой тотчас ниже ее перешейка (рис. 1). А. п. был известен К. Галену, вновь открыт Аранцио (C. Aranzio) и Л. Боталло. Функция А. п. описана В. Гарвеем, структура стенки - Лангером (С. Langer, 1853), процесс функционального закрытия А. п. экспериментально подтвержден Кеннеди, Кларком (1941).
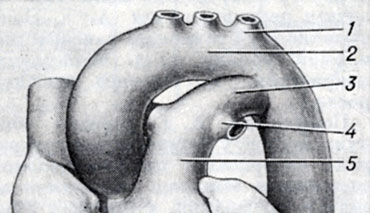
Рис. 1. Артериальный проток новорожденного ребенка: 1 - a. subclavia sin.; 2 - arcus aortae; 3 - ductus arteriosus; 4 - a. pulmonalis sin.; 5 - truncus pulmonalis
Эмбриология и анатомия
А. п. возникает на 5-й неделе эмбриогенеза из дорсального отдела шестой левой аортальной жаберной дуги одновременно с разделением артериального ствола (truncus arteriosus) на восходящую аорту (aorta ascendens) и легочный ствол (truncus pulmonalis). Начиная с амфибий А. п. образуется у всех позвоночных, но его положение у животных различных классов неодинаково (двустороннее, право- или левостороннее). У нек-рых млекопитающих (ластоногих, китообразных) А. п. функционирует в течение всей жизни.
А. п. у человека располагается в переднем средостении вне перикарда. У его стволового конца проходит левый диафрагмальный, а у аортального конца - левый блуждающий нервы. Снизу А. п. огибает левый возвратный гортанный нерв. Между А. п. и дугой аорты лежат сердечные нервы и сердечный узел, Под А. п. расположены левая легочная артерия и левый главный бронх. Сохраняя направление легочного ствола, А. п. отходит от него на одном уровне с левой легочной артерией. Диаметр А. п. 6-9 мм, длина 10-15 мм, форма может быть различной (песочных часов, цилиндрическая, веретенообразная, конусовидная). Впадает А. п. в аорту на 5-6 мм ниже и влево от начала левой подключичной артерии.
По строению А. п. относится к сосудам мышечного типа, чем отличается от аорты и легочного ствола. Перед рождением ребенка в стенке А. п. появляется мукоидное вещество, увеличивается субэндотелиальный слой. А. п. иннервируется блуждающим и симпатическим нервами. В его адвентиции находятся гломусные тельца. А. п. функционирует у человека в норме только во внутриутробном периоде. В зависимости от концентрации в крови кислорода и углекислого газа изменяется тонус мышц стенки А. п. и его диаметр, что определяет направление и объем сброса крови из легочного ствола в большой или малый круг кровообращения. А. п., обладая аккомодационной способностью, оказывает влияние на формирование малого круга кровообращения и камер сердца. После рождения, в срок от нескольких часов до 3-5 сут., А. п. закрывается и на протяжении 3-6 мес. полностью зарастает, превращаясь в артериальную связку (lig. arteriosum). Механизм закрытия А. п. изучен недостаточно. Наиболее обоснована теория мышечного спазма. При этом различают две фазы: функциональное закрытие протока и его анатомическую облитерацию.
Незаращение артериального протока
Незаращение А. п. относится к числу наиболее распространенных врожденных пороков сердца. У каждого 5-7-го больного врожденным пороком сердца имеется незаращение А. п.
При незаращении А. п. значительная часть крови из аорты сбрасывается в легочный ствол. Эта часть крови, проходя через малый круг кровообращения, снова поступает в левый желудочек. Последний во время диастолы получает избыточное количество крови, в результате чего наступает его гипертрофия.
Систолическое давление в системе легочного ствола в зависимости от ширины А. п. и длительности его функционирования может быть нормальным, повышенным или высоким. Легочная гипертензия возникает в результате склероза легочных сосудов. А. А. Кешишева (1958) разделяет легочную гипертензию на три стадии. I стадия не вносит изменений в клиническую картину неосложненного незаращения А. п. Легочная гипертензия II и III стадии является осложнением открытого А. п. Другим осложнением функционирующего А. п. является бактериальный эндартериит (боталлит).
Клиническая картина изолированного неосложненного незаращения А. п. довольно типична. Дети отстают в физическом развитии, худые. Кожные покровы бледные. Цианоз не характерен; он может наблюдаться при сочетании открытого А. п. с другими врожденными пороками синего типа, при легочной гипертензии с обратным сбросом крови либо при сердечной недостаточности.
При пальпации во II межреберье слева от грудины определяется дрожание ("кошачье мурлыканье"). Это дрожание возникает из-за того, что во время систолы кровь из аорты под большим давлением поступает в легочный ствол.
Изменение границ сердца зависит от величины и длительности незаращения А. п. Увеличение размеров сердца происходит вначале за счет левого желудочка, а позднее за счет правого. Происходит расширение легочного ствола (зона Герхардта). Часто наблюдается деформация грудной стенки в виде "сердечного горба".
Самым убедительным признаком незаращения А. п. является шум. Во II межреберье слева от грудины прослушивается грубый, резкий, скребущий, "машинный" систолодиастолический шум. Он заполняет большую часть систолы и диастолы и исчезает только в конце диастолы. Шум хорошо прослушивается, но с меньшей интенсивностью, на шее, в подмышечной впадине и в межлопаточном пространстве слева от позвоночника. Особенностью шума является его ослабление при задержке дыхания на вдохе.
Грубый систоло-диастолический шум, характерный для открытого А. п., имеет большое диагностическое значение. К числу признаков функционирующего А. п. относятся также капиллярный пульс и высокое пульсовое давление.
В разные периоды развития ребенка шум во II межреберье слева от грудины может быть различным. В раннем детском возрасте (до 3-5 лет) он может быть только систолическим, а затем становится типичным систоло-диастолическим. При осложненных формах незаращения А. п. (сердечная недостаточность, легочная гипертензия) шум может быть либо диастолическим, либо только систолическим. В последних случаях необходимо в целях уточнения диагноза прибегать к специальным методам исследования: катетеризации полостей сердца, определению газового состава крови в полостях сердца, ангиокардиографии.
Незаращение А. п. может сочетаться с другими врожденными пороками сердца. При этих вариантах в одних случаях патологический кровоток через А. п. ухудшает состояние больного, в других - является компенсаторным фактором.
Анатомические и функциональные особенности незаращения А. п. во всех вариантах наиболее полно даны в классификации Б. В. Петровского:
I. Изолированное незаращение А. п.:
1. Неосложненное.
2. Осложненное: а) бактериальным эндартериитом; б) легочной гипертензией; в) аневризмой протока или легочного ствола; г) декомпенсацией сердечной деятельности.
II. Открытый А. п., сочетающийся с другими врожденными пороками сердца. А. п. усиливает функциональные нарушения.
Сопутствующие пороки: 1) дефект межпредсердной перегородки; 2) дефект межжелудочковой перегородки;
3) аорто-легочный свищ; 4) болезнь Эйзенменгера; 5) болезнь Лютамбаше; 6) другие сочетания.
III. Открытый А. п., сочетающийся с другими врожденными пороками сердца. А. п. компенсирует функциональные нарушения, вызываемые сопутствующими пороками.
Сопутствующие пороки: 1) тетрада, пентада Фалло; 2) симптомокомплекс Корвизара; 3) другие сочетания.
Такие же осложнения, как у больных первой группы, могут быть и у больных второй и третьей групп. В повседневной практической работе следует пользоваться этой классификацией, т. к. она удобна и помогает избежать ошибок при решении вопросов о показаниях и противопоказаниях к хирургическому лечению с учетом функциональной роли А. п. в зависимости от осложнений и сопутствующих пороков (см. Пороки сердца врожденные).
Рентгенодиагностика при незаращении А. п. имеет большое значение, если сброс крови из артериального русла в венозное достаточно велик. Рентгенодиагностика трудна при небольшом сбросе и в той фазе эволюции порока, когда развилась легочная гипертензия, обусловленная свойственными этому пороку нарушениями гемодинамики.
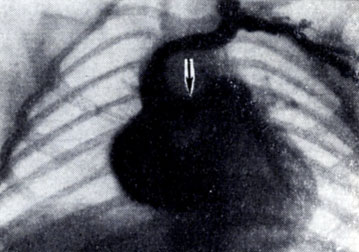
Рис. 2. Ангиограмма на 1-й секунде исследования. Видна круглая тень расширенного легочного ствола (стрелкой указан незаращенный артериальный проток)
Уже при рентгеноскопии выявляются рентгенологические признаки аномалии - выбухание дуги легочного ствола и глубокая пульсация ее, расширение сосудов корня легкого и обильный легочный рисунок, отражающие увеличенное кровенаполнение малого круга кровообращения. Левые полости сердца, получающие через легочные вены избыточное количество крови, увеличены. По мере повышения давления в малом круге кровообращения постепенно развивается гипертрофия правого желудочка. Но все эти признаки присущи и другим порокам, сопровождающимся увеличением кровотока в легких. Важным дифференциально-диагностическим признаком являются свойственные данной аномалии расширение и глубокая пульсация аорты, обусловленная быстрым оттоком крови из аорты как на периферию, так и в систему легочного ствола. На рентгенокимограмме амплитуда зубцов аорты увеличена, как при аортальной недостаточности, от к-рой данная аномалия отличается увеличением кровотока в легких. В отличие от митрального порока, левое предсердие не достигает значительной величины, отсутствует венозный застой в легких. При пробе Вальсальвы иногда отмечается отчетливое уплощение дуги легочного ствола в прессорной фазе. К аортографии (см.) прибегают лишь в случае диагностических затруднений. Прямым признаком открытого А. п. служит контрастирование легочного ствола непосредственно из аорты вследствие более высокого давления в нем. При ангиокардиографии (см.) в момент контрастирования легочного ствола заметно его расширение (рис. 2). Признаки длительного контрастирования легочного ствола и повторного его контрастирования через А. п. из аорты через 8-10 сек., когда правые полости сердца уже освободились от контрастного вещества, менее ценны, т. к. могут наблюдаться и при других видах сообщения между артериальным и венозным руслом (дефект перегородки сердца, аорто-легочный свищ).
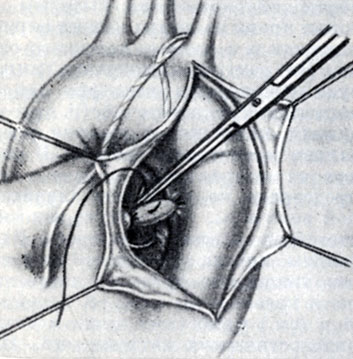
Рис. 3. Двойное лигирование артериального протока с его прошиванием
При зондировании сердца иногда удается пройти зондом из легочного ствола через открытый А. п. в просвет аорты.
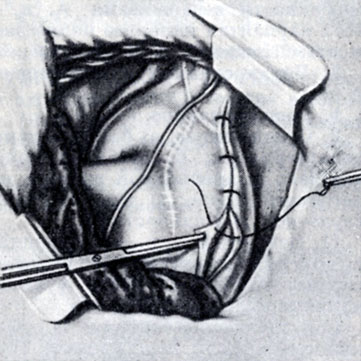
Рис. 4. Ушивание медиастинальной плевры узловыми швами после лигирования артериального протока
Хирургическое лечение. Впервые перевязка А. п. осуществлена Гроссом (R. Gross, 1938). В СССР первую успешную операцию по поводу открытого А. п. произвел А. Н. Бакулев (1948). К 1963 г. в различных странах мира было выполнено свыше 10000 операций с отличными результатами более чем у 98% больных; летальность не превышала доли процента (М. В. Муравьев, Ф. Н. Ромашов, 1963). Отечественными авторами, располагающими наибольшим опытом хирургического лечения открытого А. п., к 1971 г. опубликованы данные о результатах более 3000 операций (летальность 0,79-3,7%).
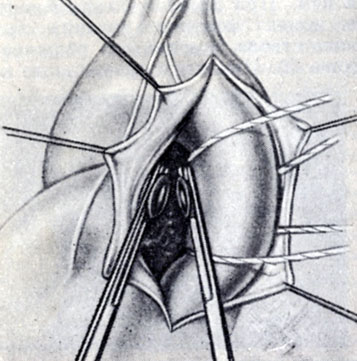
Рис. 5. Пересечение широкого артериального протока между двумя зажимами
Общепринятым хирургическим доступом является левосторонняя боковая торакотомия. Указанный доступ наименее травматичен и создает хорошие условия для операции. Легкое отводят кнаружи и выше его корня, рассекают медиастинальную плевру. Обнажают дугу аорты и левую легочную артерию. При этом следует опасаться повреждения блуждающего и возвратного нервов. Ориентируясь по пульсу и шумовым явлениям в местонахождении А. п., выделяют его со всех сторон и устраняют различными способами, к-рые зависят от анатомических условий и наличия осложнений порока, в первую очередь легочной гипертензии. При отсутствии осложнений и достаточно узком А. п. наиболее распространенным методом операции является двойная перевязка его, иногда с прошиванием между лигатурами (рис. 3).
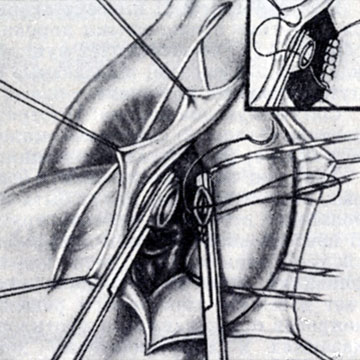
Рис. 6. Ушивание концов пересеченного артериального протока (справа вверху - ушивание стволового конца, аортальный конец ушит)
По мнению Б. В. Петровского и А. А. Кешишевой (1963), при правильной методике выполнения операции перевязка двумя лигатурами обеспечивает полное и надежное прекращение кровотока. Метод перевязки А. п. наиболее безопасен и прост технически. Как правило, при данном методе операции не прибегают к выделению аорты и легочного ствола выше и ниже А. п. Бережное оперирование с учетом анатомических взаимоотношений позволяет избежать повреждения протока.
Вначале выделяют переднюю полуокружность протока, а затем лопаточкой и диссектором - заднюю поверхность. Под проток диссектором подводят двойную шелковую лигатуру. Производят пробное пережатие протока на 4-5 мин. В это время ведут наблюдение за состоянием больного. Если гемодинамика и состояние больного не ухудшаются, продолжают операцию. При перевязке протока вначале завязывают лигатуру на аортальном конце, а затем на стволовом. После лигирования протока систоло-диастолический шум исчезает. Медиастинальную плевру ушивают узловыми швами (рис. 4).
Учитывая возможность развития аневризмы аортальной культи протока после его перевязки, иногда используют метод, заключающийся в перевязке стволового конца протока и прошивании механическим швом аортального. Наложение скрепочного шва на проток производится у самой аорты с захватом ее адвентиции, что предупреждает возникновение послеоперационной аневризмы. Метод надежен в свете отдаленных результатов и менее опасен в отношении возникновения кровотечения, чем пересечение протока.
При широком (более 1 см) А. п. показано рассечение его, чтобы избежать реканализации и возникновения кровотечения во время операции, Используется рассечение А. п. между двумя лигатурами, наложенными с прошиванием во избежание их соскальзывания, а также резекция протока между зажимами и ушивание культей аортального и стволового концов (рис. 5 и 6) ручным двухэтажным обвивным швом над зажимами и прошивным матрацным или кисетным под ними. Применение аппарата УАП-20 значительно упрощает технику операции. Многие хирурги применяют в подобных случаях прошивание протока двухрядным механическим скрепочным швом аппаратами УАП-20 или УАП-30, что дает хорошую герметичность.
В среднем у 20% больных незаращение А. п. сопровождается легочной гипертензией. Хирургическое лечение открытого А. п., осложненного легочной гипертензией, сопровождается высокой операционной и послеоперационной летальностью (до 75%, по данным Б. В. Петровского, 1963.
Операция при незаращении А. п., сопровождающемся легочной гипертензией, имеет ряд особенностей, важнейшими из к-рых являются создание широкого доступа, мобилизация аорты и легочной артерии выше и ниже места расположения протока. Обязательно использование управляемой гипотонии (см. Гипотония искусственная). Эти мероприятия направлены на обеспечение максимальной безопасности при манипуляциях на А. п. во время его выделения и закрытия. По данным многих хирургов, перевязка А. п., осложненного легочной гипертензией, может привести к смертельному кровотечению на операционном столе или в послеоперационном периоде вследствие прорезывания лигатуры или реканализации культи А. п. При осложненном легочной гипертензией открытом А. п. лигирование является непригодным методом. Наиболее приемлемым следует считать рассечение протока с последующим ушиванием его аортального и стволового концов или его прошивание аппаратом УАП-20 или УАП-30.
При высокой степени легочной гипертензии отдельным больным целесообразно производить операцию двухмоментно. На первом этапе осуществляют неполное (частичное) перекрытие А. п., чтобы уменьшить сброс крови через него, а затем после компенсации к новым условиям гемодинамики, повторной операцией полностью ликвидируют сообщение между аортой и легочным стволом. У больных с высокой степенью легочной гипертензии рекомендуется производить суживание А. п. только на 2/3 его просвета, что является достаточно эффективной и менее опасной операцией. Указанная методика значительно уменьшает опасность летального исхода от сердечной недостаточности. Состояние больных после подобных операций значительно улучшается. Однако не все хирурги применяют эту операцию.
При незаращении А. п., осложненном бактериальным эндартериитом, необходима очень осторожная мобилизация стенок протока. Необходимо также выделить аорту и легочный ствол и подвести под них держалки. Желательно рассечение протока и ушивание его аортального и стволового концов (Б. В. Петровский и А. А. Кешишева, 1963). Подобная методика операции используется и при аневризме А. п.
См. также Сердце, методы исследования, операции.
Библиогр.: Жеденов В. Н. Легкие и сердце животных и человека, М., 1961, библиогр.; Карленко П. Н., Александров Г. Н. и Борухов С. А. Сравнительные данные гистологического строения аорты, легочной артерии и боталлова протока у плодов, Грудн. хир., № 1, с. 38, 1961, библиогр.; Кушев Н. Е. О боталловом протоке у детей, Спб., 1901, библиогр.; Новиков И. И. Об иннервации боталлова протока у зародышей и плодов человека, в кн.: Вопр. морфол. периферической нервной системы, под ред. Д. М. Голуба, в. 5, с. 19, Минск, 1960, библиогр.; Парин В. В. и Меерсон Ф. З. Очерки клинической физиологии кровообращения, М., 1965, библиогр.; Петровский Б. В. и Кешишева А. А. Хирургическое лечение открытого артериального протока. М., 1963, библиогр.; Пэттен Б. М. Эмбриология человека, пер. с англ., с. 604, М., 1959, библиогр.; Рентгенодиагностика заболеваний сердца и сосудов, под ред. М. А. Иваницкой, М., 1970; Сакович А. Н. Форма и положение артериального (боталлова) протока, Труды Крымск. мед. ин-та, т. 30, с. 279, Симферополь, 1961; Barclay A. E., Franklin K. J. а. Prichard M. L. The foetal circulation, Oxford, 1945, bibliogr.; Condorelli M. i a. Sulla funzionalita' del dotto di Botallo ne primi giorni della vita extrauterina, Boll. Soc. ital. Biol, sper., v. 33, p. 1599, 1957; Danesino V. L., Reynolds S. R. M. a. Pehman I. H. Comparative histological structure of the human ductus arteriosus according to topography, age and degree of constriction, Anat. Rec., v. 121, p. 801, 1955, bibliogr.; Gerard G. Le canal artériel, J. Anat. (Paris), t. 36, p. 1, 1900; Peckholz I. Mikroskopisch-anatomische Untersuchungen zur orthologie des Ductus arteriosus Botalli vom Menschen unter Berücksichtigung einiger pathologischer Befunde, Z. mikr. - anat. Forsch., Bd 62, S. 229, 1956, Bibliogr.; Sciacca A. a. Condorelli M. Involution of the ductus arteriosus, Basel - N. Y., 1960, bibliogr.
Источники:
- Большая медицинская энциклопедия. Том 2/Главный редактор академик Б. В. Петровский; издательство «Советская энциклопедия»; Москва, 1975.- 608 с. с илл., 8 л. вкл.
|
ПОИСК:
|
© Анна Козлова подборка материалов; Алексей Злыгостев оформление, разработка ПО 2001–2019
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'