АНТИГЕН - АНТИТЕЛО РЕАКЦИЯ
Расстановка ударений: АНТИГЕ`Н - АНТИТЕ`ЛО РЕА`КЦИЯ
АНТИГЕН - АНТИТЕЛО РЕАКЦИЯ - образование комплекса между антигеном и направленными к нему антителами. Изучение А. - а. р. имеет большое значение для понимания механизма специфического взаимодействия биологических макромолекул и для выяснения механизма серологических реакций.
Различают две фазы реакции, существенно отличающиеся между собой по механизму и скорости протекания. В первой фазе реакции происходит соединение детерминантной группы антигена (см.) или гаптена (см.) с группировками в активном центре антитела (см.). Этот высокоспецифический процесс протекает в водных растворах с большой скоростью. Антитела обладают минимум двумя (антитела IgG-класса) и максимум десятью (для IgM-антител) активными центрами, к-рые конфигурационно комплементарны детерминантной группе антигена. Поэтому с поливалентным антигеном (т. е. с антигеном, содержащим несколько детерминантных групп) может происходить образование сложных по составу агрегатов антиген - антитело с молекулярной формулой: (Ат)x (Аг)y, где Ат - антитело и Аг - антиген. Агрегаты этого иммунного комплекса утрачивают растворимость в изотонических растворах и выпадают в осадок. Эта вторая неспецифическая фаза А. - а. р. протекает медленнее первой - специфической, причем ее скорость зависит от многих внешних факторов и в первую очередь от солевого состава среды. Характер реакций, протекающих во второй фазе, определяется в значительной мере физическими свойствами антигена. В случае, если в реакции участвуют низкодисперсные антигены (клетки, частицы инертного носителя с адсорбированным на них антигеном), наблюдается феномен агглютинации (см.). Высокодисперсные антигены (полисахариды, белки и их комплексы) образуют с антителами преципитаты (флоккуляты). В ходе второй фазы А. - а. р. происходит также присоединение к иммунному комплексу комплемента (см. Комплемент, Реакция связывания комплемента), что также служит высокочувствительным серологическим тестом. На основании сведений о механизмах, лежащих в основе второй фазы А. - а. р., представляется возможным подойти к объяснению таких важных в иммунологическом отношении следствий формирования иммунного комплекса, как нейтрализация токсина антитоксином (см. Токсин - антитоксин реакция), активация системы комплемента, реакция немедленной гиперчувствительности и пр. Вместе с тем необходимо иметь в виду, что трудно судить о специфической стадии А. - а. р. на основании существенно иной по механизму второй фазы реакции. В силу этого исследования тонких физических и химических механизмов А. - а. р. осуществляются преимущественно с использованием гаптенов с одной детерминантной группой, к-рые способны образовывать с направленными к ним антителами только растворимые комплексы.
В случае бивалентных антител (напр., антител класса IgG) их реакцию с моновалентным гаптеном (Г) можно записать в виде уравнения:
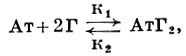
где к1 и к2 - соответственно константы скоростей прямой и обратной реакций. В силу того что при реакции гаптена со специфическим антителом не происходит каких-либо видимых превращений, судить о взаимодействии приходится с помощью различных физических и физико-химических методов, основанных на оценке количества связанного гаптена по изменению диффузионного равновесия последнего в присутствии антитела (метод равновесного диализа), либо по изменению оптических свойств гаптена в иммунном комплексе. Величина константы скорости прямой реакции, полученная в эксперименте, достигает 106-107л·моль-1сек-1, в то время как обратная реакция значительно медленнее: 1-50 сек-1. Недостаточное совершенство измерительной техники не позволяет оценить максимальную скорость прямой реакции; из теоретических соображений она могла бы достигать величины 1,5×109л·моль-1сек-1.
В силу столь больших скоростей прямой реакции соединение антитела с гаптеном завершается уже в процессе смешивания реагентов. Поэтому на практике существенно проще измерять константу сродства (ка=к1/к2), величина к-рой для ряда систем, рассчитанная с использованием метода равновесного диализа, находится в пределах 105-109л/моль.
На основании данных о величине ка при различных температурах по уравнению Вант-Гоффа можно вычислить термодинамические параметры реакции гаптен - антитело.
Изменения свободной энергии (ΔF) при взаимодействии гаптен - антитело имеют порядок величин от -7 до -12 ккал/моль. Это означает, что даже при высоких разведениях степень ассоциации остается еще значительной. Хотя в ряде случаев не отмечались существенные изменения энтропии при формировании комплекса гаптен - антитело (ΔS=0), для многих систем были получены положительные значения ΔS, указывающие на увеличение энтропии, а не на ее уменьшение, что следовало бы ожидать в силу большей упорядоченности системы при образовании иммунного комплекса. Наблюдаемый эффект обусловлен, по-видимому, тем, что гаптен экранирует поверхность активного центра антитела с высвобождением ранее связанных с ней молекул воды. В пользу этого свидетельствуют в свою очередь данные о значительном увеличении парциального специфического объема при реакции гаптен - антитело, полученные с помощью дилатометрии (см.).
До последнего времени многие вопросы, касающиеся механизма А. - а. р., остаются открытыми. О природе связей между детерминантной группой антигена и группировками в активном центре антитела можно судить на основании оптических свойств связанного гаптена.
Так, с помощью спектрофотометрии и спектрофлуориметрии было установлено для ряда гаптенов (представляющих собой ароматические соединения), что при связывании со специфическим антителом они оказываются в неполярном микроокружении и, следовательно, способны фиксироваться в активном центре за счет гидрофобных взаимодействий. В случае антител к нитрофенильным производным было продемонстрировано образование в активном центре комплекса с переносом электрона между остатком триптофана и гаптенной группировкой. Наконец, не вызывает сомнения возможность образования между аминокислотными остатками в активном центре антитела и детерминантными группами антигенов водородных связей и дальнодействующих электростатических взаимодействий. Все это, однако, не объясняет с достаточной ясностью механизм специфической фазы реакции антиген - антитело. Судя по данным, полученным с помощью физических и других методов, в момент связывания антителом детерминантной группы антигена возникает конформационная перестройка собственно активного центра антитела и расположенных вне его участков молекулы. При этом молекула антитела становится более устойчивой к различным денатурирующим воздействиям, равно как и к гидролизу протеолитическими ферментами. Очевидно, в процессе связывания детерминантной группы антигена происходит адаптация к нему активного Центра антитела; этот процесс может быть подобен перестройке активного Центра фермента при связывании субстрата.
Взаимодействие молекулы антигена с антителом или его активным Fab-фрагментом сопровождается изменениями пространственной структуры молекулы антигена. Так, миоглобин превращается в апомиоглобин при взаимодействии с антителами, направленными к апомиоглобину, а неактивная, полученная от соответствующих мутантов β-галактозидаза превращается в активный фермент после реакции с антителами к активной форме β-галактозидазы. В экспериментах с синтетическими полипептидами, использованными в качестве антигенов, было отчетливо продемонстрировано, что антитела к ос-спиральной форме полипептида способны стабилизировать эту структуру и, более того, обеспечивать структурный переход пептидов из формы неупорядоченного клубка в α-спираль. Следует подчеркнуть, что наблюдаемые под действием антител структурные переходы в молекуле антигена происходят в процессе первой фазы реакции, а не за счет эффектов, возникающих при агрегации иммунных комплексов. Это несомненно в силу того, что структурные перестройки в антигене вызывают одновалентные активные Fab-фрагменты антител, неспособные обеспечить агрегацию антигена.
В силу структурной гетерогенности антител найденные в эксперименте константы сродства (ка) данного гаптена к антигену представляют собой усредненную величину многих констант, отражающих особенности связывания гаптена различными молекулами антител. Распределение антител по константам сродства описывается кривой Гаусса. Ввиду того что в составе популяции молекул антител всегда присутствуют такие, к-рые отличаются относительно низкой степенью сродства, число молекул гаптена, связанных на моль бивалентного антитела, достигает величины 2 только при заметном избытке гаптена. Путем преципитации антител к динитрофенильной группе возрастающими количествами специфического антигена удалось получить несколько фракций антител, отличающихся у одного и того же животного по сродству к гаптену на четыре порядка (от 1,0×105 до 1,1×109). При повторных иммунизациях величина ка для более поздних антител возрастает особенно заметно в том случае, когда для иммунизации применяются небольшие количества антигена. Очевидно, антиген соединяется в организме в первую очередь с рецепторами предшественников антителообразующих клеток, отличающихся наибольшим сродством к антигену. При иммунизации большими дозами антигена гетерогенность антител по величине ка возрастает за счет вовлечения в иммунный ответ клеток с антителоподобными рецепторами, характеризующимися низким сродством к антигену и обладающими способностью синтезировать только антитела с низкой степенью сродства.
При оценке кинетических параметров А. - а. р. часто прибегают к определению константы равновесия (к), к-рую рассчитывают в эксперименте по ингибированию А. - а. р. с помощью специфического гаптена на основании уравнения:
[АгАт] = к [ГАт] [Аг]/[Г],
где каждая величина в скобках означает молекулярную концентрацию вещества. Величина (к) в общем случае близка по значению величине ка. Метод ингибирования реакции преципитации нашел самое широкое применение для оценки структуры детерминантных групп природных антигенов - белков и полисахаридов. В этом случае в качестве гаптенов используют олигосахариды и пептиды, выделенные из природных соединений или полученные синтетическим путем.
Наряду с изучением механизма первой фазы А. - а. р. в течение многих лет идет интенсивное изучение второй фазы реакции и гл. обр. реакции преципитации (см.). Сейчас не вызывает сомнения, что феномен преципитации связан с образованием решетчатых структур благодаря поливалентной природе антигена и антитела. Теория "решетки", наиболее четко сформулированная впервые Марраком (J. R. Marrak), находит подтверждение в многочисленных фактах, основные из к-рых следующие: 1) одновалентные гаптены не дают реакции преципитации, в то время как при наличии в молекуле гаптена двух и более детерминантных групп преципитат в присутствии антитела, как правило, образуется; 2) полученные в результате расщепления молекулы антитела одновалентные Fab-фрагменты не преципитируют поливалентный антиген, хотя и соединяются с ним; 3) гибридные искусственно полученные бивалентные F(ab)2-фрагменты антител, каждый из моновалентных фрагментов к-рых принадлежит различным по специфичности молекулам антител, преципитируют лишь в присутствии обоих антигенов, к к-рым они направлены, и 4) бивалентные гаптены, содержащие две различные по структуре детерминантные группы, способны образовывать преципитат лишь в присутствии антител к обеим детерминантным группам. Прямые доказательства образования решетчатых структур при формировании преципитата были получены с помощью электронной микроскопии. Схематически эти структуры представлены на рис. 1.
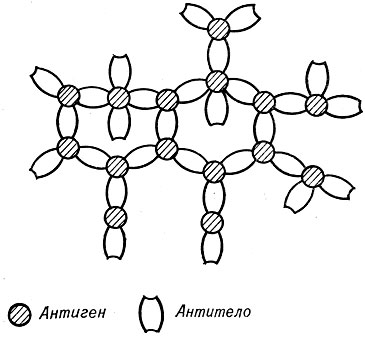
Рис. 1. Схема решетчатой структуры иммунного преципитата
Наличием минимум двух валентностей у антигена и антитела не исчерпываются требования, необходимые для формирования иммунных преципитатов, а также для реализации других процессов, протекающих во второй фазе реакции антиген - антитело. Так, хотя антитела, относящиеся к классам IgA и IgE, содержат по два активных центра, они по существу лишены способности участвовать в реакциях преципитации и агглютинации и связывать комплемент в присутствии специфического антигена. По-видимому, основные различия между преципитирующими и непреципитирующими антителами кроются в способности первых образовывать мостики между молекулами антигена либо в силу наперед заданного особенностями структуры большого расстояния между активными центрами (как это имеет место в случае антител IgM-класса), либо при условии достаточной гибкости молекулы антитела, обеспечивающего возможность увеличения расстояния между активными центрами в присутствии антигена. Последнее присуще антителам IgG-класса благодаря вращению Fab-фрагментов, несущих активные центры в отношении Fc-фрагмента (см. Антитела). Так, согласно данным электронной микроскопии в присутствии низкомолекулярного бивалентного гаптена, взаимодействующего с обоими активными центрами антитела, угол между Fab-фрагментами составляет 10°, но может увеличиваться до 180° при соотношении гаптен - антитело (или антиген - антитело), обеспечивающем образование крупных агрегатов, в состав к-рых входит 4 и более молекул антител. Указанные изменения конформации молекулы антитела IgG-класса представлены на рис. 2. После взаимодействия с антигеном молекула антитела превращается из Y-образной в стержнеобразную с максимально удаленными друг от друга активными центрами, расположенными на дистальных концах Fab-фрагментов.
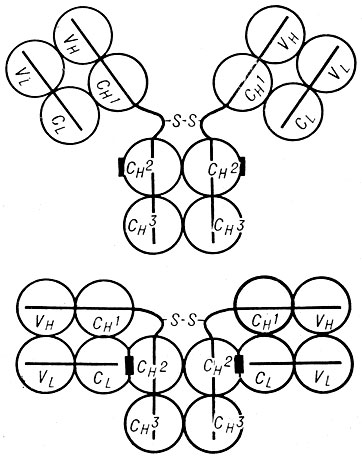
Рис. 2. Конформация молекулы антитела класса IgG до взаимодействия с антигеном (вверху) и в составе иммунного комплекса, образованного в зоне эквивалентности (внизу). VL и CL - основные структурные субъединицы (домены) легкой цепи, VH, CH1-CH3 - домены тяжелой цепи. Черный прямоугольник - комплементсвязывающий центр. Активный центр сформирован и VH- и VL--доменами, входящими в состав Fab-фрагмента
Необходимость конформационной перестройки антител IgG и IgM классов при участии антигена очевидна и для реализации других процессов, протекающих во второй фазе А. - а. р., и, в частности, для активации системы комплемента. Эти конформационные изменения затрагивают область молекулы, содержащую специализированный центр для связывания первого компонента комплемента (см. Комплемент, Реакция связывания комплемента). В результате структурной перестройки этого центра, расположенного в Fc-фрагменте (рис.2), по-видимому, возрастает его сродство к первому компоненту комплемента, что необходимо для превращения последнего в активный фермент - CI-эстеразу. Несомненные доказательства изменения третичной структуры молекулы антитела при образовании ими комплексов с антигеном в зоне эквивалентности (т. е. при соотношении реагентов, обеспечивающих максимальную преципитацию и связывание комплемента) были получены методом дисперсии оптического вращения. Необходимо подчеркнуть, что увеличение отрицательного левовращения антител наблюдалось именно в составе указанных комплексов и не имело места в комплексах, образованных в избытке антигена. Это показывает, что конформационные изменения в больших по размеру иммунных агрегатах связаны с изменениями структуры участков молекулы антитела, расположенных вне области их активных центров. Т. о., необходимо констатировать возникновение двух видов конформационных изменений молекулы антитела после ее взаимодействия с антигеном. Первые из них, как указывалось выше, возникают непосредственно в области активного центра антитела и в его ближайшем окружении в ходе первой фазы реакции вне зависимости от степени агрегированности иммунного комплекса. Вторые возникают непосредственно во второй фазе реакции в результате формирования агрегатов, включающих не менее двух-четырех молекул антител, и сопряжены со структурной перестройкой удаленных от активного центра областей молекулы антитела, в частности его Fc-фрагмента.
Значительный интерес представляет вопрос о диссоциации комплекса антиген - антитело, к-рый включает в себя проблему обратимости конформационных изменений молекулы антитела, сопровождающих процесс ее взаимодействия с антигеном. Выше уже отмечалось, что обратная реакция антиген-антитело протекает значительно медленнее прямой. В зоне эквивалентности в состав иммунного комплекса вовлекаются целиком как антиген, так и антитело, в силу чего практически ощутимой диссоциации при этом не наблюдается. Однако диссоциация иммунного комплекса в относительно мягких условиях все же возможна уже хотя бы потому, что между партнерами реакции возникают лишь нековалентные взаимодействия. Можно выделить два основных пути, с помощью к-рых может быть частично или полностью разделен уже сформировавшийся комплекс антиген - антитело. Первый состоит в вытеснении антител избытком антигена (гаптена), а второй - в воздействии на иммунный комплекс внешних факторов, приводящих к разрыву связей (уменьшению сродства) между антигеном и антителом.
Уже при промывании иммунного преципитата физиологическим раствором из его состава можно выделить постоянно уменьшающиеся количества антител и лишь следовые количества антигена. Процесс диссоциации можно записать в форме уравнения:
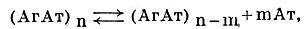
где n и m соответствуют числу молекул Аг и Ат в комплексе и числу свободных молекул Ат.
Эффективность диссоциации иммунного комплекса существенно возрастает в присутствии большого избытка антигена (гаптена). На практике для этой цели используют моновалентные гаптены, характеризующиеся относительно небольшой степенью сродства к антителам и способные вытеснять из комплекса в первую очередь антитела с относительно низким сродством к антигену. Естественно, антитела элюируются в форме комплекса с гаптеном. Последний в силу относительно низкого сродства к антителу может быть удален либо продолжительным диализом, либо с применением ионообменной хроматографии. Примером такого метода изоляции антител может служить выделение антител к динитрофенильной группе с использованием в качестве гаптена динитрофенола.
Частичная диссоциация комплекса антиген-антитело может быть достигнута в общем случае при повышении температуры. Исходя из того, что А. - а. р. является экзотермической, вполне закономерно, что большинство комплексов антиген - антитело, сформированных при t° 0° может быть хотя бы частично диссоциировано при повышении t° до 40° и выше. Степень термической диссоциации существенно варьирует в зависимости от природы антитела. Особенно эффективно диссоциируют при t° 37-40° иммунные комплексы, образованные так наз. Холодовыми антителами, направленными, как правило, к антигенам мембраны эритроцитов.
Наиболее универсальным способом диссоциации иммунных комплексов, образованных самыми разнообразными антителами, служит их обработка разбавленными кислотами и щелочами, а также концентрированными растворами амидов (мочевины, солянокислого гуанидина). Увеличение константы диссоциации комплекса антиген - антитело в этих условиях связано, очевидно, с разрывом нековалентных связей и изменением конформации молекулы антитела (антигена), сопровождающихся, в частности, перестройкой активного центра антитела и детерминантной группы антигена. В числе диссоциирующих комплекс антиген - антитело агентов использовались также полианионы (полиметакрилат и полистиролсульфонат) и концентрированные растворы нейтральных солей.
Обратимость конформационных изменений антитела после его извлечения из иммунного Комплекса нуждается еще в дальнейшем изучении. При элюции антител кислотой или Щелочью (особенно последней) закономерно отмечают снижение их прецилитирующей активности, хотя способность связывать антиген остается, по-видимому, без существенных изменений. Незначительно изменяется сродство антител и после их элюции концентрированной мочевиной. Судя по этим данным, структура активного центра антитела, извлеченного из иммунного комплекса, возвращается в целом к исходной. Необратимые изменения, по крайней мере у части молекул, претерпевают структуры, ответственные за способность антител участвовать во второй фазе А. - а. р. В свете современных представлений о механизме А. - а. р. и механизме реакции преципитации можно допустить, что у антител, извлеченных из иммунного комплекса щелочью или кислотой, уменьшается свобода вращательных движений Fab-фрагментов молекулы, хотя нельзя исключить и другие повреждения.
Библиогр.: Волькенштейн М. В. Физика ферментов, М., 1967, библиогр.; Гауровиц Ф. Иммунохимия и биосинтез антител, пер. с англ., М., 1969, библиогр.; Кульберг А. Я. Молекулярные основы эффекторных функций иммуноглобулинов, Усн. совр. биол., т. 7 6, № 1, с. 110,1973, библиогр.; Кэбот Э. и Мейер М. Экспериментальная иммунохимия, пер. с англ., М., 1968, библиогр.; Незлин Р. С. Строение биосинтеза антител, М., 1972; Руководство по иммунологии, под ред. О. Е. Вязова и Ш. Х. Ходжаева, М., 1973; Cathou R. E. a. Werner T. C. Hapten stabilization of antibody conformation, Biochemistry, v. 9, p. 3149, 1970; Edelman G. M. a. Gall W. E. The antibody problem, Ann. Rev. Biochem., v. 38, p. 415, 1969, bibliogr.; Green N. M. Electron microscopy of the immunoglobulins, Advanc. Immunol., Y. 11, p. 1, 1969, bibliogr.; Marrack J. R. a. Richards C. B. Light-scattering studies of the formation of aggregates on mixtures of antigen and antibody, Immunology, v. 20, p. 1019, 1971, bibliogr.; Ohta Y., Gill T. J. a. Leung C. S. Volume changes accompanying the antibody-antigen reaction, Biochemistry, v. 9, p. 2708, 1970; Schechter B., Conway-Jacobs A. a. Sela M. Conformational changes in a synthetic antigen induced by specific antibodies, Europ. J. Biochem., v. 20, p. 321, 1971.
Источники:
- Большая медицинская энциклопедия. Том 2/Главный редактор академик Б. В. Петровский; издательство «Советская энциклопедия»; Москва, 1975.- 608 с. с илл., 8 л. вкл.
|
ПОИСК:
|
© Анна Козлова подборка материалов; Алексей Злыгостев оформление, разработка ПО 2001–2019
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'