АНАЭРОБНАЯ ИНФЕКЦИЯ
Расстановка ударений: АНАЭРО`БНАЯ ИНФЕ`КЦИЯ
Содержание
История Статистика Этиология Эпидемиология Патологическая анатомия Патогенез Классификация форм анаэробной инфекции Клиническая картина, диагностика и прогноз Лечение Профилактика
Анаэробная инфекция (греч. отрицательная приставка an-, aēr — воздух и bios — жизнь; син.: газовая гангрена, газовая флегмона, злокачественный отек, молниеносная гангрена, коричневая флегмона) — грозная раневая инфекция, вызываемая патогенными анаэробами, характеризующаяся быстро наступающим и распространяющимся некрозом тканей, их распадом, обычно с образованием газов, тяжелой общей интоксикацией и отсутствием выраженных воспалительных явлений.
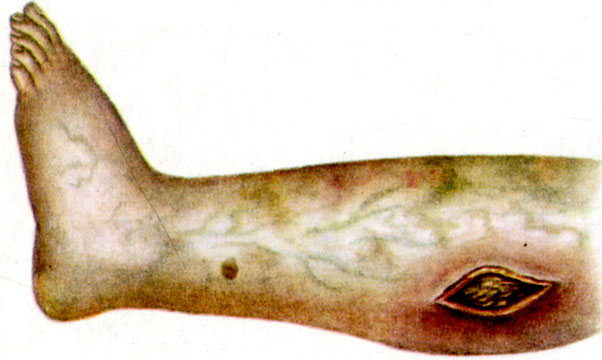
Анаэробная инфекция голени (газовая гангрена)
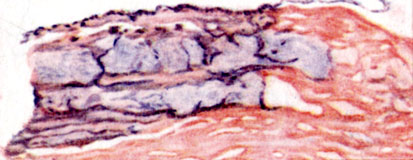
Газовая гангрена. Некроз. Образование пузырей газа
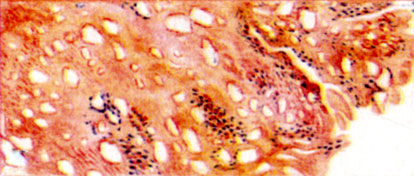
Газовая гангрена. Некроз и кровянистое пропитывание мышц. Образование пузырей газа
История
Можно считать, что первое описание клинических проявлений А. п. дал в своих трудах Гиппократ. В сочинениях Г а лена упоминается о появлении «воздуха» в области раненых мышц. Амбруаз Паре, по-видимому, описал А. и. под названием «госпитальной гангрены». В сочинениях Н. И. Пирогова клиника А. и. ран подробно описывается под названиями «местный ступор», «мефитическая гангрена», «острый злокачественный отек». В «Началах общей военно-полевой хирургии» Н. И. Пирогов говорит, что «первый признак перехода остросерозного и гнойного инфильтрата в гангренозный есть треск (крепитация), ощущаемый под кожей».
В 1899 г. Лиденталь и Хичман (О. Lidenthal, F. Hitschman) через 7 лет после открытия Cl. perfringens Уэлшем и Наттоллом (W. H. Welch, G. H. F. Nuttall) правильно оценили роль этого микроба в возникновении А. и.; они писали, что заболевание возникает в результате смешанной инфекции, но главная роль принадлежит Cl. perfringens. Смерть наступает в результате токсемии. Токсины выделяются микробами и образуются в результате разложения (протеолиза) белка.
Статистика
А. и. ран в мирное время возникает редко, поэтому основной статистический материал относится к военному времени. Частота А. и., возникающей как осложнение ран, зависит от многих факторов, из к-рых главнейшими являются характер ранения, срок и качество оказания хирургической помощи.
Частота анаэробных осложнений, по статистическим данным советских хирургов, выражается в следующих цифрах: по данным М. Н. Ахутина, частота А. и. во время боев у оз. Хасан (1938) составила 1,5%; во время боев в Монголии (1939) — 1,4%. Во время советско-финляндской войны (1939—1940) частота А. и., по М. Н. Ахутину, — 1,25%; по Н. Н. Бурденко — 0,8%; по С. И. Банайтису — 0,8%; по Б. А. Петрову — 2—4%; по М. Б. Рывлину — 2,4%.
По данным зарубежных авторов, относящимся к годам второй мировой войны, частота А. и. составляет: по Альтемейеру (W.A. Altemeier) — 4,2% , по Ленгли (F. Langley) — 1,6%,по Фишеру и Флори (G. H. Fisher, М. E. Florey) — 0,15%. Сравнивая
приведенные цифры, можно прийти к заключению, что А. и. огнестрельных ран возникает примерно у 1—2% раненых. Значение особенностей и локализации ран может быть охарактеризовано так: А. и. чаще всего возникает при осколочных ранениях тех участков конечностей, на к-рых имеются мощные мышечные массивы, заключенные в прочные костно-фасциальные футляры.
По многим статистическим материалам, 58—77% всех случаев А. и. возникало в ранах нижних конечностей (И. В. Давыдовский). По материалам нек-рых авторов (И. Ш. Блюмин, И. Б. Колоднер, А. Н. Беркутов и др.), наибольшее число случаев А. и. (35,8—46%) приходится на ранения бедра. Второе место занимают ранения голени, на долю к-рых приходилось от 27 до 35% случаев анаэробной инфекции. В других участках тела она встречается значительно реже. Так, на ранения плеча падает 10—12% , предплечья — 4%, ягодицы — 8,6%, стопы — 3,9%. Описывались и более редкие локализации А. и., такие как раны головного мозга (Н. И. Гращенков), раны печени (И. В. Давыдовский). Наиболее часто А. и. возникает в ранах, нанесенных осколками снарядов, что было подмечено еще Н. И. Пироговым, писавшим: «...особенно часто вспышки мефитической гангрены бывали после ранений артиллерийскими снарядами». Эта закономерность подтверждалась во всех войнах, в т. ч. и на опыте Великой Отечественной войны. По статистическим данным М. Н. Ахутина, 92% случаев А. и. возникало при осколочных ранениях.
Летальность при А. и. всегда была очень высокой. По статистическим данным, относящимся к первой мировой войне, она, по Н. Н. Петрову, колебалась в пределах 30—50%, по Н. Н. Бурденко — составила 60%, по А. Ф. Бердяеву — 54%, по А. А. Опокину — 40% . Примерно такие же цифры, по данным первой мировой войны, приводили и зарубежные хирурги. Так, летальность, по наблюдениям Омбреданна (L. Ombredanne), Лера (W. Lohr) составила 50—60%, Клозе (F. Klose) — 43—68%, Френкеля (A. Frankel) — 75%.
Летальность при А. и. во время Великой Отечественной войны во всех мед. учреждениях также была значительной.
Этиология
Возбудители А. и. — патогенные клостридии (см. Clostridium). Из них основными являются следующие.
Cl. perfringens типов А, В, С, D, E, F — короткие полиморфные палочки, без жгутиков, образуют субтерминальные споры, редко центральные. Клетки разных штаммов отличаются друг от друга размерами (0,6—1 мкм × — 8 мкм). В материале из раны и на среде с сывороткой образуют капсулу, грамположительны. На жидких средах (мясных или казеиновых) растут быстро (3—8 час.), давая равномерное помутнение с бурным газообразованием, изменяют рН среды в кислую сторону. Среда Вильсона — Блера чернеет и разрывается через 1—2 часа после посева, молоко бурно створаживается через 3—5 час. с образованием рыхлого сгустка. Медленно расплавляют свернутую сыворотку или вареные кусочки мяса, желатину разжижают. Все штаммы сбраживают (с образованием кислоты и газа) глюкозу, галактозу, мальтозу, лактозу, левулезу, сахарозу и не ферментируют маннит и дульцит. Нек-рые штаммы разлагают глицерин и инулин. Образуют гладкие колонии (S), слизистые (М) и шероховатые (R), могут образовывать и колонии смешанного (0) варианта.
Cl. perfringens делят на 6 типов по их способности вырабатывать 12 различных по антигенным свойствам летальных и некротических токсинов и ферментов, обозначенных буквами греческого алфавита: α, β, γ, δ, ε, η, θ, ι, κ, λ, μ,ν. Тип А вырабатывает в большом количестве α-токсин — лецитиназу С, к-рая обладает летальными, некротическими и гемолитическими свойствами и играет основную роль в патогенезе газовой гангрены. В значительно меньшем количестве этот токсин вырабатывают все остальные типы этого микроба. Cl. perfringens типа А вырабатывает также θ-токсин — гемолизин, κ-токсин — коллагеназу, μ-токсин — гиалуронидазу и, возможно, летальный η-токсин. Cl. perfringens типов В, С и F вырабатывает β-токсин — летальный, некротический яд — главный токсический фактор этих типов, а также в небольшом количестве γ-токсин. Типы В и С вырабатывают δ-гемолитический, летальный фактор, θ-гемолитический токсин, тип С — также κ-коллагеназу. Тип В может вырабатывать ε-токспн, λ-желатиназу. Тип D вырабатывает в большом количестве ε-токсин — сильный летальный, некротический протоксин, активируемый протеолитическими ферментами. Тип Е вырабатывает летальный ι-токсин. Все типы Cl. perfringens вырабатывают дезоксирибонуклеазу — ν-токсин. Основным возбудителем раневой А. и. является Cl. perfringens типа А, реже — другие типы.
Cl. oedematiens типа А, В, С и D — толстые крупные палочки (1—2 мкм × — 10 мкм), подвижны, имеют 20—25 жгутиков, капсулы нет, грамположительны. Споры овальные, субтерминальные, строгие анаэробы. Рост на жидкой среде сопровождается легким помутнением и рыхлым осадком, газообразование умеренное. Среда Вильсона—Блера чернеет через 16—24 часа. Протеолитические свойства слабые, молоко свертывается не ранее 12—24 час., желатину разжижает, свернутый белок не изменяет. Cl. oedematiens типов А, В, С, D ферментирует глицерин, глюкозу, фруктозу и мальтозу. Нек-рые штаммы типа В не разлагают глицерин. На кровяном или печеночном агаре образует серые бугристые колонии с приподнятым центром, изрезанными краями и с отходящими отростками. На кровяном агаре с бензидином колонии типов А и В при выдерживании на воздухе в течение 30—60 мин. постепенно чернеют, имеется зона гемолиза. В глубине агара формирует колонии в виде комочков ваты, снежных хлопьев пли линзы. Cl. oedematiens типов А, В и D вырабатывает 8 растворимых антигенов — токсинов и ферментов. Штаммы типов А и В образуют термолабильный летальный и некротический α-токсин, к-рый является сильным капиллярным ядом, нарушающим проницаемость стенки сосудов. Кроме того, тип А вырабатывает γ-токсин — лецитиназу, δ-токсин — кислородолабильный гемолизин, ε-токсин — липазу. Тип В вырабатывает β-токсин — лецитиназу, а также ζ-токсин — гемолизин и η-токсин — тропомиозиназу. У человека А. и. вызывает Cl. oedematiens типов А и В, тип С не патогенен.
Cl. septicum. Различают 2 типа (А и В). Полиморфная грам-положительная палочка (0,8 мкм × 4—5 мкм), подвижна (перитрих). Споры овальные, субтерминальные, капсулы нет. В зависимости от штамма и среды могут превращаться в короткие вздутые формы и длинные нити, к-рые часто обнаруживаются на серозной оболочке печени, селезенки или на диафрагме. Строгий анаэроб. На жидких средах растет, давая равномерное помутнение и газообразование. Среда Вильсона—Блера чернеет через 3—6 час. Молоко свертывает медленно, желатину разжижает. На поверхности плотных питательных сред образует блестящие полупрозрачные колонии диам. 4 мм с неровными бахромчатыми краями. На кровяном агаре образует колонии в виде капелек росы с зоной гемолиза. В глубине цгара )бразует колонии диам. 1—2 мм с уплотненным центром или радиально отходящими нитями. Разлагает глюкозу, лактозу, мальтозу, салицин, галактозу, фруктозу; не разлагает глицерин и маннит. Отдельные штаммы типа А и все штаммы типа В разлагают сахарозу. Не переваривает коагулированную сыворотку и яичный белок. Cl. septicum вырабатывает не менее 4 токсинов: α-токсин, обладающий летальными, некротическими и гемолитическими свойствами, β-токсин — дезоксирибонуклеазу, γ-токсин — гиалуронидазу и δ-токсин — кислородолабильный гемолизин. В фильтратах культур Cl. septicum обнаружены фибринолизин, коллагеназа и общий антиген с Cl. histolyticum, перекрестно нейтрализующийся антитоксическими сыворотками против этих бактерий. При внутримышечном заражении морской свинки Cl. septicum развивается типичная А. и.
Cl. histolyticum — небольшая палочка, имеет жгутики, подвижна, грамположительна, капсул не образует. Споры субтерминальные, в форме ракетки или игольного ушка. При росте на жидких средах дает помутнение без газообразования. Образует протеолитические ферменты, вызывающие быстрое растворение кусочков печени, мясного фарша, яичного белка в жидкой среде. Молоко быстро пептонизирует без заметного свертывания, желатину быстро разжижает. Углеводы не разлагает. Индола не образует, сероводород выделяет в большом количестве. Колонии на агаре столбиком компактны, мохнатые, неправильной формы. На кровяном агаре — мелкие, прозрачные, как капельки росы, с зоной гемолиза. Cl. histolyticum вырабатывает α-токсин — летальный и некротический фактор, β-антиген, или коллагеназу, к-рая разрушает нативный и денатурированный коллаген, азоколл и желатину.
Кроме коллагеназы, Cl. histolyticum вырабатывает γ-антиген — протеиназу, δ-антиген, к-рый разрушает эластические волокна, азоколл и желатину. Этот фермент в связи со способностью растворять эластические волокна назван эластазой. Введение 0,5 мл свежей культуры в мышцы морской свинки вызывает быстрое расплавление тканей и гибель животного через несколько часов или суток.
Cl. sordellii образует цепочки по 3—4 членика, капсулы нет, подвижна, иногда растет в виде длинных нитей. Легко образует овальные споры, на жидких средах вызывает резкое помутнение и газообразование. Обладает протеолитическими свойствами. Молоко полностью пептонизирует в течение 2—3 сут., разжижает желатину; ферментирует глюкозу, левулезу и мальтозу с образованием кислоты и газа, слабо — сахарозу. На агаре с кровью образует круглые или неправильной формы колонии зоной гемолиза. Вирулентные штаммы Cl. sordellii выделяют высокоактивный летальный токсин. Микроб выделяет также гиалуронидазу, кислородолабильный гемолизин типа θ-токсина, а также фибринолизин и другие протеолитические ферменты.
При экспериментальном заражении животное погибает от А. и. в течение 1—2 дней.
Помимо перечисленных, этиологическое значение могут иметь и другие клостридии: Cl. fallax, Cl. sporogenes, Cl. putrificus, Cl. bifermentans. Кроме того, раневой ботулизм следует рассматривать как А. и. Наконец, иногда при классической картине А. и. возбудителем может оказаться анаэробный стрептококк, что устанавливается только бактериологическим исследованием.
Бактериологический анализ материалов, взятых из раны при А. п., всегда обнаруживает микробные ассоциации различного состава, в к-рых наряду с анаэробами присутствует и другая микрофлора. Почти как правило, присутствуют гноеродные микробы — стафилококки, стрептококки, часто находят протея, си-негнойную палочку и других микробов. Несомненно, что эти ассоциации оказывают определенное влияние на течение заболевания.
См. также Анаэробы.
Эпидемиология
Естественная среда обитания анаэробов, в т. ч. возбудителей А. и., — кишечник животных, в особенности травоядных, а также всеядных (свиньи). В их кишечнике, как правило, находят Cl. perfringens, а нередко и других возбудителей А. и.; здесь они размножаются как сапрофиты, не вызывая заболевания животного. Из кишечника здорового человека ряд авторов также выделил наряду с другими анаэробами и Cl. perfringens. Хозяйственная деятельность человека — удобрение полей фекалиями, выпас скота и т. д. — способствует широкому распространению возбудителей А. и. во внешней среде, в первую очередь в почве. В нек-рых почвах при наличии питательных веществ, достаточной влажности и температуры патогенные анаэробы могут даже размножаться. Но и при неблагоприятных условиях внешней среды анаэробные бактерии способны сохраняться очень долгое время в состоянии спор; вместе с кормами они вновь попадают в кишечник животных.
Патогенные анаэробы нередко могут быть обнаружены на одежде и на коже человека, причем интенсивность обсеменения зависит от бытовых, сан.-гиг. условий и может быть весьма значительной. Очень распространено мнение, что в эпидемиологии А. и. боевых ран ведущее значение имеет почвенный фактор, следовательно, те географические, климатические и сезонные условия, к-рые определяют как состояние почвы, а значит и вероятность непосредственного попадания земли в рану, так и степень загрязненности почвенными анаэробами одежды солдат и их кожи. Между тем, сопоставляя многочисленные наблюдения, к-рые проводились в различных широтах при различной температуре и на различных почвах, можно заключить, что факторы климатические, почвенные, метеорологические и другие не оказывают решающего влияния на увеличение или уменьшение частоты осложнений А. и. Так, частота А. и. во время войны с Финляндией, когда боевые действия велись при очень низкой температуре, не отличалась от частоты, зарегистрированной Мак-Леннаном (J. D. Мас-Lennan) в Африке, Ленгли — в Тунисе и М. Н. Ахутиным — во время боев у реки Халхин-Гол в жаркую погоду.
Имеются наблюдения, показывающие, что процент ранений, осложненных А. и., колебался в госпиталях одной и той же группы, располагавшихся на одном месте, в одно и то же время года. Так, этот процент уменьшался в периоды, когда поступало небольшое число раненых, и увеличивался при массовом поступлении, особенно если оно продолжалось длительное время. Поскольку характер ранений, географические и сезонные условия оставались неизменными, единственной причиной увеличения числа осложнений в периоды массового поступления раненых следует считать удлинение сроков, отделяющих момент ранения от оказания хирургической помощи. Признание этого фактора в качестве главной причины может существенно снизить частоту А. и. Признание же ведущей роли состояния почвы, погоды или времени года демобилизует хирурга, т.к. эти причины не поддаются устранению.
В мирное время А. и. встречается спорадически, гл. обр. как осложнение тяжелой открытой травмы, транспортной или полученной при выполнении с.-х. работ. В редких случаях А. и. может возникать как послеоперационное осложнение, обычно за счет аутоинфекции. Cl. perfringcns у человека находили не только в кишечнике, но и в полости рта (при наличии кариозных зубов), у женщин — во влагалище. Cl. perfringens. находящийся во влагалище, изредка может служить источником А. и. в послеродовом периоде, а чаще после внебольничных абортов.
Описаны случаи возникновения А. и. после подкожных, внутримышечных и даже внутривенных инъекций. По мнению А. Н. Чистовича, возникновение А. и. в этих случаях вызвано введением большой дозы инфицированного материала, т. к. механическая травма сама по себе ничтожна.
Патологическая анатомия
Принято различать две классические формы А. и.: эмфизематозную (газовая гангрена, газовая флегмона) и отечную (злокачественный отек), к-рую связывают гл. обр. с заражением Cl. oedematiens. Деление это, однако, весьма условно, т. к. и при отечной форме газообразование также имеет место, хотя не всегда определяется клинически. Для той и другой формы А. и. характерно прогрессирующее омертвение тканей с их распадом и быстрое распространение патогенной микрофлоры за пределы раны.
Нет единого мнения по поводу анатомического субстрата, в первую очередь поражаемого А. и. Одни авторы считают таким субстратом мышечную ткань и склонны определять А. и. как клостридиальный миозит, другие, не отрицая особой тяжести и демонстративности изменений в мышцах, признают эти изменения вторичными, связанными с первичным поражением кровеносных сосудов при распространении возбудителя по межмышечным щелям и клетчатке сосудисто-нервных пучков. Распространение процесса по живым тканям происходит под влиянием токсинов и ферментов, таких, как коллагеназа, гиалуронидаза, протеаза, к-рые, обладая цитолитическими свойствами, прокладывают путь микробам. Бактериальные токсины, всасываясь из очага инфекции, оказывают и общетоксическое действие, проявляющееся в форме токсикорезорбтивной лихорадки. Прогрессирующий отек выражается накоплением свободной жидкости в тканевых пространствах, набуханием и растворением значительной части фибриллярных структур. В том случае, если живые ткани обладают достаточной сопротивляемостью, может образоваться ограниченный очаг, иногда в форме газового абсцесса.
Некротические изменения при А. и. наступают в различные сроки. Некротизируются мышцы, клетчатка, сосуды, нервы. Такие изменения особенно выражены в мышечной ткани, к-рая становится тусклой и серой (цвет вареного мяса). Иногда мышцы утрачивают присущую им упругость, легко растираются пальцами, а по консистенции представляют собой желеобразную массу (симптом «малинового лизиса тканей» по А. В. Мельникову). При эмфизематозных формах мышца становится пористой, т. к. вся интерстициальная ткань оказывается нафаршированной пузырьками газа (цветн. табл., смотри выше). При отечных формах преобладает пропитывание тканей жидкостью, а газообразование незначительно или отсутствует. Это является одним из характернейших симптомов отечной формы А. и. В большинстве случаев газообразование связано с заражением Cl. perfringens, хотя присутствие самых различных микробов, кроме Cl. perfringens, при распаде тканей может приводить к развитию процессов, сопровождающихся выделением газа. Газы, инфильтрирующие ткани при А. и., разнообразны по своему составу — в них может находиться метан, водород, углекислота. При прогрессировании распада, особенно под влиянием присоединившейся гнилостной микрофлоры, в газах обнаруживаются примеси сероводорода, аммиака и других дурно пахнущих хим. соединений. Изредка встречались случаи А. и. стопы, вызванной Cl. histolyticum. При этом наступало полное разжижение всех мягких тканей, кроме кожи и связочного аппарата, так что скелет стопы оказывался заключенным в кожный мешок, наполненный жидкостью. При А. и. иногда возникают метастатические очаги, к-рые чаще всего образуются в местах давления, уколов, ушибов, хотя иногда и в неповрежденной клетчатке. При А. и. возникают различные изменения и во внутренних органах. Эти изменения выражаются в гемолизе, образовании воспалительных и дегенеративно-некротических изменений во внутренних органах. Иногда возникают и подлинные септицемии — анаэробный сепсис (см.). Несмотря на значительные изменения внутренних органов при А. и., считается, что основной причиной летальных исходов в большинстве случаев является поражение ц. н. с. продуктами тканевого распада и микробными токсинами. Все же, по-видимому, нельзя считать, что причиной смерти от А. и. является поражение только ц. н. с. Смерть от А. и., видимо, результат воздействия токсинов на весь организм в целом, приводящего к возникновению функциональных и нек-рых морфологических изменений во многих органах и системах. Причины летальных исходов, установленные при вскрытиях, чаще всего распределяются следующим образом: 1) распространение специфического процесса и интоксикация — 85%; 2) пневмонии — 1,5%; 3) изменения, характерные для сепсиса, — 4,5%; 4) острая анемия — 2,1%; 5) специфический процесс в сочетании с тяжестью ранения — 1,3%; 6) метастатические очаги анаэробной инфекции — 0,5%; 7) причина не установлена — 0,5%.
О причинах летальных исходов зарубежные хирурги высказываются очень неопределенно и считают, что природа токсемии еще недостаточно изучена, так же как и «жизненные центры», на к-рые действуют токсины, хотя в то же время большинство авторов считает, что в патогенезе роль клостридиальных токсинов не подлежит сомнению [Хамптон (О. Hampton), Патерфорд и Эванс (R. Putherford, I. R. Evans), Тарбиат (S. Tarbiat) и др.].
Патогенез
Факт частого возникновения А. и. при осколочных ранениях связан с особенностями патогенеза этого раневого осложнения. Осколочные ранения отличаются тем, что в них всегда находится большое количество некротических тканей и тканей с резко пониженной жизнеспособностью; кроме того, при осколочных ранениях более выражена так наз. сила бокового удара, т. е. распространение энергии ранящего снаряда в сторону от раны, в результате этого дополнительно повреждаются значительные участки тканей. В поврежденных тканях быстро развивается травматический отек, и они сдавливаются в прочном апоневротическом футляре, сдавливаются и мелкие сосуды мышц, нарушается микроциркуляция и, следовательно, снабжение тканей кислородом. В результате образуется участок ишемизированных тканей, в к-рых анаэробы находят благоприятные условия для размножения.
Действие силы бокового удара вызывает длительный спазм и более крупных артерий, что еще больше нарушает кровоснабжение. Особенно значительные участки ишемизированных тканей образуются после перетягивания конечности кровоостанавливающим жгутом. Действие энергии ранящего снаряда распространяется и на нервные стволы, временно нарушая их функцию, вследствие чего изменяются и нейротрофические процессы в зоне ранения. Осколочные раны всегда имеют сложное строение, и нек-рые участки раны часто недостаточно аэрируются, чем также создаются благоприятные условия для развития анаэробных микробов. Нужно при этом учитывать и то, что масштабы микробного загрязнения осколочных ранений всегда довольно значительны, поскольку осколки часто увлекают в рану обрывки одежды, обуви, частицы земли. Следовательно, в механизме развития А. и. участвует ряд факторов, причем ведущими следует считать особенности очага повреждения, в к-ром наряду с некротическими тканями образуются участки тканей с нарушенной микроциркуляцией, находящиеся в условиях ишемии и кислородной недостаточности. Микробное загрязнение раны можно считать фактором, действующим только в зависимости от определенных условий, создающихся в очаге повреждения. Известно, что загрязнение раны патогенными анаэробами (в т. ч. Cl. perfringens) имеет место значительно чаще, чем А. и. раны. Более редкое, спорадическое появление А. и. при неогнестрельных ранениях можно объяснить тем, что при таких повреждениях редко создаются условия, благоприятные для развития анаэробных микробов.
Огнестрельные переломы значительно более подвержены А. и., чем ранения мягких тканей. Эта закономерность выражена тем отчетливее, чем меньше мышечные массы поврежденного сегмента. Так, по наблюдениям А. Н. Беркутова, 49% случаев А. и. бедра регистрировалось при ранении мягких тканей и 51 % — при огнестрельном переломе, на голени же 30% случаев А. и. было при ранениях мягких тканей и 70% — при огнестрельных переломах, на предплечье — соответственно 10 и 90%. Значение перелома как фактора, способствующего развитию А. и., было установлено и при экспериментальных исследованиях. Так, в опытах Г. П. Ковтуновича даже после введения 100 млн. отмытых микробных тел в мышцы бедра морским свинкам А. и. не развивалась; в тех же случаях, когда после введения микробов производился перелом кости, А. и. развилась почти во всех случаях. Значение повреждения кости в развитии А. и., особенно при огнестрельном ранении, можно объяснить, во-первых, тем, что архитектура мышечно-костной раны отличается большей сложностью по сравнению со строением раны мягких тканей; во-вторых, при огнестрельном переломе зона поврежденных тканей увеличивается разлетающимися свободными костными осколками и, наконец, при огнестрельном переломе более значительная, чем при ранениях мягких тканей, часть энергии ранящего снаряда передается тканям.
Классификация форм анаэробной инфекции
Существует очень большое число классификаций форм А. и. В Европе и Америке после первой мировой войны большое распространение получила классификация Вейнберга — Сегена (М. Weinberg, P. Seguin), по к-рой все случаи А. и. предлагается разделить на две группы: 1) вирулентную газовую гангрену и 2) авирулентную. Группа вирулентной А. и. разделяется напять форм: 1) эмфизематозную, или классическую; 2) отечную, или токсическую-3) смешанные формы; 4) гнилостные формы; 5) флегмонозную форму. По мнению авторов, их классификация до нек-рой степени указывает и на микробные ассоциации, вызывающие те или иные клинические формы.
Классификация Вейнберга—Сегена, будучи достаточно полной очень статична, т. к. в ее определениях не приводится никаких особенностей, характеризующих течение инфекционного процесса. В СССР (официальные «Указания по военно-полевой хирургии») принята классификация А. и., предложенная А. Н. Беркутовым в 1951 г., учитывающая быстроту распространения процесса, клинико-морфологические показатели и анатомические особенности процесса (табл.).
| По темпу распространения | По клинико-морфологическим показателям | По анатомическим особенностям |
|---|---|---|
| Быстро распространяющиеся | Газовые формы | Глубокие |
| Медленно распространяющиеся | Газово-отечные формы | Поверхностные |
| Гнилостно-гнойные формы |
Пользуясь этой классификацией, можно всегда сформулировать динамический диагноз, к-рый в какой-то степени служит и руководством к действию. Напр., диагноз «быстро распространяющаяся глубокая форма анаэробной инфекции» явно указывает на необходимость применения быстрых и иногда очень радикальных способов лечения.
В США распространена классификация, согласно к-рой клинические проявления А. и. систематизируются следующим образом.
I. Травматические раневые инфекции. 1. Простое загрязнение. 2. Анаэробный целлюлит. 3. Анаэробный мионекроз: а) клостридиальный мионекроз; б) стрептококковый мионекроз. II. Нетравматические инфекции. 1. Идиопатические. 2. Инфицированная сосудистая гангрена.
Под термином «простое загрязнение» понимается только нахождение клостридиальной флоры в медленно заживающей ране без выраженной общей реакции.
К анаэробным целлюлитам относят случаи массивного клостридиального загрязнения раны, когда инфекционный процесс развертывается в нежизнеспособных тканях, не выходя за их пределы, причем здоровые мышцы не поражаются. Анаэробный целлюлит ранее описывался под названием «газовый абсцесс» или «локализованная форма газовой гангрены».
Под названием «клостридиальный некроз» или «клостридиальный миозит» понимаются классические клинические проявления А. и. с прогрессирующим некрозом и распадом мышечной ткани, с выраженной интоксикацией организма. Стрептококковый мионекроз клинически не отличается от клостридиального и диагностируется только на основании бактериологических исследований. При анаэробном целлюлите в раневом отделяемом находят много лейкоцитов и грамположительных палочек и другую флору; при клостридиальном мионекрозе мало лейкоцитов, присутствуют грамположительные палочки и другая флора; при стрептококковом мионекрозе в отделяемом много лейкоцитов, отсутствуют грамположительная и другая флора, кроме стрептококков, к-рые обнаруживаются в большом количестве.
Клиническая картина, диагностика и прогноз
Течение А. и. может быть молниеносным, быстро прогрессирующим и торпидным. При молниеносном течении уже спустя несколько часов после ранения развиваются грозные явления, приводящие к смерти через 1—2 суток; лечение в большинстве случаев оказывается неэффективным. При быстро прогрессирующем течении признаки осложнения появляются не ранее 24 час. после ранения (обычно через 2—3 суток); смерть может последовать через 4—6 дней; этот вид встречается наиболее часто. Торпидное течение характеризуется поздним (не ранее 5—6-го дня) развитием А. и., распространение ее идет медленно и к летальному исходу может приводить через 2—3 недели и позже. При быстро прогрессирующем, а тем более при торпидном течении А. и. жизнь раненого может быть спасена своевременными и радикальными лечебными мероприятиями. Наиболее благоприятная форма А. и. — позднее образование газового абсцесса, обычно вокруг инородного тела или осколка кости.

Рис. 1. Газовая гангрена. Газ в мышцах. Рисунок «елочки» (рентгенограмма)
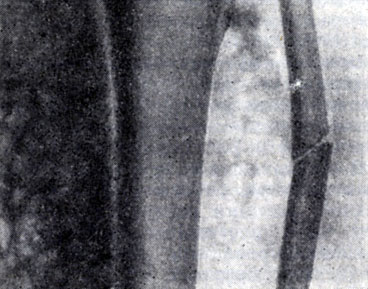
Рис. 2. Газовая гангрена. Газ в подкожной клетчатке. Рисунок «пчелиных сот»
Диагностика А. и. должна быть очень ранней, т. к. при быстро распространяющихся формах токсемия в короткие сроки приобретает необратимый характер. Для ранней диагностики А. и., особенно при массовом поступлении раненых, нужно еще до снятия повязки и до осмотра раны искать подозрительные симптомы этого осложнения. При этом уделяется особое внимание тем раненым, у к-рых имеются ранения конечностей, особенно осколочные ранения бедра, голени (тем более если имеется огнестрельный перелом) и ягодичной области. В самом начальном периоде А. и. отмечается нек-рое возбуждение раненого, говорливость и беспокойство, часты жалобы на боли в ране, к-рые иногда характеризуют как «распирающие», или на чувство полноты в конечности, на сдавление якобы туго наложенной повязкой. Наркотики часто не устраняют боли, и раненый проводит ночи без сна (симптом бессонной ночи). Очень патогномонично резкое учащение пульса — 110—120 уд. в 1 мин., температура тела обычно колеблется в пределах 38—38,5°. В более поздних стадиях появляется легкая иктеричность склер, что может быть следствием гемолиза. Еще позже, при наступившей тяжелой интоксикации, появляется эйфория, изменения лица типа fades hippocratica. При осмотре области ранения, особенно после снятия повязки, можно определить степень развития отека, а при эмфизематозных формах с помощью перкуссии и пальпации обнаружить газовую крепитацию и высокий тимпанический звук. При осмотре раны определяются размеры отека и область распространения газа. При этом, помимо перкуссии и пальпации, следует использовать аускультацию фонендоскопом: надавливая мембраной на кожу в области раны, удается услышать хруст пузырьков газа в самых начальных стадиях газообразования. Меньшее значение имеет так наз. симптом бритвы — особый звонкий хруст волосков, сбриваемых с окружности раны. Важный ранний признак А.и. — болезненность при пальпации по ходу сосудистого пучка, проксимальнее области ранения. Характерным признаком А. и. служит распространение отека на далекое расстояние от раны или отек всего поврежденного сегмента. Для наблюдения за нарастанием отека предлагали (Н. Н. Бурденко, А. В. Мельников) обвязывать конечность шелковой нитью и по степени ее врезания судить об увеличении отека. Этот признак недостоверен, т. к. обнаруживается и при неосложненных (напр., закрытых) переломах с нарастающим травматическим отеком. Кроме того, его выявление ведет к потере времени. В окружности раны иногда можно обнаружить ландкартообразные пятна кровоизлияний необычной окраски (цветн. табл., ст. 521, рис. 10) и подэпидермальные пузыри. Цвет пятен обусловил такие наименования А. и., как «коричневая флегмона», «бронзовая рожа», «белая рожа», «голубая флегмона». Цвет пятен непостоянен (по мере разложения экстравазата он может изменяться) и связи с характером микрофлоры не имеет. Внешний вид раны зависит в первую очередь от ее размеров: при небольшом раневом отверстии можно отметить только скудность отделяемого, к-рое имеет серозно-кровянистый характер. Иногда оно может быть пенистым (важный диагностический признак). При ране значительных размеров или при возникновении А. и. в уже рассеченной ране можно видеть изменения мышц, к-рые становятся восковидными, а в более поздние сроки — серыми («вареное мясо»). При значительном дефекте кожи и фасции или в рассеченной ране иногда можно видеть, что отечные мышцы выдаются (выпирают? из раны (симптом А. Ф. Бердяева). Запах отделяемого (запах сыра, кислой капусты, мышиный запах и т. д.) не является существенным симптомом, т. к. зависит от степени разложения мышечной ткани. Тяжелый зловонный запах отделяемого не характерен для А. и. и указывает на гнилостный процесс, вторично развившийся в омертвевших тканях.
Рентгенодиагностика. Очень убедительные диагностические данные можно получить с помощью рентгенографии. Она позволяет обнаружить такое ничтожное количество газа, к-рое не удается определить путем перкуссии и пальпации. Применение рентгенографии доказало, насколько условно деление форм А. и. на эмфизематозные и отечные. По рентгенограмме можно установить также, в каких тканях располагается газ, а значит — судить о глубине и распространенности процесса. В тех случаях, когда мышечная ткань импрегнирована газом, на рентгенограмме она представлена рисунком, напоминающим елочку (рис. 1).
При распространении газа только по подкожной клетчатке изображение напоминает рисунок пчелиных сот (рис. 2), ограниченное скопление газа свидетельствует о наличии газового абсцесса (анаэробного целлюлита — по американской терминологии).
Микробиологическая диагностика. Для бактериологического исследования при первичной операции берут экссудат, кусочки (2—3 г) измененной ткани из раны на границе со здоровой тканью, а также кровь из вены (5—10 мл).
Трупный материал (отделяемое раны, кусочки измененных мышц, кровь из сердца, кусочки селезенки и печени) следует брать не позже, чем через несколько часов после смерти во избежание посмертной инвазии патогенных анаэробов из жел.-киш. тракта.
Взятый материал помещают в стерильную герметически закрывающуюся стеклянную или пластмассовую посуду и срочно пересылают в бактериологическую лабораторию. Немедленно по поступлении материала в лабораторию пробы микроскопируют. Для этой цели готовят мазки-отпечатки и окрашивают их по Граму. Наличие в пробе крупных грамположительных палочек служит ориентировочным признаком А. и. Плотный материал стерильно измельчают ножницами и растирают в ступке со стерильным песком или толченым стеклом в равном объеме физиологического раствора. Кровь или экссудат центрифугируют при 3000 об/мин в течение 30 мин. и осадок засевают на среды(кровяной агар, среду Уиллиса—Хоббс, агар Вильсона—Блера и бензидиновый агар).
Посевы инкубируют в анаэробных з условиях при t° 37° (в микро- и макроанаэростате с пирогаллолом), посевы на среде Вильсона—Блера просматривают через 3—6 час., а посевы на других средах — на следующий день и затем каждый день до 7 сут. Выросшие колонии, вызывающие гемолиз на кровяном агаре, опалесценцию или появление перламутрового ореола на среде Уиллиса—Хоббс, почернение на среде Вильсона—Блера, почернение на бензидиновом агаре, проверяют на чистоту и наличие грамположительных палочек и затем пересевают в пробирки с жидкой мясной или казеиново-грибной средой под слоем вазелинового масла с кусочками мяса или ватой. Посевы инкубируют в термостате 24—48 час., проверяют при помощи микроскопии чистоту культур и для определения вида возбудителя и его токсина ставят реакцию нейтрализации с антитоксическими диагностическими сыворотками ко всем возбудителям А. и. Реакцию ставят в шести пробирках: в каждую пробирку вносят по 0,9 мл центрифугата исследуемой культуры; в пять первых пробирок добавляют по 0,6 мл моновалентных сывороток, содержащих антитоксины против каждого из возбудителей А. и. в количестве 50—100 ME, в контрольную пробирку добавляют 0,6 мл физиологического раствора. Смеси токсина с антитоксином выдерживают 40 мин. при t° 20° в темном месте и затем вводят внутривенно по 0,5 мл белым мышам или внутрикожно по 0,2 мл морским свинкам. Результаты регистрируют через 5—6 час. и на 3-й сутки. Видовая принадлежность изучаемой культуры устанавливается по нейтрализации токсина сывороткой.
В случае гибели всех животных реакцию нейтрализации ставят повторно с типовыми специфическими диагностическими сыворотками Cl. perfringens типов А, В, D и Е.
Культуры Cl. perfringens типа D и Е способны вырабатывать протоксины, для обнаружения к-рых применяют метод активации с помощью протеолитических ферментов — трипсина или панкреатина.
Исследуемая 5—6-часовая культура Cl. perfringens, полученная на жидкой мясной или казеиновой среде, подвергается центрифугированию или фильтрованию. Исходный 1% раствор трипсина в количестве 1 мл добавляют к 10 мл исследуемой культуральной жидкости. Если вместо трипсина применяют 4% раствор панкреатина, то культуральную жидкость смешивают с равным объемом раствора панкреатина и рН смеси доводят при помощи 10% NaOH до 8,0—8,4.
Полученные жидкости помещают в термостат при t° 37° на 1 час. По истечении указанного срока ставится реакция нейтрализации с сыворотками Cl. perfringens типа D и Е.
В лабораториях, располагающих к возможностью работы с культурами тканей, реакция нейтрализации может быть поставлена на первично м трипсинизированных тканях 10—11-дневных куриных эмбрионов.
Микробиологическая диагностика может быть проведена ускоренными методами.
1. Если можно получить большое количество относительно чистого отделяемого из раны, ставят реакцию нейтрализации с центрифугатом этой жидкости.
Для определения лецитнназы можно также поставить реакцию с исследуемой жидкостью in vitro, используя лецитовителлин или эритроциты овцы, мыши, кролика для реакции гемолиза. Подавляя реакцию сыворотками против Cl. perfringens, Cl. oedematiens и т. п. устанавливают специфичность обнаруженных лецитиназы, гемолизина.
2. С целью идентификации чистых токсигенных культур Cl. perfringens типа A, Cl. oedematiens, Cl. septicum и др. к прозрачному питательному агару на основе бульона Хоттингера или Мартена добавляют один из гомологичных антитоксинов в концентрации 8 ME на 1 мл. Необходимо иметь четыре чашки с четырьмя разными антитоксинами, на к-рые засевают исследуемые культуры. Через 48—72 часа вокруг выросших колоний с гомологичной сывороткой образуется кольцо преципитации.
3. Один из ускоренных методов диагностики in vitro основан на изменении морфологии и характера роста анаэробов при культивировании в полужидкой среде в присутствии специфических антитоксических сывороток (О. А. Комкова).
С этой целью используют среду, состоящую из бульона Поупа с 0,1% агара, 0,4% желатины и 0,5% глюкозы. Среду разливают в пробирки по 10 мл и стерилизуют текучим паром 2 раза по 20 мин. с суточным перерывом.
Исследуемый материал помещают по нескольку кусочков в десять пробирок с полужидкой средой; пять пробирок прогревают при t° 80° в течение 20 мин. В каждую пару пробирок — прогретую и непрогретую — добавляют различные моновалентные диагностические противогангренозные сыворотки с таким расчетом, чтобы в 1 мл среды содержалось антитоксической сыворотки Cl. perfringens типа А не менее 200 ME, Cl. oedematiens типа А — не менее 300 ME, Cl. septicum и Cl. histolyticum — не менее 50 ME. В последние две пробирки сыворотку не добавляют.
Содержимое каждой пробирки тщательно перемешивают и все пробирки помещают в термостат при t° 37—38°. Через 10—18 час. читают результат. Стрептобациллярная форма и рост изолированными колониями в пробирках с какой-либо антитоксической сывороткой и отсутствие этих явлений в остальных пробирках указывают на наличие в исследуемом материале возбудителя А. п., соответствующего данному виду сыворотки.
Обнаружение стрептобациллярных форм в пробирках с разными сыворотками свидетельствует о присутствии возбудителей А. и. нескольких видов.
4. Второй ускоренный метод, предложенный О. А. Комковой, представляет собой усовершенствованную реакцию нейтрализации токсина антитоксином с помощью внутрикожного введения морским свинкам. Для одного анализа требуется 3—5 морских свинок, у к-рых заранее депилпруют боковую поверхность живота. Одной свинке вводят внут-рпкожно 0,1 мл испытуемой жидкости с 0,1 мл физиологического раствора, а остальным по 0,1 мл исследуемой жидкости в смеси с 0,1 мл моновалентной диагностической противогангренозной сыворотки против каждого вида возбудителя. Наблюдение за свинками ведут 24 часа. Диагностика основана на быстро наступающем изменении цвета кожи морских свинок (окрашивание в фиолетовый, розовый, синий тона) вследствие местного расстройства кровообращения. Метод позволяет иногда обнаружить токсигенные штаммы возбудителей А. и. в период от 30 мин. до 4 час.
Для определения лецитиназы готовят двукратные последовательные разведения испытуемого фильтрата культуры в боратном или ацетатном буфере (рН = 6,0) с ацетатом кальция (0,005 М). Для этой цели удобно применять хлорвиниловую пластину с 72 лунками. В лунки разливают по 0,5 мл буфера. В первые две лунки буфер не наливают, заполняя их по 0,5 мл испытуемой культуральной жидкости. В первую лунку добавляют затем 0,1 мл специфической антитоксической диагностической сыворотки, содержащей не менее 50 ME в 1 мл. В третью лунку доливают 0,5 мл испытуемой жидкости и, смешав ее с буфером, готовят последовательно двукратные разведения. Пластину оставляют затем на 30 мин. при t° 20° в затемненном месте. Специфическая сыворотка за это время успевает нейтрализовать действие гомологичной лецитиназы. В каждую лунку затем добавляют по 0,1 мл лецитовителлина, смешивают жидкости круговыми покачиваниями и пластину помещают в термостат при t° 37° на 2 часа. Реакцию учитывают в проходящем свете, отмечая помутнение жидкости в лунках с помощью трехплюсовой системы. Специфичность реакции подтверждается отсутствием помутнения в первой лунке, содержащей гомологическую антитоксическую сыворотку.
Нужно подчеркнуть, что бактериологическое исследование не может помочь срочной диагностике А. п., т. к. ответ может быть получен лишь через несколько суток и даже при использовании ускоренных методов — через 2—3 часа. Кроме того, обнаружение патогенных анаэробов ценно лишь при наличии клинических симптомов А. и., т. к. даже Cl. perfringens очень часто находят в ранах, не имеющих никаких признаков А. и. и не подвергающихся ей в последующем.
Данные бактериологических исследований могут, однако, быть использованы при дальнейшем лечении, особенно при серотерапии.
Гистологическая диагностика, к-рую предлагали К. П. Улезко-Строганова и П. В. Макаров, не получила широкого распространения, хотя при совместной работе хирургов, бактериологов и патологов диагностика А. и., несомненно, может стать более достоверной. Упрощенный метод, основанный на изучении отпечатков раны и цитологической характеристике раневого отделяемого, может служить скорее показателем реактивных и репаративных процессов, а не этиологии инфекционного осложнения, хотя авторы метода (М. П. Покровская и М. С. Макаров) считают, что при А. и. удается получить специфическую цитограмму — отсутствие и резкое ослабление явлений фагоцитоза, отсутствие моноцитов, присутствие лейкоцитов с явлениями распада, а также наличие большого количества грамположительных палочек.
Другие методы диагностики А. п.: серологические, иммунологические, пробы на специфичность токсинов, реакции преципитации и другие — основаны на экспериментальных исследованиях и не получили распространения в клинической практике.
Гематологические исследования при А. и. диагностического значения не имеют. Суммируя многочисленные исследования, можно считать, что гемограмма при А. и. отражает изменения, свойственные вообще очень тяжелой раневой инфекции: быстро наступающую гипохромную анемию с пейтрофильным лейкоцитозом, эозинопенией, лимфопенией, ускорением РОЭ и морфологическими изменениями эритроцитов. Бактериологическое обнаружение в крови анаэробных микробов является прогностически очень неблагоприятным симптомом, т. к. служит признаком резкого угнетения защитных механизмов организма.
Лечение
Лечение А. и. проводится комплексно. Раны, осложненные А. и., должны быть немедленно подвергнуты хирургической обработке по способу рассечения — иссечения: рана должна быть широко рассечена, края ее раздвигаются крючками, после чего необходимо произвести полное, иногда очень обширное иссечение всех пораженных (серых, не кровоточащих) мышц по всему ходу раневого канала. Критерием жизнеспособности мышц являются сокращения мышечных пучков при пересечении и кровотечение из пересекаемых мелких сосудов мышц. После окончания хирургической обработки необходимо большими продольными (лампасными) или Z-образнымп разрезами вскрыть все костно-фасциальные футляры на поврежденном сегменте и освободить мышцы от сдавления. Разрезы фасций на неповрежденном проксимальном сегменте необходимо производить, если и на этом сегменте имеются признаки отека, а тем более газообразования.
При наличии перелома наложение циркулярной гипсовой повязки и внутрикостная фиксация противопоказаны. Для иммобилизации пользуются скелетным вытяжением или иммобилизуют конечность с помощью гипсовых лонгет. Рана обязательно оставляется широко открытой и рыхло тампонируется сухими или влажными марлевыми тампонами. Для смачивания тампонов предложено множество различных антисептических растворов, хотя ни один из них не обладает отчетливыми преимуществами. Вообще же эти растворы должны быть несколько гипертоничнее тканевых жидкостей и обладать нек-рыми антисептическими свойствами. Хорошо действуют гипертонические (10—20%) растворы хлорида натрия, растворы, выделяющие кислород (перекись водорода), масляно-бальзамические эмульсии и т. д. Кроме тампонов, в глубину раны вводят тонкую резиновую трубочку, по к-рой непрерывно или периодически вводят смесь растворов антибиотиков с раствором сульфамилона или другими антимикробными препаратами. В дальнейшем применяют внутривенное капельное непрерывное введение поливалентной проти-вогангренозной сыворотки, к-рая в 3—5 раз разводится физиологическим раствором. Нужно вводить не менее одной лечебной дозы в сутки. Согласно официальной инструкции, утвержденной Министерством здравоохранения СССР, лечебная доза противогангренозной сыворотки составляет 150000 ME (по 50000 ME сывороток антиперфрингенс, антисептикум, антиэдематиенс). После установления бактериологического диагноза необходимо вводить только сыворотку, одноименную с выделенным возбудителем. Перед введением сыворотки для выявления повышенной чувствительности к лошадиному белку проводят внутрикожную пробу с разведенной 1:100 сывороткой, взятой из тест-ампулы, к-рая имеется в коробке с набором сывороток. 0,1 мл сыворотки из тест-ампулы вводят внутрикожно. Проба считается отрицательной, если диаметр папулы будет не более 0,9 см, положительной — при диаметре папулы в 1,0 см и более и если папула будет окружена большой зоной красноты. При отрицательной внутрикожной пробе вводят подкожно 0,1 мл сыворотки и при отсутствии реакции через 30 мин. вводят внутримышечно всю назначенную дозу или начинают капельное введение. При положительной пробе сыворотку вводят только по абсолютным показаниям. Рекомендуется перед этим вводить под кожу разведенную сыворотку с интервалами в 20 мин. в дозах 0,5; 2,0; 5,0 мл. При отсутствии реакции на эти дозы вводят 0,1 мл неразведенной сыворотки, при повторном отсутствии реакции вводят внутримышечно всю назначенную дозу или приступают к внутривенному введению. В тех случаях, когда невозможно применять капельное введение сыворотки (напр., при эвакуации), неразведенную сыворотку вводят внутримышечно. В процессе лечения вводят внутримышечно или внутривенно большие дозы различных антибиотиков.
Имеется положительный опыт применения пенициллина, к-рый вводят внутривенно и внутримышечно по 2—10 млн. ЕД в сутки. Для того чтобы избежать появления пеницил-лнноустойчивых рас микробов, целесообразно чередовать применение различных антибиотиков: сигмомицин, тетрациклин, канамицин и др. Производят переливания крови. Доза гемотрансфузии определяется размерами кровопотери и степенью анемии. Массивные переливания крови при А. и. больные переносят плохо, поэтому применяют частые переливания в дозе 250 мл в сутки. Лучший эффект наблюдается при прямых переливаниях непосредственно от донора реципиенту. Показано внутривенное введение полиионных растворов по 1—3 л в сутки, способствующее разведению и выведению токсинов, уменьшению вязкости крови и нормализации гемодинамики. В лечении А. и. иногда используют газообразный кислород, к-рый теоретически должен способствовать гибели анаэробных микробов. Уже в 1917 г. Б. С. Иоффе инфильтрировал пораженные ткани перекисью водорода. В. Д. Соколов в 1927 г. производил вдувание кислорода в окружность раны непосредственно из баллона. В 1941 г. Альмейда (J. D. Almeida) применял кислород под давлением в 3 атм. Все авторы, применявшие кислород, не смогли отметить ясно выраженного лечебного эффекта. При лечении А. и. применяется кислород и в форме так наз. оксибаротерапии (см. Кислородная терапия). Оксибаротерапия должна применяться только после выполнения хирургических способов лечения А. и.
Испытывалась и регионарная перфузия конечности (см. Перфузия). С помощью этого метода пытались создать в тканях конечности высокую концентрацию антибиотиков, отмыть тромбы и устранить сосудистый спазм (И. Л. Крупко с соавт., Б. С. Греков). В экспериментах были получены удовлетворительные результаты. А. Н. Сызганов для лечения А. и. предлагает накладывать на корень конечности жгут, к-рый должен сдавливать только вены; приток артериальной крови не нарушается. Затем внутрикостно вводится раствор, содержащий антибиотики, ткани пропитываются этим раствором, избыток к-рого непрерывно оттекает через рану.
А. и. часто служит поводом к ампутации конечности, причем лечение иногда даже начинают с ампутации в тех случаях, когда степень повреждения конечности не позволяет рассчитывать на ее функциональную полноценность после выздоровления. Вторичные показания к ампутации ставятся при наличии клинических симптомов быстро распространяющейся А. и. с ясно выраженной тяжелой общей реакцией и особенно при обширном и глубоко расположенном очаге инфекции. Отсечение конечности производят выше очага инфекции; при этом видимые границы распространения газа и отека не могут служить ориентиром, и уровень ампутации определяют только по состоянию мышечной ткани после рассечения кожи и фасции. При обнаружении в этом разрезе серой, не сокращающейся и не кровоточащей мышцы уровень ампутации повышают до того участка, где находятся живые, ярко окрашенные, кровоточащие и сокращающиеся мышцы. Способ ампутации особого значения не имеет, хотя предпочтительнее пользоваться лоскутными разрезами (см. Ампутация). После отсечения конечности оттягивают кожу культи в проксимальном направлении и производят рассечение всех костно-фасциальных футляров. Швы не накладывают, культю покрывают марлевыми тампонами.
Профилактика
Наиболее эффективным средством предупреждения А. и. является полноценная первичная хирургическая обработка ран (см.), выполненная в ранние сроки после ранения. Однако всегда проходит какое-то время, прежде чем пораженный или пострадавший будет доставлен в учреждение, где может быть выполнена первичная хирургическая обработка, поэтому большинство профилактических мер имеет своей целью временно подавить микробную флору раны и тем самым предотвратить или замедлить развитие инфекционного процесса. Вакцинопрофилактику А. и. осуществляют введением ассоциированных вакцинных препаратов — полианатоксинов. Анатоксины Cl. perfringens и Cl. oedematiens входят в состав комплексного препарата — сорбированной брюшнотифозной вакцины с секстаанатоксином. 1 мл вакцины (доза на каждую прививку) содержит 30 ЕС анатоксина Cl. perfringens и 10 ЕС Cl. oedematiens, При иммунизации населения вакцинируются люди в возрасте от 17 до 60 лет подкожным введением вакцины двукратно с интервалом в 25—30 сут. Привитых ревакцинируют спустя 6—9 мес. и затем через каждые 5 лет или по каким-либо особым показаниям. При правильной дозировке вакцинация не создает иммунологической конкуренции между входящими в препарат антигенами. Практическое значение активной иммунизации анатоксинами возбудителей А. и. еще не оценено вполне достоверно.
Серопрофилактика А. и. во время Великой Отечественной войны проводилась введением смеси противогангренозных антитоксических сывороток.
Вначале рекомендовали вводить внутримышечно 5000 ME (антиперфрингенс 1500, антиэдематиенс 2500, антисептикум 500 и антигистолитикум 500). Отсутствие эффекта послужило поводом к увеличению дозы вводимой сыворотки до 14 000 ME (Указания по военно-полевой хирургии, 1944 г.). Профилактическое введение сыворотки предписывалось при ранении верхних и нижних конечностей и ягодиц, сопровождающемся обширным разрушением мышц, и при ранах, загрязненных землей, обрывками одежды, а также в случаях, когда был наложен жгут. В послевоенные годы рекомендовано профилактическое введение 30000 ME (по 10000 ME антиперфрингенс, антиэдематиенс и антисептикум). Противогангренозные сыворотки получают от лошадей, иммунизированных анатоксином или токсином соответствующих микробов. Сыворотки выпускаются в жидком или сухом виде, после очистки и концентрации методом ферментативного гидролиза (диаферм-3) в виде комплекта ампул, каждая из к-рых содержит моновалентную сыворотку (антиперфрингенс, антиэдематиенс, антисептикум), или в виде смеси всех трех антитоксических сывороток в одной ампуле.
Однако, несмотря на увеличение дозы, эффект серопрофилактики настолько незначителен, что нет убедительных доказательств ее целесообразности, и профилактическое введение антитоксической сыворотки раненым в военное время считается необязательным. Гораздо более эффективными оказались бактериостатические и бактерицидные препараты. В многочисленных работах, посвященных изучению чувствительности анаэробных микробов к пенициллину и другим антибиотикам, приводятся убедительные экспериментальные и клинические материалы, свидетельствующие о том, что под влиянием этих препаратов изменяются культуральные, токсинообразующие и морфологические свойства анаэробов. Изменения особенно отчетливо выявляются, если в ране создаются высокие концентрации противобактерийных препаратов, чего удается достичь при одновременном введении их — общем и местном, т. е. непосредственно в рану или в ткани по ее окружности. В тех случаях, когда по условиям боевой или мед. обстановки рана не может быть подвергнута хирургической обработке в ранние сроки, введение антибиотиков позволяет несколько отсрочить первичную хирургическую обработку. С такой же целью вводят в рану раствор сульфаниламидного препарата — сульфамилона, иногда в виде пенициллин-сульфамилоновой смеси.
См. также Раневые инфекции, Раны, ранения.
Библиогр.: Арапов Д. А. Анаэробная газовая инфекция, М., 1972, библиогр.; Беркутов А. Н. Предупреждение и лечение анаэробной инфекции огнестрельных ран, Л., 1955; он же,Об анаэробной инфекции огнестрельных ран, Воен.-мед. журн., № 4, с. 14, 1972, библиогр.; Беркутов А. Н. и Корчанов Л. С. О предупреждении и лечении анаэробной инфекции огнестрельных ран, там же, № 7, с. 21, 1967; Brummelkamp W. Н. К вопросу о лечении газовой гангрены кислородом в 3 ата, в кн.: Лечение повышен. давлением кислорода, пер. с англ., под ред. Л. Л. Шика и Т. А. Султанова, с. 115, М., 1968; Бурденко Н. Н. Письма хирургам фронтов о пенициллине, М., 1945; Воронов Н. С. Об анаэробной инфекции после второй мировой войны, Воен.-мед. журн., № 3, с. 89, 1972; Гращенков Н. И. Анаэробная инфекция мозга, М., 1944; Давыдовский И. В. Огнестрельная рана человека, т. 1, М., 1952; Костин Н. С. и Задорожный А. А. Прижизненное рентгеноконтрастное исследование сосудов при анаэробной инфекции, Ортоп. и травмат., № 12, с. 33, 1971; Львов А. Н. Газовая инфекция, М., 1946; Матвеев К. И. и Волгин Ю. Б. Анаэробная инфекция, Многотомн. руководство по микр., клин, и эпид. инфекц. бол., под ред. Н. Н. Жукова-Вережникова, т. 7, с. 565, М., 1966, библиогр.; Матвеев К. И. и др. Концентрированный адсорбированный анаэробный полианатоксин, в кн.: Анаэробные инфекции, под ред. Г. В. Выгодчикова и др., с. 293, М., 1960; Мельников А. В. Клиника газовой инфекции огнестрельных ран, М., 1945; Мельников В. Н. и Мельников Н. И. Анаэробные инфекции, М., 1973, библиогр.; Мельников В. Н. Мельников Н. И. и Еникеева У. С. Основа профилактики анаэробных инфекций, Уфа, 1971; Мицкевич А. И. и Штефан Э. Э. Внутрикостный способ введения специфических сывороток для профилактики и лечения газовой гангрены, Клин, хир., № 3, с. 53, 1970, библиогр.; Опыт советской медицины в Великой Отечественной войне 1941—1945 гг., т. 2, М., 1951; Пирогов Н. И. Начала общей военно-полевой хирургии, ч. 1—2, М., 1941 — 1944; Покровская М. П. Использование цитологического анализа раневого экссудата для ранней диагностики газовой гангрены, Госпит. дело, № 12, с. 18, 1944; Руководство по микробиологической диагностике инфекционных болезней, под ред. К. И. Матвеева, с. 357, М., 1973; Сидоренко Г. И. Распространение Cl. perfringens во внешней среде, Гиг. и сан., № 9, с. 38, 1965, библиогр.; Черная Л. А. и Ковтунович Г. П. Газовая инфекция, Киев. 1950; Веavis J. P. a. Watt J. Hyperbaric oxygen therapy in the treatment of gas gangrene, J. roy. nav. med. Serv., v. 56, p. 26, 1970; Hampton O. P. Gas gangrene, J. Trauma, v. 11, p. 1050, 1971; Nеу, Welchen Platz haben aktive chirur-gisclie Massnahmen im Rahmen der hyperbaren Sauerstofftherapie des Gasodems, Zhl. Chir., S. 1560, 1972; Parker М. Т. Postoperative clostridial infections in Britain, Brit. med. J., v. 3, p. 671, J969; Prévot A. R., Turpin A. etKaiser P. Les bacterics anaérobies, P., 1967; Roding В., Groeneveld P. а. Boerema I. Ten years of experience in the treatment of gas gangrene with hyperbaric oxygen, Surg. Gynec. Obstet., v. 134, p. 579, 1972; Roemer G. B. Untersuchungen uber die antibaktericlle Wirkung ncuerer Antibiotika auf Welch—Frenkelsche Gasbrandbazillen, Dtsch. med. Wschr., S. 2205, 1968, Bibliogr.; Seemann, Hyperbare Therapie der Gasödeminfektion, Zbl. Chir., S. 1559, 1972; Sсhоtt H. u. Hockcrts T. Das Gasödem und seine Behandlung, Chirurg, S. 302, 1971, Bibliogr.; Willis A. T. Clostridia of wound infection, L., 1969, bibliogr.
Источники:
- Большая медицинская энциклопедия. Том 1/Главный редактор академик Б. В. Петровский; издательство «Советская энциклопедия»; Москва, 1974.- 576 с.
|
ПОИСК:
|
© Анна Козлова подборка материалов; Алексей Злыгостев оформление, разработка ПО 2001–2019
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'