АМФОЛИТЫ
Расстановка ударений: АМФОЛИ`ТЫ
АМФОЛТЫ (греч. amphoteros — и тот и другой и lytos — растворимый), или амфотерные электролиты, — вещества, молекулы к-рых содержат кислотные и основные группы; в зависимости от условий проявляют кислотные или основные свойства. К А. относятся такие биологически важные вещества, как аминокислоты (см.), пептиды (см.), белки (см.), нуклеопротеиды (см.) и др.
Согласно протолитической теории кислот и оснований (см. Электролиты) кислотные свойства этих веществ обусловлены содержанием в их молекулах кислотных групп, напр. — СООН, — NH+3, являющихся донорами протонов, а основные свойства — содержанием основных групп, напр. — СОО-, — NH2, являющихся акцепторами протонов.
В водных растворах А. могут находиться в различных формах: в виде не диссоциированных молекул, положительно заряженных ионов (катионов), отрицательно заряженных ионов (анионов) и биполярных ионов (называемых также цвиттерионами, амфотерными ионами или амфиионами). Все эти формы находятся в динамическом равновесии друг с другом. Так, напр., в растворе аминокислота глицин находится в форме катионов+H3NCH2COOH, анионов H2NCH2COO-, молекул H2NCH2COOH или биполярных ионов+H3NCH2GOO-.
Исследование ряда свойств растворов А. (диэлектрической проницаемости, спектров комбинационного рассеяния и др.) показало, что в водных растворах аминокислот, пептидов и белков электронейтральными частицами преимущественно являются не сами молекулы, а биполярные ионы. Так как в состав последних входят кислотные и основные группы, то они проявляют амфотерные свойства, т. е. диссоциируют в растворах и как кислоты:
[+H3NCH2COO-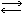 -H2NCH2COO-+H+](1),
-H2NCH2COO-+H+](1),
и как основания:
[+H3NCH2COO-+H2О 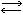 H3NCH2COOH+OH-](2).
H3NCH2COOH+OH-](2).
Константы диссоциации, соответствующие равновесиям (1) и (2), называют амфиионными (амфотерноионными) константами диссоциации и обозначают через Ка и Кb соответственно. В кислой среде А. в растворе находятся в виде катионов.
+H3NCH2COO-+H+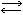 +H3NCH2COOH (при электрофорезе перемещаются к катоду), в сильно щелочной среде — в виде анионов:
+H3NCH2COOH (при электрофорезе перемещаются к катоду), в сильно щелочной среде — в виде анионов:
+H3NCH2COO-+OH-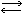 HOH3NCH2COO-(при электрофорезе перемещаются к аноду). Значение рН среды, в к-рой А. находится в форме биполярных ионов или недиссоциированных молекул, т, е. электронейтральных частиц, не перемещающихся в электрическом поле, называют изоэлектрической точкой А. и обозначают символом pi (см. Изоэлектрическая точка).
HOH3NCH2COO-(при электрофорезе перемещаются к аноду). Значение рН среды, в к-рой А. находится в форме биполярных ионов или недиссоциированных молекул, т, е. электронейтральных частиц, не перемещающихся в электрическом поле, называют изоэлектрической точкой А. и обозначают символом pi (см. Изоэлектрическая точка).
Для А. с преобладающими кислотными свойствами изоэлектрическая точка меньше 7, а для А., у к-рых более выражены основные свойства, — больше 7.
См. также Активная реакция среды, Водородный показатель, Кислоты и основания.
Библиогр.: Ашмарин И. П. и др Химия белка, ч. 1, с. 153, Л., 1968, библиогр.; Белки, под ред. Г. Нейрата и К. Бейли. пер. с англ., т. 2, с. 431, М., 1956, библиогр.; Гауровиц Ф. Химия и функции белков, пер. с англ., с. 109, М 1965 библиогр.
Источники:
- Большая медицинская энциклопедия. Том 1/Главный редактор академик Б. В. Петровский; издательство «Советская энциклопедия»; Москва, 1974.- 576 с.
|
ПОИСК:
|
© Анна Козлова подборка материалов; Алексей Злыгостев оформление, разработка ПО 2001–2019
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'