АММИАК
Расстановка ударений: АММИА`К
АММИАК (NH3) — химическое соединение азота с водородом, бесцветный газ с характерным острым запахом, раздражающим слизистые оболочки. Встречается в небольших количествах в воздухе, речной и морской воде, почве, особенно в тех местах, где происходит разложение органических азотсодержащих веществ (см. Гниение).
А. впервые получил английский ученый Д. Пристли(1774)при действии гашеной извести на хлористый аммоний. В 1787 г. для А. было предложено название «аммониак», к-рое сохранилось за ним в различных странах. В России в 1801 г. химик Я. Д. Захаров заменил это название более коротким «аммиак».
В лабораторных условиях А. получают вытеснением его из аммиачных солей растворами сильных щелочей при нагревании:
2NH4Cl + Ca(OH)2 → 2NH3 + CaCl2 + 2H2O.
В технике А. получают синтетически по методу, разработанному немецким химиком Габером (F. Haber). Синтез А. проводится следующим образом: смесь азота с водородом сжимается с помощью компрессора до 200—220 атм и иод таким давлением пропускается через контактный аппарат, содержащий катализатор (железо с добавкой окисей алюминия и калия). После прохождения над катализатором газы, содержащие около 10% А., поступают в охладитель, а затем в ряде аппаратов А. поглощается водой.
При наличии дешевой электроэнергии, необходимой для создания высокой температуры, А. синтезируют по цианамидному методу, основанному на взаимодействии атмосферного азота и карбида кальция. При высокой температуре оба вещества реагируют друг с другом с образованием кальций-цианамида, к-рый при действии перегретого водяного пара и давлении 6 атм легко распадается с образованием А.
Плотность А. при t° 0° и давлении 760 мм рт. ст. (1 атм) равна 0,589. Масса 1 л — 0,771 г. При давлении 7 атм и комнатной температуре А. находится в жидком состоянии. При давлении в 1 атм при охлаждении до t° — 40° сжижается. При охлаждении до t° — 75° кристаллизуется. А. хорошо адсорбируется активированным углем. Хорошо растворим в воде. В одном объеме воды при комнатной температуре растворяется 750 объемов А. В насыщенном водном растворе содержится 33% А. Раствор А. в воде называется «нашатырным спиртом». С водой А. образует очень непрочное соединение — гидрат окиси аммония (NH4OH), представляющее собой слабое основание.
Из водного раствора А. легко выделяется, особенно при нагревании; горит в кислороде с образованием воды и азота:
4NH3 + 3O2 → 2N2 + 6H2O;
в присутствии катализаторов окисляется до окиси азота.
Раствор А. в воде имеет слабощелочную реакцию, т. к. в нем содержатся гидроксильные ионы (ОН-). Последние возникают благодаря тому, что нек-рая часть молекул А. соединяется с водородными ионами воды: NH3 + НОН 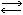 NH+4 + OH-. Часть гидроксильных ионов связывается с ионами аммония, образуя гидрат окиси аммония NH+4 + OH-
NH+4 + OH-. Часть гидроксильных ионов связывается с ионами аммония, образуя гидрат окиси аммония NH+4 + OH-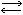 NH4OH. Отсюда следует, что раствор А. содержит одновременно молекулы аммиака, ионы NH+4 и ОН-. Однако главная масса растворенного А. находится в виде молекул.
NH4OH. Отсюда следует, что раствор А. содержит одновременно молекулы аммиака, ионы NH+4 и ОН-. Однако главная масса растворенного А. находится в виде молекул.
Жидкий А. при испарении поглощает большое количество тепла (327 кал на 1 г), благодаря чему его применяли в холодильном деле. Особенно велико значение А. как источника получения азотной к-ты и ее солей. Синтез А. с использованием атмосферного азота, количэство к-рого практически неисчерпаемо, позволяет пополнять запасы азотистых веществ в почве и делать ее более плодородной. Для использования в качестве удобрений из А. в больших количествах готовят сульфат аммония и азотнокислый аммоний.
В фармацевтической практике применяют нашатырный спирт различной крепости. Официнальный раствор должен содержать 10% А. Этот раствор получают путем разбавления водой товарного 25% раствора А.
А. занимает центральное место в азотистом обмене растений. Через корневую систему аммиачные соли поступают в растения в очень незначительных количествах, т. к. содержание их в почве невелико. А. в почве подвергается окислению в результате жизнедеятельности нитрифицирующих бактерий, и образующиеся при этом соли азотистой и азотной кислот используются после предварительного образования из них А. для синтеза аминокислот (а из них белков) и иных азотсодержащих веществ (см. Азотистый обмен).
А. образуется также в организме человека и животных. Источником его образования являются входящие в состав животных тканей аминокислоты, а также адениловая к-та. Однако содержание А. в тканях, крови и цереброспинальной жидкости очень незначительно (0,01—0,1 мг%). Объясняется это тем, что в тканях организма образующийся А. устраняется путем синтеза амидов (см.). Устранение А. (в организме животных синтезируется преимущественно глутамин) является общебиологическим процессом, происходящим в микроорганизмах, растениях и организме животных. Конечным продуктом обезвреживания и устранения А. в организме человека является мочевина (см.).
А. образуется при сокращении мышц, возбуждении нервной ткани. Образующийся при работе мышц А. частично устраняется, частично же поступает в кровь. А. поступает также в кровь из кишечника. Выделяется он из организма человека и животных с мочой в виде аммиачных солей (гл. обр. сульфата аммония). При ацидозах выделение А. с мочой резко увеличивается. Главным источником А. мочи является глутампн, доставляемый к почкам кровью, где он дезамидируется под влиянием глутаминазы.
Количественное определение А. производится по реакции нейтрализации кислоты: 2NH3 + H2SO4 → (NH4)2SO4. Неиспользованную кислоту титруют раствором щелочи в присутствии индикатора — метилового оранжевого. А. количественно определяют и по цветной реакции с реактивом Несслера (щелочной раствор меркурийодида калия K2Hg2I4). Для определения А. в воздухе определенный объем его протягивают с помощью аспиратора через поглотительные склянки с 10 н. раствором серной к-ты, а затем определяют титрометрически или колориметрически.
Применение аммиака в медицине. Раздражающее действие А. и его солей используется в мед. практике. Рефлексы, возникающие при раздражении слизистых оболочек верхних дыхательных путей, способствуют возбуждению дыхательного центра, особенно при его угнетении (удушение, отравление и т. д.). Вдыхание А. вызывает учащение дыхания и повышение артериального давления; при действии больших концентраций, наоборот, происходит остановка дыхания и замедление пульса. Кроме того, при продолжительном действии высоких концентраций А. на месте применения его могут возникать воспалительные и некробиотические изменения в тканях. А. обладает также дезинфицирующим действием.
Из препаратов А. наибольшее терапевтическое применение имеет нашатырный спирт (Solutio Ammonii caustici, Liquor Ammonii caustici, Ammonium causticum solutum, NH4OH) — 10% водный раствор А. Прозрачная бесцветная жидкость с резким запахом А. Смешивается с водой и спиртом в любых соотношениях. Нашатырный спирт вызывает раздражение рецепторов слизистых оболочек и рефлекторно возбуждает дыхательный и сосуд одвигательный центры. С этим свойством связано его применение при обморочных состояниях или отравлении алкоголем (ингаляция или прием внутрь по 5—10 капель в 100 мл воды). Действие на дыхательный центр непродолжительно, и для длительной стимуляции дыхания необходимо применение аналептиков. В хирургической практике нашатырный спирт применяют как дезинфицирующее средство для мытья рук (25 мл на 5 л теплой воды — способ Кочергина—Спасокукоцкого).
При хронических артритах и невралгиях в качестве отвлекающего средства применяют аммиачный линимент (Linimentum ammoniatum, линимент летучий, Linimentum volatile) — однородная густоватая жидкость желтовато-белого цвета с запахом А. Получают взбалтыванием смеси подсолнечного масла (74 части) и олеиновой к-ты (1 часть) с раствором А. (25 частей).
Раствор А. при приеме внутрь оказывает отхаркивающий эффект (см. Нашатырно-анисовые капли).
Растворы А. применяют для нейтрализации кислых токсинов при укусах насекомых, змей и каракурта (примочки или впрыскивания в место укуса). Имеются данные об использовании слабых растворов А. (0,1—0,2%) в качестве противовоспалительного средства при панарициях, фурункулах, абсцессах и т. п.
Профессиональные вредности. Отравления А. в условиях производства чаще острые и возникают лишь при аварийных случаях; хрон. отравления возможны, но встречаются реже.
Порог рефлекторного действия для человека — 25 мг/м3. Ощущение раздражения наблюдается при 100 мг/м3. Работа затруднена при 140—210 мг/м3, невозможна — при 350 мг/м3 и выше.
При острых отравлениях появляется насморк, першение и боль в горле, слюнотечение, осиплость голоса, гиперемия слизистых оболочек верхних дыхательных путей и глаз.
При тяжелых отравлениях присоединяется чувство стеснения и боли в груди, сильный приступообразный кашель, удушье, головная боль, боль в желудке, рвота, задержка мочи. Наступает резкое расстройство дыхания и кровообращения. Возможен ожог слизистой оболочки верхних дыхательных путей и развитие явлений воспаления легких, реже токсический отек легких. Возникает сильное возбуждение. Причиной гибели в ряде случаев является воспаление бронхов и легких. При непосредственном попадании на кожу или слизистую оболочку глаз возможен хим. ожог. Последствиями перенесенного острого отравления могут быть помутнение роговицы и потеря зрения, хриплость голоса, иногда полная его потеря, хрон. бронхит, активизация туберкулезного процесса.
Хрон. отравления могут развиться при постоянном воздействии невысоких концентраций А. Концентрация А. 40 мг/м3 является порогом хрон. действия (круглосуточное воздействие). В моче отравленных животных значительно повышается содержание А. При вскрытии у животных, подвергшихся отравлению, наблюдается гнойное воспаление трахеи и бронхов, воспаление легких и плеврит; патологические изменения со стороны паренхиматозных органов, по-видимому, связаны с реакцией на ожог.
А. в организме быстро обезвреживается, и потому его кумулятивное действие незначительно или даже мало вероятно. При хрон. отравлении у людей наблюдается потеря обоняния, конъюнктивит, хрон. катар слизистых оболочек носа, верхних дыхательных путей и бронхов.
Первая помощь: при попадании в глаза брызг аммиачных растворов следует немедленно промыть глаза проточной водой. Затем применяют вазелиновое или оливковое масло, новокаин с адреналином, сульфацил - натрий (альбуцид - натрий). При попадании на кожу брызг немедленно смыть сильной струей воды. При поражении кожи газообразным А. — примочки 5% раствора уксусной или лимонной к-ты. При отравлении — свежий воздух, ингаляция подкисленного теплого пара, 10% ментол в хлороформе, легкие наркотики (кодеин, дионин — 0,01 г), кислород, тепло.
При спазме голосовой щели — местное тепло, ингаляция, атропин, по показаниям трахеотомия. Сердечные средства по показаниям. При остановке дыхания — искусственное дыхание. Лечение н профилактика отека легких (см.).
Профилактика сводится к герметизации аппаратуры и коммуникаций. При работе на опасных участках следует применять фильтрующий промышленный противогаз марки К (зеленая коробка) и систематически контролировать концентрацию А. в воздухе производственных помещений.
ПДК в атмосфере производственных помещений — 20 мг/м3.
Аммиак в судебно-медицинском отношении. А. может вызывать отравление в газообразном состоянии или при приемах внутрь в виде водных растворов. Клиническая картина при отравлении A. (per os) сходна с той, к-рая наблюдается при отравлении едкими веществами, однако имеются особенности: характерный запах рвотных масс, насморк, слезотечение, сильный кашель; наблюдается парез нижних конечностей. При суд.-мед. исследовании обращают внимание на ярко-красный цвет слизистой оболочки рта, глотки, пищевода и желудка, иногда принимающий более темную окраску. В легких наблюдается очаговая пневмония, в почках — явления острого нефрита.
При вскрытии трупа ощущается запах А., сохраняющийся в течение нескольких дней. Для суд.-хим. качественного обнаружения А. используется способность его паров окрашивать в синий цвет красную лакмусовую бумажку и бумажку, смоченную раствором сульфата меди. Для исключения А., образующегося при гниении биол. объектов, параллельно проводится испытание с бумажкой, пропитанной раствором ацетата свинца. При этом возникает почернение в присутствии сероводорода, сопутствующего А. при гниении. При посинении двух первых бумажек и потемнении третьей установление наличия поступившего в организм А. хим. методом уже невозможно.
Количественное определение А. при исследовании трупного материала, как правило, не может быть произведено.
Библиогр.: Закусов В. В. Фармакология, с. 186, М., 1966; Козлов Н. Б. Аммиак, его обмен и роль в патологии, М., 1971; Машковский М. Д. Лекарственные средства, ч. 1, с. 393, М., 1972; Реми Г. Курс неорганической химии, пер. с нем., т. 1, с. 587, М., 1972; Goodman L. S. a. Gilman A. Pharmacological basis of therapeutics, N. Y., 1970.
Профессиональные вредности — Алпатов И. М. Изучение токсичности газообразного аммиака, Гиг. труда и проф. заболев., № 2, с. 14, 1964; Алпатов И. М. и Михайлов В. И. Исследование токсичности газообразного аммиака, там же, № 12, с. 51, 1963; Вольфовская Р. Н. и Давыдова Г. Н. Клинические наблюдения над острыми отравлениями аммиаком, Сб. науч. работ Ленингр. ин-та гиг. труда, с. 155, 1945; Вредные вещества в промышленности, под ред. Н. В. Лазарева, ч. 2, с. 120, Л., 1971, библиогр.; Михайлов В. И. и др. Влияние малых концентраций аммиака на некоторые биохимические и физиологические показатели у человека, Гиг. труда и проф.заболев., № 10, с. 53, 1969, библиогр.
Источники:
- Большая медицинская энциклопедия. Том 1/Главный редактор академик Б. В. Петровский; издательство «Советская энциклопедия»; Москва, 1974.- 576 с.
|
ПОИСК:
|
© Анна Козлова подборка материалов; Алексей Злыгостев оформление, разработка ПО 2001–2019
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'