АМИНОТРАНСФЕРАЗЫ
Расстановка ударений: АМИНОТРАНСФЕРА`ЗЫ
АМИНОТРАНСФЕРАЗЫ (син. трансаминазы; устаревшее название аминоферазы) — ферменты из класса трансфераз, катализирующие реакцию трансаминирования, т. е. перенос аминогруппы (—NH2) и атома водорода от одной молекулы субстрата к другой; играют важную роль в азотистом обмене. Общая схема реакции:
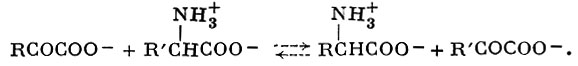
Реакция протекает без промежуточного образования аммиака. Ферментативное трансаминирование было открыто в 1937 г. А. Е. Браунштейном и М. Г. Крицман, к-рые показали, что препараты из грудной мышцы голубя катализируют обратимую реакцию образования глутаминовой кислоты (см.) и α-кетокислоты (см. Кетокислоты) из α-кетоглутарата и различных аминокислот.
А. обнаружены во всех исследованных тканях растений и животных и в клетках микроорганизмов. Известно ок. 50 А., к-рые действуют избирательно на природные α-аминокислоты и многие β-, γ- и δ-аминокислоты. Наиболее активные и самые распространенные А. используют глутаминовую и α-кетоглутаровую кислоты в качестве одной из донорно-акцепторных пар; остальные аминокислоты трансаминируются менее активными А., обычно проявляющими групповую специфичность (см. Ферменты) к нескольким субстратам сходного строения, напр. к аминокислотам с разветвленной цепью или ароматическим аминокислотам. В органах высших животных (мышцы, сердце, печень) наиболее активны аспартат-кетоглутарат-аминотрапсферазы и аланин-кетоглутаратамино-трансферазы.
Все очищенные А., выделенные из тканей животных, высших растений и многих микроорганизмов, стерео-специфичны. Они катализируют, как правило, трансаминирование аминокислот (см.) только L-ряда. Однако известны А. нек-рых бактерий, к-рые действуют только на D-аминокислоты и не действуют на их L-изомеры.
Донорами аминогрупп служат не только α-аминокислоты. Так, в тканях животных и у микроорганизмов обнаружены А., осуществляющие трансаминирование β-аланина, γ-аминомасляной и нек-рых других аминокислот с α-кетоглутаровой (реже с пировиноградной) к-той. Одним из основных путей метаболизма γ-аминомасляной к-ты в мозге является ее трансаминирование с α-кетоглутаратом, в результате чего образуется глутамат и янтарный полуальдегид (аналогичная реакция имеет место у бактерий). δ-Аминогруппа орнитина и аминолевулиновой к-ты также может переноситься А. на кетокислоты. Глутамин и аспарагин реагируют (при участии А.) с различными кетокислотами с образованием соответствующих аминокислот и амидов (см.) кетоглутаровой и щавелево-уксусной кислот.
За немногими исключениями А. Имеют широкий рН-оптимум с максимумом в области 8—9. Коферментами А. являются производные витамина В6 — пиридоксальфосфат и пиридоксаминфосфат. Согласно теории А. Е. Браунштейна и М. М. Шемякина, аминокислоты реагируют с пиридоксальфосфатом (соединенным с белковой частью молекулы А.) с образованием промежуточных альдиминов пиридоксальфосфата (оснований Шиффа) и таутомерных им кетпмпнов пиридоксаминфосфата:
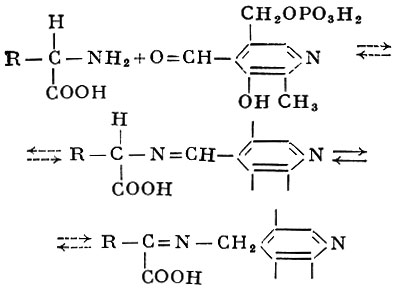
Образовавшийся таким образом кетимин затем гидролизуется с освобождением кетокислоты. соответствующей исходной аминокислоте, и пиридоксаминфосфата:
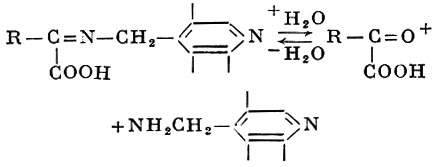
Далее пиридоксаминфосфат взаимодействует с другой кетокислотой, и все стадии реакции повторяются, протекая в обратном направлении. В результате образуется исходная форма протеида пиридоксальфосфата и новая аминокислота. Суммируя, получаем: фермент-пиридоксальфосфат + аминокислота1 ферментпиридоксаминфосфат + кетокислота1 фермент-пиридоксаминфосфат + кетокислота2
ферментпиридоксаминфосфат + кетокислота1 фермент-пиридоксаминфосфат + кетокислота2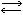 фермент-пиридоксальфосфат + аминокислота2.
фермент-пиридоксальфосфат + аминокислота2.
Спектральные исследования А. показали, что пиридоксальфосфат, связанный с белком,существует не в виде свободного альдегида, а в виде основания Шиффа (см. Шиффа основание).
Образование основания Шиффа между пиридоксальфосфатом и апоферментом объясняет тот факт, что пиридоксальфосфат труднее диссоциирует от А., чем пиридоксаминфосфат.
А. участвуют в следующих превращениях: образование аминокислот из кетокислот и обратное превращение (окислительный распад аминокислот); биосинтез γ-аминомасляной к-ты, мочевины, пуриновых и пиримидиновых оснований, порфиринов, флавинов, птеридинов, кобаламина.
Обратимое образование аланина, аспартата и глутамата из соответствующих кетокислот является важным звеном, непосредственно связывающим обмен углеводов с обменом аминокислот.
А. играют основную роль в азотистом обмене (см.). Окислительное дезаминирование аминокислот (за исключением глутамата) в животном организме осуществляется через реакции трансаминирования с учетом ос-кетоглутаровой к-ты в качестве переносчика аминогрупп. Сначала аминокислоты трансаминируются с кетоглутаровой к-той. Образующаяся при этом глутаминовая к-та дезаминируется под действием глутаматдегидрогеназы с образованием свободного аммиака и освобождением кетоглутаровой к-ты. Обратимость описанных реакций обеспечивает возможность синтеза аминокислот из аммиака и кетокислот путем непрямого аминирования последних. После перехода азота глутаминовой к-ты в аспарагиновую к-ту под действием А. азот аспартата используется в различных процессах биосинтеза, диссимилируется в других ферментативных превращениях до конечных азотистых продуктов (аммиак, мочевина, мочевая к-та). Определение активности А. в крови и других биологических жидкостях имеет определенное диагностическое значение. Так, содержание А. в плазме крови больных резко возрастает при нек-рых патологических состояниях, в частности сопровождающихся деструктивными процессами в паренхиматозных органах. Так, напр., содержание А. (и в первую очередь аспарат-кетоглутарат-аминотрансферазы) в плазме крови больного увеличивается многократно при инфаркте миокарда, достигая максимума на вторые и третьи сутки. Это позволяет проводить дифференциальный диагноз (в частности, от приступа стенокардии, при к-ром активность А. в плазме не повышается). Аналогичным образом при вирусном гепатите из пораженных клеток печени в плазму крови поступает большое количество А., в особенности аланин-кетоглутарат-аминотрансферазы, чего не наблюдается при иных формах желтухи (напр., обструкционной). При вирусном гепатите и других поражениях паренхимы печени определение А. в плазме крови имеет не только диагностическое, но и прогностическое значение.
См. также Трансферазы.
Библиогр.: Молекулярные основы действия и торможения ферментов, Труды 5-го Международного биохим. конгресса, Симпозиум 4, М., 1962; Guirard В. М. а. Snell Е. Е. Vitamin B6 function in trans-amination and decarboxylation reactions, Cpmprehens. Biochem., v. 15, p. 138, 1964, bibliogr.
Источники:
- Большая медицинская энциклопедия. Том 1/Главный редактор академик Б. В. Петровский; издательство «Советская энциклопедия»; Москва, 1974.- 576 с.
|
ПОИСК:
|
© Анна Козлова подборка материалов; Алексей Злыгостев оформление, разработка ПО 2001–2019
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'