АМИНОКСИДАЗЫ
Расстановка ударений: АМИНОКСИДА`ЗЫ
АМИНОКСИДАЗЫ — группа ферментов, катализирующих окислительное дезаминирование моно-, ди- и полиаминов с образованием соответствующих альдегидов, аммиака (NH3) и перекиси водорода (Н2O2). Реакция идет в две стадии:
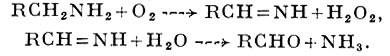
А. относятся к оксидазам (см.), т. е. к ферментам, катализирующим окисление субстрата с обязательным присутствием кислорода в качестве акцептора водорода (см. Дезаминирование). А. имеют большое значение, т. к. большинство их природных субстратов являются биогенными аминами (см.), многие из к-рых обладают фармакологической активностью (напр., серотонин, адреналин, норадреналин).
Классификация аминоксидаз построена на основе их отношения к карбонильным ингибиторам (см.), в соответствии с чем различают: 1) А., резистентные к карбонильным реагентам (напр., истинная моноаминоксидаза, или МАО, действующая на первичные, вторичные и третичные моноамины и на алифатические диамины с длинной цепью); 2) А., ингибируемые карбонильными реагентами, к-рые окисляют первичные амины, но не действуют на вторичные (к ним относятся днаминоксидаза и А. плазмы: внеклеточные А. — сперминоксидаза и бензиламиноксидаза).
Моноаминоксидаза (МАО) найдена во всех исследованных тканях беспозвоночных и позвоночных. Особенно много ее в околоушной и подчелюстной железах человека, а также печени, почках, аорте, поджелудочной
железе. Локализована в основном в митохондриях. Прочно связана с ми-тохондриальными мембранами; может быть отделена от них обработкой детергентами или ультразвуком. Коферментом служит флавинаденин-динуклеотид. МАО ингибируется реагентами на SH-группы, хотя считается, что последние не необходимы для каталитической активности этого фермента. Ингибиторы МАО подразделяются на гидразинные (напр., ипрониазид, ипразид, марсамид) и негидразинные (трансамин, паргилин, гармин, пиронин G, акридиновый оранжевый и др.). В живом организме гидразинные ингибиторы характеризуются более высокой избирательностью для мозга по сравнению с печенью. Ингибирование МАО п-хлормеркурибензоатом и тяжелыми металлами снимается глутатионом или цистеином.
Основная функция МАО в организме — инактивация биогенных аминов (см. Моноаминоксидазы).
Диаминоксидаза окисляет гистамин, путресцин, кадаверин, агматин и, в меньшей степени, алифатические моноамины. Найдена в тканях животных, растений и у микроорганизмов. Локализована в основном в цитоплазме, однако в печени кролика присутствует только в митохондриях. Ингибиторы — гидроксиламин, семикарбазид, гуанидин и его производные, метиленовый синий, цианиды и др. Из почек свиньи получена в кристаллическом виде. Мол. вес — 185000. Простетическими (т. е. небелковыми) группами являются пиридоксальфосфат и медь.
Сперминоксидаза присутствует в основном в крови жвачных животных. Из плазмы крови быка получена в кристаллическом виде. Мол. вес — 250000. В состав молекулы фермента входит пиридоксальфосфат и ионы двухвалентной меди.
См. также Ферменты.
Библиогр.: Analysis of biogenic amines and their related enzymes, ed. by D. Glick, N. Y. a. o., 1971; Kapeller-Adler R. Amine oxidases and methods for their study, N. Y. a. o., 1970.
Источники:
- Большая медицинская энциклопедия. Том 1/Главный редактор академик Б. В. Петровский; издательство «Советская энциклопедия»; Москва, 1974.- 576 с.
|
ПОИСК:
|
© Анна Козлова подборка материалов; Алексей Злыгостев оформление, разработка ПО 2001–2019
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'