АМИНОКИСЛОТЫ
Расстановка ударений: АМИНОКИСЛО`ТЫ
Содержание
Электрохимические свойства
Оптические свойства
Классификация аминокислот
Получение аминокислот
Определение аминокислот
Активный транспорт аминокислот
Роль аминокислот в питании
Патология обмена аминокислот
Применение аминокислот
Гистохимические методы выявления
аминокислот в тканях
Аминокислоты (син. аминокарбоновые кислоты) — органические (карбоновые) кислоты, содержащие одну или более аминогрупп; основная структурная часть молекулы белков.
В зависимости от положения аминогруппы в углеродной цепи по отношению к карбоксильной группе (т. е. у второго, третьего и т. д. углеродных атомов) различают α-, β-, γ-аминокислоты и т. д. Многие А. обнаружены в живых организмах в свободном виде или в составе более сложных соединений. Описано ок. 200 различных природных А., среди к-рых особенно важны ок. 20, входящих в состав белков (см.). Все найденные в белках А. представляют собой α-аминокислоты и отвечают общей формуле: RCH(NH2)COOH, где R — неодинаковый в разных А. радикал, присоединенный ко второму углеродному атому цепи. К этому же углеродному атому присоединена и аминогруппа. Т. о., у этого атома углерода 4 неодинаковых заместителя, и он является асимметрическим.
Еще до открытия А. как особого класса хим. веществ французские химики Воклен и Робике (L. W. Vauquelin, P. J. Robiquet, 1806) изолировали из сока спаржи кристаллический аспарагин, представляющий собой амид аспарагиновой кислоты (см.) и входящий в качестве одной из А. в состав белков.
Первая природная аминокислота (цистин) была открыта в 1810 г. в мочевых камнях Волластоном (W. Н. Wollaston); в 1819 г. Пруст (J. L. Proust), производя опыты по ферментации сыра, выделил кристаллы лейцина. В 1820 г. Браконно (Н. Braconnot) получил из гидролизата желатины глицин, к-рый имел сладкий вкус и был назван клеевым сахаром; лишь впоследствии глицин был отнесен к А. Открытие Браконно сыграло особенно важную роль, поскольку оно явилось первым случаем получения А. из гидролизата белка; в дальнейшем из гидролизатов белков были выделены и идентифицированы и остальные А., содержащиеся в составе белковых молекул.
А. обладают рядом общих свойств: это бесцветные, кристаллические вещества, плавящиеся обычно с разложением при сравнительно высоких температурах, сладкие, горьковатые или пресные на вкус. А. являются амфотерными электролитами, т. е. образуют соли как с кислотами, так и с основаниями и обладают нек-рыми свойствами, характерными и для органических кислот и для аминов. Природные α-аминокислоты могут вращать плоскость поляризации в разной степени вправо или влево в зависимости от природы А. и условий среды, но все они принадлежат к L-ряду, т. е. имеют одинаковую конфигурацию α-углеродного атома и могут рассматриваться как производные L-аланина или, соответственно, L-глицерпнового альдегида. Разнообразие свойств и характера радикалов различных А. определяет многообразие и специфические свойства как отдельных А., так и белковых молекул, в состав к-рых они входят. Химическое строение и важнейшие свойства природных А., встречающихся в гпдролизатах белков, приведены в табл. 1 (смотри ниже).
Электрохимические свойства
Обладая амфотерными свойствами (см. Амфолиты), А. в растворах диссоциируют как по типу кислотной диссоциации (отдавая ион водорода и заряжаясь при этом отрицательно), так и по типу щелочной диссоциации (присоединяя Н-ион и освобождая ион гидроксила), приобретая при этом положительный заряд. В кислой среде усиливается щелочная диссоциация А. и происходит образование солей с анионами кислот. В щелочной среде, наоборот, А. ведут себя как анионы, образуя соли с основаниями. Установлено, что А. в растворах практически полностью диссоциируют и находятся в виде амфотерных (биполярных) ионов, называемых также цвиттерионами или амфиионами:
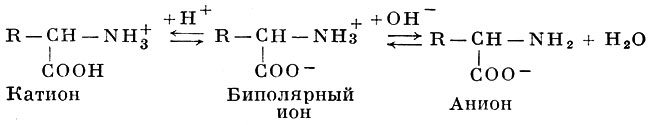
В кислой среде амфотерный ион присоединяет ион водорода, подавляющий кислотную диссоциацию, и превращается в катион; в щелочной среде с присоединением иона гидроксила подавляется щелочная диссоциация, и биполярный ион становится анионом. При определенном значении рН среды, неодинаковом для разных А., степень кислотной и щелочной диссоциации для данной А. уравнивается, и в электрическом поле А. не движется ни к катоду, ни к аноду. Это значение рН называют изоэлектрической точкой (pI), к-рая тем ниже, чем больше у данной А. выражены кислотные свойства, и тем выше, чем у А. больше выражены основные свойства (см. Изоэлектрическая точка). При рI растворимость А. становится минимальной, в соответствии с чем ее легче осадить из раствора.
Оптические свойства
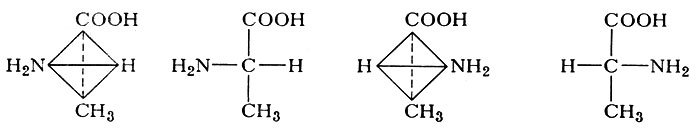
Все α-аминокислоты, за исключением глицина (см.), имеют асимметрический атом углерода. Таким атомом всегда является 2-й, или α-углеродный, атом, все четыре валентности к-рого заняты различными группами. В этом случае возможны две стереоизомерные формы, являющиеся зеркальным отражением друг друга и несовместимые между собой подобно правой и левой руке. На схеме изображены два стереоизомера А. аланина в виде объемного изображения и соответствующей ему проекции на плоскости. Изображение слева условно принято считать левой конфигурацией (L), справа — правой конфигурацией (D). Такие конфигурации соответствуют лево- и правовращающему глицериновому альдегиду, к-рый принят за исходное соединение при определении конфигурации молекул. Показано, что все природные А., получаемые из гидролизатов белков, по конфигурации α-углеродного атома соответствуют L-ряду, т. е. могут рассматриваться как производные L-аланина, в к-ром один водородный атом в метальной группе заменен на более сложный радикал. Удельное вращение плоскости поляризации света отдельных А. зависит как от свойств всей молекулы в целом, так и рН-раствора, температуры и других факторов.
Удельное вращение важнейших А., их изоэлектрические точки и показатели констант кислотной диссоциации (рКа) представлены в табл. 2 (смотри ниже).
Раньше оптические антиподы L-аминокислот, т. е. аминокислоты D-ряда, называли «неприродными», однако в наст, время аминокислоты D-ряда обнаружены в составе нек-рых бактериальных продуктов и антибиотиков. Так, капсулы спороносных бактерий (Вас. subtilis, В. anthracis и др.) в значительной мере состоят из полипептида, построенного из остатков D-глутаминовой к-ты. D-аланин и D-глутамидовая к-та входят в состав мукопептидов, образующих клеточные стенки ряда бактерий; валин, фенилаланин, орнитин и лейцин D-ряда содержатся в составе грамицидинов и многих других пептидов — антибиотиков и т. п. Стереоизомерные А. существенно различаются по своим биологическим свойствам, они атакуются ферментами, специфическими только к определенной оптической конфигурации, не заменяют или лишь частично заменяют друг друга в обмене веществ и т. п. D-изомеры аланина (см.), лейцина (см.), серина (см.), триптофана (см.) и валина (см.) очень сладкие, тогда как L-стереоизомеры аланина и серина умеренно сладкие, триптофана — безвкусны, а лейцина и валина — горьковаты. Характерный «мясной» вкус L-глутаминовой к-ты отсутствует у D-формы. Синтетические А. обычно представляют собой рацематы, т. е. смесь равных количеств D- и L-форм. Их обозначают как DL-аминокислоты. При помощи нек-рых специальных реактивов или обработки некоторыми ферментами синтетические А. можно разделить на D- и L-формы или получить только один желаемый стереоизомер.
Классификация аминокислот
Характерные свойства отдельных А. определяются боковой цепью, т. е. радикалом, стоящим у α-углеродного атома. В зависимости от строения этого радикала А. подразделяют на алифатические (к ним относится большинство А.), ароматические (фенилаланин и тирозин), гетероциклические (гистидин и триптофан) и иминокислоты (см.), у к-рых атом азота, стоящий при α-углеродном атоме, соединен с боковой цепью в пирролидиновое кольцо; к ним относятся пролин и оксипролин (см. Пролин).
По числу карбоксильных и аминных групп А. делят следующим образом.
Моноаминомонокарбоновые аминокислоты содержат одну карбоксильную и одну аминную группы; к ним относится большая часть А. (их рI лежит ок. рН 6).
Моноаминодикарбоновые аминокислоты содержат две карбоксильные и одну аминную группы. Аспарагиновая и глутаминовая кислота (см.) обладают слабокислыми свойствами.
Диаминомонокарбоновые кислоты — аргинин (см.), лизин (см.), гистидин (см.) и орнитин — в водном растворе диссоциируют преимущественно как основания.
По химическому составу замещающих групп различают: оксиаминокислоты (содержат спиртовую группу) — серии и треонин (см.), серосодержащие А. (содержат в своем составе атомы серы) — цистеин, цистин (см.) и метионин (см.); амиды (см.) дикарбоновых А. — аспарагин (см.) и глутамин (см.) и т. п. Аминокислоты с углеводородным радикалом, напр. аланин, лейцин, валин и др., придают белкам гидрофобные свойства; если радикал содержит гидрофильные группы, как, напр., у дикарбоновых А., они сообщают белку гидрофильность.
| Название | Рациональное название | Формула | Молекулярный вес | Температура плавления | Растворимость в граммах на 100 г воды при t° 25° |
|---|---|---|---|---|---|
| L-Аланин | α-Аминопропионовая кислота | 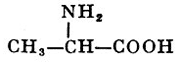 | 89,09 |
297° (с разложением) |
16,51 |
L-Аргинин |
α-Амино-δ-гуанидинвалериановая кислота |
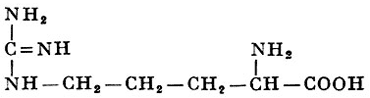 | 174,20 |
238° (с разложением) |
Легко растворим |
L-Аспарагин |
γ-Амид α-аминоянтарной кислоты |
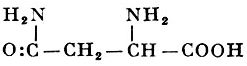 | 132,12 |
236° (с разложением) |
3,11 (28°) |
L-Аспарагиновая кислота |
α-Аминоянтарная кислота |
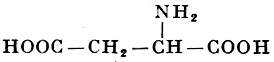 | 133,10 |
270° |
0,50 |
L-Валин |
α-Аминоизовалериановая (α-амино-β-метилмасляная) кислота |
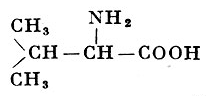 | 117,15 |
315° (с разложением) |
8,85 |
L-Гистидин |
α-Амино-β-имидазолилпропионовая кислота |
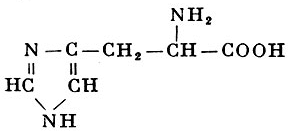 | 155,16 |
277° (с разложением) |
4,29 |
Глицин (гликокол) |
Аминоуксусная кислота |
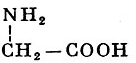 | 75,07 |
290° (с разложением) |
24,99 |
L-Глутамин |
δ-Амид-α-аминоглутаровой кислоты |
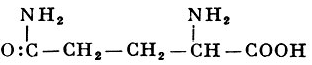 | 146,15 |
185° |
3,6 (18°) |
L-Глутаминовая кислота |
α-Аминоглутаровая кислота |
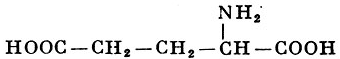 | 147,13 |
249° |
0,843 |
L-Изолейцин |
α-Амино-β-метилвалериановая кислота |
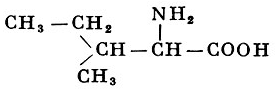 | 131,17 |
284° (с разложением) |
4,117 |
L-Лейцин |
α-Аминоизокапроновая кислота |
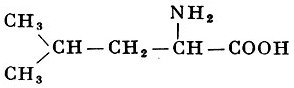 | 131,17 |
295° (с разложением) |
2,19 |
L-Лизин |
α-, ε-Диаминокапроновая кислота |
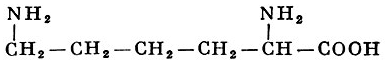 | 146,19 |
224° (с разложением) |
Легко растворим |
L-Метионин |
α-Амино-γ-метилтиомасляная кислота |
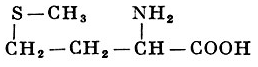 | 149,21 |
283° (с разложением) |
3,35 |
L-Оксипролин |
γ-Оксипирролидин- α-карбоновая кислота |
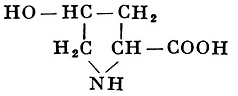 | 131,13 |
270° |
36,11 |
L-Пролин |
Пирролидин-α-карбоновая кислота |
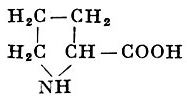 | 115,13 |
222° |
162,3 |
L-Серин |
α-Амино-β-оксипропионовая кислота |
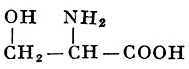 | 105,09 |
228° (с разложением) |
5,023 |
L-Тирозин |
α-Амино-β-параоксифенилпропионовая кислота |
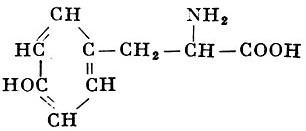 | 181,19 |
344° (с разложением) |
0,045 |
L-Треонин |
α-Амино-β-оксимасляная кислота |
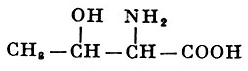 | 119,12 |
253° (с разложением) |
20,5 |
L-Триптофан |
α-Амино-β-индолилпр опионовая кислота |
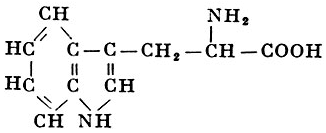 | 204,22 |
282° (с разложением) |
1,14 |
L-Фенилалавин |
α-Амино-β-фенилпропионовая кислота |
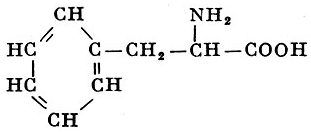 | 165,19 |
284° |
2,985 |
L-Цистеин |
α-Амино-β-тиопропионовая кислота |
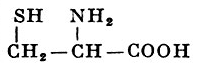 | 121,15 |
178° |
- |
L-Цистин |
Ди-α-амино-β-тиопропионовая кислота |
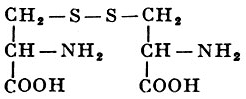 | 240,29 |
261° (с разложением) |
0,011 |
| Аминокислота | Удельное вращение | Константы кислотной диссоциации | Изоэлектрическая точка рI | |||
|---|---|---|---|---|---|---|
| водного раствора | в 5 н. растворе соляной кислоты | pK1 | pK2 | pK3 | ||
| Алании | +1,6 | +13,0 | 2,34 | 9,69 | 6,0 | |
| Аргинин | +21,8 | +48,1 | 2,18 | 9,09 | 13,2 | 10,9 |
| Аспарагин | -7,4 | +37,8 | 2,02 | 8,80 | 5,4 | |
| Аспарагиновая кислота | +6,7 | +33,8 | 1,88 | 3,65 | 9,60 | 2,8 |
| Валии | +6,6 | 33,1 | 2,32 | 9,62 | 6,0 | |
| Гистидин | +59,8 | +18,3 | 1,78 | 5,97 | 8,97 | 7,6 |
| Глицин | 2,34 | 9,60 | 6,0 | |||
| Глутамин | +9,2 | +46,5 | 2,17 | 9,13 | 5,7 | |
| Глутаминовая кислота | +17,7 | +46,8 | 2,19 | 4,25 | 9,67 | 3,2 |
| Изолейцин | +16,3 | +51,8 | 2,26 | 9,62 | 5,9 | |
| Лейцин | -14,4 | +21,0 | 2,36 | 9,60 | 6,0 | |
| Лизин | +19,7 | +37,9 | 2,20 | 8,90 | 10,28 | 9,7 |
| Метионин | -14,9 | +34,6 | 2,28 | 9,21 | 5,7 | |
| Оксипролин | -99,6 | -66,2 | 1,82 | 9,65 | 5,8 | |
| Пролин | -99,2 | -69,5 | 1,99 | 10,60 | 6,3 | |
| Серии | -7,9 | +15,9 | 2,21 | 9,15 | 5,7 | |
| Тирозин | -6,6 | -18,1 | 2,20 | 9,11 | 10,07 | 5,7 |
| Треонин | -33,9 | -17,9 | 2,15 | 9,12 | 5,6 | |
| Триптофан | -68,8 | +5,7 | 2,38 | 9,39 | 5,9 | |
| Фенилаланин | -57,0 | -7,4 | 1,83 | 9,13 | 5,5 | |
| Цистеин | -20,0 | +7,9 | 1,71 | 8,33 | 10,78 | 5,0 |
| Цистин | <1,00 | 2,01 | 8,02 pK4 = 8,71 | 5,0 | ||
Помимо уже упомянутых А. (см. табл. и соответствующие статьи), в тканях человека, животных, растений и у микроорганизмов найдено еще более 100 А., многие из к-рых играют важную роль в живых организмах. Так, орнитин и цитруллин (относятся к диаминокарбоновым А.) играют важную роль в обмене веществ, в частности в синтезе мочевины у животных (см. Аргинин, Мочевина). В организмах найдены высшие аналоги глутаминовой к-ты: α-аминоадипиновая к-та с б атомами углерода и α-аминопимелиновая к-та с 7 атомами углерода. В составе коллагена и желатина найден оксилизин:
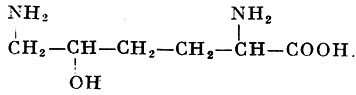
имеющий два асимметрических атома углерода. Из алифатических моноаминомонокарбоновых А. встречаются α-аминомасляная к-та, норвалин (α-аминовалериановая к-та) и норлейцин (α-ампнокапроновая к-та). Последние две получены синтетически, но не встречаются в составе белков. Гомосерин (α-амино-γ-оксимасляная к-та) является высшим аналогом серина. Соответственно α-амино-γ-тиомасляная к-та, или гомоцистеин, является подобным аналогом цистеина. Две последние А. наряду с лантионином:
[НООС—CH(NH2)—СН2—S-CH2—CH(NH2)—COOH]
и цистатионином:
[НООС—CH(NH2)—CH2—S—СН2—СН2—CH(NH2)—COOH]
принимают участие в обмене серосодержащих А. 2,4-Диоксифенилаланин (ДОФА) является промежуточным продуктом обмена фенилаланина (см.) и тирозина (см.). Из тирозина образуется такая А., как 3,5-дийодтирозин — промежуточный продукт образования тироксина (см.). В свободном состоянии и в составе нек-рых природных веществ встречаются А., метилированные (см. Метилирование) по азоту: метилглицин, или саркозин [CH2(NHCH3) COOH], а также метилгистидин, метилтриптофан, метиллизин. Последний недавно обнаружен в составе ядерных белков — гистонов (см.). Описаны также ацетилированные производные А., в том числе ацетиллизин составе гистонов.
Помимо α-аминокислот в природе, гл. обр. в свободном виде и в составе нек-рых биологически важных пептидов, встречаются А., содержащие аминогруппу у других атомов углерода. К ним относятся β-аланин (см. Аланин), γ-аминомасляная к-та (см. Аминомасляные кислоты), играющая важную роль в функционировании нервной системы, δ-аминолевулиновая к-та, являющаяся промежуточным продуктом синтеза порфиринов. К А. относят также таурин (H2N—CH2—CH2—SO3H), образующийся в организме в процессе обмена цистеина.
Получение аминокислот
А. получают различными методами, нек-рые из них предназначены специально для получения тех или иных А. Наиболее распространенными общими методами химического синтеза А. являются следующие.
1. Аминирование галоидопроизводных органических кислот. На галоидопроизводное (обычно бромзамещенную кислоту) действуют аммиаком, в результате чего галоид замещается на аминогруппу.
2. Получение А. из альдегидов путем обработки их аммиаком и цианистым водородом или цианидами. В результате такой обработки получается циангидрин, к-рый далее аминируется, образуя аминонитрил; омыление последнего дает А.
3. Конденсация альдегидов с производными глицина с последующим восстановлением и гидролизом.
Отдельные А. могут быть получены из гидролизатов белков в виде труднорастворимых солей или других производных. Напр., цистин и тирозин легко осаждаются в изо электрической точке; диаминокислоты осаждают в виде солей фосфорно-вольфрамовой, пикриновой (лизин), флавпановой (аргинин) и других кислот; дикарбоновые А. осаждают в виде кальциевых или бариевых солей, глутаминовая к-та выделяется в виде гидрохлорида в кислой среде, аспарагиновая к-та — в виде медной соли и т. д. Для препаративного выделения ряда А. из гидролизатов белка применяют также методы хроматографии и электрофореза. Для промышленных целей многие А. получают методами микробиологического синтеза, выделяя их из культуральной среды определенных штаммов бактерий.
Определение аминокислот
В качестве общей реакции на А. чаще всего применяют цветную реакцию с нингидрипом (см.), к-рый при нагревании дает с разными А. фиолетовое окрашивание различных оттенков. Применяют также реактив Фолина (1,2-нафтохинон-4-сульфоиово-кислый натрий), дезаминирование азотистой к-той с газометрическим определением выделяющегося азота по Ван-Слайку (см. Ван-Слайка методы).
Определение отдельных А., а также аминокислотного состава белков и свободных А. крови и других жидкостей и тканей организма обычно производят методами хроматографии на бумаге или на ионообменных смолах (см. Хроматография) или электрофореза (см.). Эти методы позволяют качественно и количественно определять малые количества (доли миллиграмма) любых А. с применением эталонных образцов этих соединений в качестве «свидетелей» или стандартов. Обычно пользуются автоматическими анализаторами А. (см. Автоанализаторы), проводящими за несколько часов полный аминокислотный анализ образцов, содержащих всего несколько миллиграммов А. Еще более быстрым и чувствительным методом определения А. является газовая хроматография их летучих производных.
А., поступающие в организм человека и животных с пищей, гл. обр. в виде пищевого белка, занимают центральное место в азотистом обмене (см.) и обеспечивают синтез в организме его собственных белков и нуклеиновых кислот, ферментов, многих коферментов, гормонов и других биологически важных веществ; в растениях из А. образуются алкалоиды (см.).
В крови человека и животных в норме поддерживается постоянный уровень содержания А. в свободном виде и в составе небольших пептидов. В плазме крови человека в среднем содержится 5—6 мг азота А. (обычно называемого аминоазотом) на 100 мл плазмы (см. Азот остаточный). В эритроцитах содержание аминоазота в 11/2—2 раза выше, в клетках органов и тканей оно еще выше. В сутки с мочой выделяется ок. 1 г А. (табл. 3). При обильном и несбалансированном белковом питании, при нарушении функции почек, печени и других органов, а также при нек-рых отравлениях и наследственных нарушениях обмена А. содержание их в крови повышается (гипераминоацидемия) и с мочой выделяются заметные количества А. (см. Аминоацидурия).
| Аминокислота | Плазма крови (мг %) | Моча за 24 часа (мг) |
|---|---|---|
| Азот аминокислот | 5,8 | 50-75 |
| Алании | 3,4 | 21-71 |
| Аргинин | 1,62 | - |
| Аспарагиновая кислота | 0,03 | <10 |
| Валин | 2,88 | 4-6 |
| Гистидин | 1,38 | 113-320 |
| Глицин | 1,5 | 68-199 |
| Глутаминовая кислота | 0,70 | 8-40 |
| Изолейцин | 1,34 | 14-28 |
| Лейцин | 1,86 | 9-26 |
| Лизин | 2,72 | 7-48 |
| Метионин | 0,52 | <5-10 |
| Орнитин | 0,72 | - |
| Пролив | 2,36 | <10 |
| Серии | 1,12 | 27-73 |
| Тирозин | 1,04 | 15-49 |
| Треонин | 1,67 | 15-53 |
| Триптофан | 1,27 | - |
| Цистин (+цистеин) | 1,47 | 10-21 |
Активный транспорт аминокислот
Существенную роль в обмене А. играет активный транспорт А. против градиента концентрации. Этот механизм поддерживает концентрацию А. в клетках на более высоком уровне, чем их концентрация в крови, а также регулирует всасывание А. из кишечника (в процессе переваривания белковой пищи) и обратное всасывание их из почечных канальцев после фильтрации мочи в мальпигиевых клубочках. Активный транспорт А. связан с действием специфических белковых факторов (пермеаз и транслоказ), избирательно связывающих А. и осуществляющих их активный перенос за счет распада богатых энергией соединений. Взаимная конкуренция одних А. между собой за активный перенос и отсутствие ее у других А. показывает, что существует несколько систем активного транспорта А. — для отдельных групп А. Так, цистин, аргинин, лизин и орнитин обладают общей системой транспорта и конкурируют между собой в этом процессе. Другая система транспорта обеспечивает перенос через мембраны глицина, пролина и оксипролина и, наконец, третья система, по-видимому, является общей для большой группы остальных А.
Роль аминокислот в питании
Человек и животные используют в обмене веществ азот, поступающий с пищей в виде А., гл. обр. в составе белков, нек-рых других органических соединений азота, а также аммонийные соли. Из этого азота путем процессов аминирования и трансаминирования (см. Переаминирование) в организме образуются различные А. Нек-рые А. не могут синтезироваться в животном организме, и для поддержания жизни эти А. должны обязательно поступать в организм с пищей. Такие А. называют незаменимыми. Незаменимые А. для человека: триптофан (см.), феиилаланин (см.), лизин (см.), треонин (см.), валин (см.), лейцин (см.), метионин (см.) и изолейцин (см.). Остальные А. относят к заменимым, но нек-рые из них заменимы лишь условно. Так, тирозин образуется в организме только из фенилалашгаа и при поступлении последнего в недостаточном количестве может оказаться незаменимым. Подобно этому цистеин и цистин могут образоваться из метионина, но необходимы при недостатке этой А. Аргинин синтезируется в организме, но скорость его синтеза может оказаться недостаточной при повышенной потребности (особенно при активном росте молодого организма). Потребность в незаменимых А. изучалась в исследованиях по азотистому равновесию, белковому голоданию, учету потребляемой пищи и др. Тем не менее потребность в них не поддается точному учету и может быть оценена лишь приблизительно. В табл. 4 приведены данные о рекомендуемых и безусловно достаточных для человека количествах незаменимых А. Потребность в незаменимых А. возрастает в периоды интенсивного роста организма, при повышенном распаде белков при нек-рых заболеваниях.
| Аминокислота | Рекомендуемое количество | Безусловно достаточное количество |
|---|---|---|
| L-Валии | 0,80 | 1,60 |
| L-Изолейцин | 0,70 | 1,40 |
| L-Лейцин | 1,10 | 2,20 |
| L-Лизин | 0,80 | 1,60 |
| L-Метионин | 1,10 | 2,20 |
| L-Треонин | 0,50 | 1,00 |
| L-Триптофан | 0,25 | 0,50 |
| L-Фенилалашга | 1,10 | 2,20 |
Принадлежность А. к заменимым или незаменимым для различных организмов не совсем одинакова. Так, напр., аргинин и гистидин, относящиеся к заменимым А. для человека, незаменимы для кур, а гистидин также для крыс и мышей. Аутотрофные организмы (см.), к к-рым относятся растения и многие бактерии, способны синтезировать все необходимые А. Однако ряд бактерий нуждается в наличии тех или иных А. в культуральной среде. Известны виды или штаммы бактерий, избирательно нуждающиеся в наличии определенных А. Такие мутантные штаммы, рост к-рых обеспечивается только при добавлении в среду определенной А., называют ауксотрофными (см. Ауксотрофные микроорганизмы). Ауксотрофные штаммы растут на среде, полноценной в остальных отношениях, со скоростью, пропорциональной количеству добавленной незаменимой А., поэтому их иногда применяют для микробиологического определения содержания данной А. в тех или иных биологических материалах, напр. Гатри метод (см.).
Недостаток в питании одной из незаменимых А. приводит к нарушению роста и общей дистрофии, но отсутствие нек-рых А. может давать также специфические симптомы. Так, недостаток триптофана нередко дает иеллагроподобные явления, поскольку из триптофана в организме образуется никотиновая к-та (у экспериментальных крыс при недостатке триптофана наблюдается помутнение роговицы, катаракта, выпадение шерсти, анемия); недостаток метионина приводит к поражению печени и почек; недостаток валина вызывает неврологические симптомы и т. д.
Полноценное питание обеспечивается при сбалансированном содержании отдельных А. в пище. Избыток нек-рых А. также неблагоприятен. Избыток триптофана приводит к накоплению продукта его обмена — 3-оксиантраниловой к-ты, к-рая может вызывать опухоли мочевого пузыря. При несбалансированном питании избыток нек-рых аминокислот может нарушать обмен или использование других А. и вызывать недостаточность последних.
Патология обмена аминокислот
Наиболее частой причиной амнноацидурий и гипераминоацидемий являются заболевания почек, связанные с нарушением выделения и обратного всасывания А. Ряд специфических нарушений обмена А. связан с наследственной недостаточностью определенных ферментов, участвующих в их метаболизме.
Так, редкое, но давно известное заболевание - алкаптонурия обусловлено недостаточностью в организме фермента — оксидазы гомогентизиновой к-ты (одного из продуктов промежуточного обмена тирозина). При алкаптонурии гомогентпзи новая к-та выделяется с мочой и, окисляясь на воздухе, окрашивает ее в черный цвет. Хотя алкаптонурия обнаруживается с младенчества, клинические нарушения при этом незначительны и сводятся лишь к большей подверженности особому виду артропатии (охронозу). Другим наследственным нарушением обмена А. является фенилкетонурия. При этом заболевании имеет место недостаточность или отсутствие фермента фенилаланин-4-гидроксилазы, вследствие чего нарушается превращение фенилаланина в тирозин; тирозин, в норме не являющийся незаменимой А., у больных фенилкетонурией становится незаменимым, поскольку он не может образовываться из фенилаланина. Фенилкетонурия связана с тяжелыми клиническими нарушениями, из к-рых наиболее важным является нарушение развития головного мозга и вследствие этого тяжелая умственная отсталость, проявляющаяся с раннего детства. Причиной этих нарушений является избыточное накопление фенилаланина в крови (гиперфенилаланинемия) и в моче, в особенности накопление продуктов его обмена, в частности фенилпировиноградной к-ты (фенилкетонурия), от к-рой и происходит название этой болезни. В наст, время развитие неврологических нарушений, вызванных фенилкетонурией, успешно смягчают, назначая младенцам специальную диету с очень низким содержанием фенилаланина. Нек-рые важнейшие наследственные нарушения обмена аминокислот представлены в табл. 5.
Особое место занимают резко выраженные аминоацидурии (см.), возникающие в результате нарушения транспорта А. и, соответственно, всасывания их из почечных канальцев и из кишечника. К таким нарушениям относится цистинурия, диагностированная по выделению с мочой цистина и отложению его в виде камней и осадков в мочевых путях. В действительности цистинурия связана с нарушением общей системы активного транспорта четырех А. — лизина, аргинина, орнитина и цистина. При цистинурии выделяется в среднем более 4 г этих А. в сутки, из к-рых только ок. 0,75 г приходится на долю цистина, однако именно цистин вследствие своей низкой растворимости выпадает при этом в осадок и вызывает отложение камней. Нарушение другой системы активного транспорта, общей для глицина, пролина и оксипролина, приводит к повышенному выделению с мочой этих трех А. (без появления признаков клинических нарушений). Наконец, нарушение еще одной общей системы транспорта А., к к-рым относится, по-видимому, большая группа всех остальных А., называемое болезнью Хартнупа, связано с многообразными клиническими проявлениями, неодинаковыми в разных случаях заболевания.
Применение аминокислот
А. находят широкое применение в медицине и других областях. Различные наборы А. и гидролизаты белков, обогащенные отдельными А., применяются для парентерального питания при операциях, заболеваниях кишечника и нарушениях всасывания. Нек-рые А. оказывают специфический терапевтический эффект при различных расстройствах. Так, метионин применяют при ожирении печени, циррозах и т. п.; глутаминовая и γ-амино-масляная кислоты дают хороший эффект при нек-рых заболеваниях ц. н. с. (эпилепсии, реактивных состояниях и т. д.); гистидин иногда применяют для лечения больных гепатитами, язвенной болезнью желудка и двенадцатиперстной кишки.
А. применяют также в качестве добавок к пищевым продуктам. Практически наиболее важны добавки лизина, триптофана и метионина к пищевым продуктам, неполноценным по содержанию этих аминокислот. Добавка глутаминовой к-ты и ее солей к ряду продуктов придает им приятный мясной вкус, что часто используют в кулинарии. Помимо питания человека и применения А. в пищевой промышленности, их используют для кормления животных, для приготовления культуральных сред в микробиологической промышленности и как реактивы.
См. также Азотистый обмен, Обмен веществ и энергии, Окисление биологическое.
Гистохимические методы выявления аминокислот в тканях
Реакции выявления А. в тканях основаны гл. обр. на выявлении аминогрупп (NH2-), карбоксильных (СООН—), сульфгидрильных (SH-) и дисульфидных (SS-) групп. Разработаны методы выявления отдельных А. (тирозина, триптофана, гистидина, аргинина). Идентификация А. проводится также при помощи блокирования тех или иных групп. Следует иметь в виду, что гистохимик имеет дело, как правило, с денатурированным белком, поэтому результаты гистохимических методов не всегда сопоставимы с биохимическими.
Для выявления SH- и SS-групп лучшей считается реакция с 2,2′-диокси - 6,6′ - динафтилдисульфидом (ДДД), основанная на образовании нафтил дисульфид а, связанного с белком, содержащим SH-группы. Для развития окраски препарат обрабатывают солью диазония (прочный синий Б или прочный черный К), к-рая соединяется с нафтилдисульфидом, образуя азокраситель, окрашивающий участки локализации SH-и SS-групп в тканях в оттенки от розового до сине-фиолетового. Метод позволяет проводить количественные сопоставления. Ткань фиксируется в жидкости Карнуа, Буэна, в формалине. Лучшие результаты дает 24-часовая фиксация в 1% растворе трихлоруксусной к-ты на 80% спирте с последующей промывкой в серии спиртов возрастающей концентрации (80, 90, 96%), затем производится обезвоживание и заливка в парафин. Для реакции необходимы реактивы: ДДД, соль диазония, 0,1 М веронал-ацетатный буферный раствор (рН 8,5), 0,1 М фосфатный буферный раствор (рН 7,4), этиловый спирт, серный эфир.
α-Аминокислоты выявляются с помощью нингидрин-реактива Шиффа. Метод основан на взаимодействии нингидрина с аминогруппами (NH2-); образующийся при этом альдегид выявляется реактивом Шиффа. Материал фиксируется в формалине, безводном спирте, жидкости Ценкера, заключается в парафин. Необходимы реактивы: нингидрин, реактив Шиффа, этиловый спирт. Ткани, содержащие α-аминогруппы, окрашиваются в розовато-малиновые оттенки. Специфичность реакции, однако, является спорной, т. к окислению нингидрином могут подвергаться не только α-аминокислоты, но и другие алифатические амины.
| Название | Фермент, недостаточность которого вызывает нарушение обмена | Причина нарушения обмена | Некоторые патологические проявления |
|---|---|---|---|
| Тирозинемия | Оксидаза п-оксифенилпировиноградной кислоты | Неспособность превращать п-оксифенилпировиноградную кислоту в гомогентизиновую кислоту | Тяжелое поражение печени и почечных канальцев, нередко смертельное в младенчестве |
| Гистидинемия | Гистидаза (гистидин-α-дезаминаза) | Неспособность образовывать урокининовую кислоту из гистидина. Повышенное содержание в крови и выделение с мочой гистидина и имидазолпировиноградной кислоты | Дефекты речи. Нередко некоторая степень умственной отсталости |
| Гомоцистинурия | Цистатионин-синтетаза (сериндегидратаза) | Неспособность образовывать цистатионин из гомоцистеина и серина. Повышенное содержание гомоцистина и метионина в сыворотке и аномальное выделение гомоцистина с мочой | Умственная отсталость, аномалии развития скелета, эктопия хрусталика, артериальная и венозная тромбоэмболия |
| Цистатионинурия | Цистатионаза (гомосериндегидратаза) | Неспособность расщеплять цистатионин с образованием цистина, α-кетобутирата и аммиака. Значительное выделение цистатионина с мочой и повышенное содержание его в тканях и сыворотке | Иногда умственная отсталость и психические нарушения |
| Лейциноз (болезнь «кленового сиропа») | Декарбоксилаза (декарбоксилазы) кетокислот с разветвленной углеродной цепью | Нарушение декарбоксилирования кетокислот (α-кето-изовалериановой, α-кето-β-метилвалериановой и α-кетоизокапроновой), являющихся продуктами дезаминирования А. валина, изолейцина и лейцина, и выделение этих кетокислот и соответствующих А. с мочой | Характерный запах мочи, напоминающий кленовый сироп. Прогрессирующее неврологическое заболевание с выраженной дегенерацией мозга, обычно начинающееся вскоре после рождения и кончающееся летально в течение нескольких недель или месяцев. В более легки» случаях перемежающиеся приступы токсической энцефалопатии и выделения названных кетокислот и А. с мочой |
| Один из типов кретинизма с зобом | Йодотирозиндейодиназа | Нарушение дейодирования моно- и дийодтирозина при синтезе тиреоидного гормона | Резкое увеличение щитовидной железы, сопровождающееся тяжелым гипотиреоидизмом |
| Гипервалинемия | Валинтрансаминаза | Нарушение переаминирования валина; повышенное содержание его в крови и выделение с мочой | Нарушение развития и умственная отсталость |
| Изовалериановая ацидемия | Изовалерил-кофермент А-дегидрогеназа | Повышенные количества изовалериановой кислоты (продукта дезаминирования валина) в крови и моче | Периодические приступы ацидоза и комы |
| Гиперпролинемия | Пролиноксидаза | Повышенное содержание в сыворотке и выделение с мочой пролина вследствие нарушения превращения его в Δ1-пирролидин-5-карбоксилат | В некоторых случаях нарушение функции почек и умственная отсталость |
| Оксипролинемия | Оксипролиноксидаза | Нарушение превращения оксипролина в Δ1-пирролидин-3-окси-5-карбоксилат и повышенное содержание оксипролина в сыворотке и моче | Тяжелая умственная отсталость |
Тирозин, триптофан, гистидин выявляются тетразониевым методом. Соли диазония в щелочной среде находятся в виде гидроксидов диазония, присоединяющихся к названным аминокислотам. Для усиления цветной окраски срезы обрабатывают β-нафтолом или Н-кислотой. Фиксация формалином, жидкостью Карнуа. Необходимые реактивы: тетразотированный бензидин или лучше прочный синий Б, 0,1 М вероналацетатный буферный раствор (рН 9,2); 0,1 н. HCl, Н-кислота или β-нафтол. В зависимости от реактива срезы окрашиваются в фиолетово-синий или коричневый цвет. При оценке результатов нужно иметь в виду возможность присоединения к гидроксиду диазония фенола и ароматических аминов. Для дифферен-цировки аминокислот применяют контрольные реакции.
Библиогр.: Браунштейн А. Е. Биохимия аминокислотного обмена, М., 1949, библиогр.; Майстер А. Биохимия аминокислот, пер. с англ., М., 1961; Greenstein J. P. a. Winitz M. Chemistry of the amino acids, v. 1—3, N. Y.—L., 1961; Meister A. Biochemistry of the amino acids, v. 1—2, N. Y., 1965; Nivard R. J. Е. а. Тesser G. I. Amino acids and related compounds, Comprehens. Biochem., v. 6, p. 143, 1965, bibliogr.
Гистохимические методы выявления А. в тканях — Лилли Р. Патогистологическая техника и практическая гистохимия, пер. с англ., М., 1969, библиогр.; Пирс Э. Гистохимия, пер. с англ., с. 73, М., 1962; Принципы и методы гистоцитохимического анализа и патологии, под ред. А. П. Авцына и др., Л., 1971, библиогр.
Источники:
- Большая медицинская энциклопедия. Том 1/Главный редактор академик Б. В. Петровский; издательство «Советская энциклопедия»; Москва, 1974.- 576 с.
|
ПОИСК:
|
© Анна Козлова подборка материалов; Алексей Злыгостев оформление, разработка ПО 2001–2019
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'