АМИДАЗЫ
Расстановка ударений: АМИДА`ЗЫ
АМИДАЗЫ (син.: дезамидазы, ами-догидролазы) — ферменты класса гидролаз, катализирующие гидролиз связи между атомами углерода и азота в амидах.
Реакция протекает по следующей схеме:
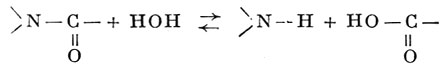
Из А., имеющих наибольшее биологическое значение, следует назвать аспарагиназу, глутаминазу, уреазу и др. Напр., глутаминаза (КФЗ.5.1.2,-L-глутамин-амидогидролаза) дезамидирует глутамин (см.) с образованием глутаминовой кислоты (см.) и аммиака:
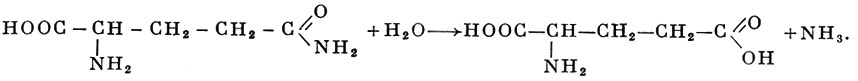
Аспарагиназа (КФ3.5.1.1.-L-аспарагин-амидогидролаза) сходным образом дезамидирует аспарагин с образованием аспарагиновой кислоты (см.) и аммиака. Оба фермента содержатся у микроорганизмов, в тканях растений и животных.
Глутамин в тканях животных гидролизуется двумя дезамидазами — фосфатзависимой глутаминазой (ФЗГ), активируемой ионами фосфата, и фосфатнезависимой глутаминазой (ФНГ). Эти два типа ферментов различаются по свойствам, локализации, регуляции и, вероятно, физиологическим функциям. Напр., ФНГ из печени крысы отличается от ФНГ из почек крысы по мол. весу, оптимуму рН, термостабильности, влиянию ингибиторов (см.) и активаторов.
Аммиак, выделяемый с мочой, образуется гл. обр. за счет дезамидирования глутамина в почках. При метаболических ацидозах (см.) глутаминазная активность ткани почек возрастает, вследствие чего увеличивается также образование аммиака в почках и нейтрализация кислых продуктов обмена за счет аммиака. Это один из механизмов защиты организма от потери катионов (К, Na, Са, Mg).
Механизм увеличения глутаминазной активности почек включает как активацию глутаминаз, так и повышение скорости их синтеза.
Аспарагиназа у животных обнаружена в печени, семенниках, мозге; фермент отсутствует в селезенке, почках, лимф, узлах. У морской свинки и родственных ей животных аспарагиназа содержится в сыворотке крови; в крови других животных, а также человека фермент не найден.
Высокоочищенная аспарагиназа получена из сыворотки крови морской свинки, из клеток кишечной палочки и нек-рых других микроорганизмов.
Аспарагиназа обладает способностью подавлять развитие нек-рых форм лейкемических опухолей или вызывать их регрессию. Противолейкозное действие препаратов аспарагиназы из разных источников неодинаково; из двух изоферментов аспарагиназы кишечной палочки противолейкозной активностью обладает лишь один (см. L-аспарагиназа). Чувствительность к аспарагиназе характерна лишь для определенных типов лейкемий. Напр., к аспарагиназе особенно чувствительны лейкемии, вызванные облучением. В тех случаях, когда отмечалось излечение лейкемии или ремиссия как в экспериментах на животных, так и в клинике, было установлено, что лейкозные клетки этих животных и пациентов при культивировании in vitro нуждаются в добавке к среде аспарагина. Очевидно, противолейкозное действие аспарагиназы обусловлено обеднением тканей аспарагином вследствие его дезамидирования. Аспарагин входит в состав белков, и, следовательно, снижение его концентрации приводит к нарушению синтеза белков, что может служить непосредственной причиной регрессии опухоли.
Особенностью противолейкозного действия аспарагиназы является ее высокая эффективность при лечении радиационной лейкемии у животных. При применении аспарагиназы для лечения лейкозов у человека ремиссия, или улучшение состояния, наблюдалась лишь в части случаев.
В растительных тканях, у многих микроорганизмов, моллюсков и членистоногих найден фермент уреаза (КФ3.5.1.5- карбамид - амидогидролаза), гидролизующий мочевину с образованием аммиака и углекислоты. Уреаза соевых бобов была первым ферментом, полученным в кристаллическом состоянии [Самнер (J. В. Sumner), 1926]. Очищенная уреаза применяется в биохимическом анализе для количественного определения мочевины в биологических объектах. Так наз. аммиачное брожение мочи обусловлено бактериальными уреазами.
Источники:
- Большая медицинская энциклопедия. Том 1/Главный редактор академик Б. В. Петровский; издательство «Советская энциклопедия»; Москва, 1974.- 576 с.
|
ПОИСК:
|
© Анна Козлова подборка материалов; Алексей Злыгостев оформление, разработка ПО 2001–2019
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'