АЛЬДОЛАЗЫ
Расстановка ударений: АЛЬДОЛА`ЗЫ
АЛЬДОЛАЗЫ (устаревшее десмолазы) — групповое название ферментов, участвующих в механизме анаэробного расщепления углеводов. А. катализируют расщепление С—С-связи в нек-рых органических соединениях по реакции:
RCH(OH) — CR1R2R3 → RCHO + HCR1R2R3.
Лучше всего изучены А. фруктозо-1,6-дифосфата (Фру-1,6-Р2) из мышц и печени кролика, а также дрожжей, катализирующие обратимую реакцию: D-Фру-1,6-Р2 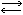 диоксиацетон P + D-глицеральдегид-3-Р. А. могут также катализировать аналогичное расщепление фруктозо-1-фосфата.
диоксиацетон P + D-глицеральдегид-3-Р. А. могут также катализировать аналогичное расщепление фруктозо-1-фосфата.
А. фруктозодифосфата открыта в 1934 г. Мейергофом п Ломанном (О. Meyerhof, K. Lohmann). Первоначальное название фермента «зимогексаза» в наст, время иногда применяют к комбинации А. с триозофосфатизомеразой, действие к-рых тесно связано. Этот фермент является главным компонентом миогена (см.). У животных и человека А. имеются во всех тканях, особенно много их в тканях с интенсивным обменом углеводов (см. Углеводный обмен), напр, в печени, миокарде, поперечнополосатых мышцах. В мышцах общее содержание А. составляет примерно 10% всех растворимых белков. В кристаллическом виде А. из мышц была получена в 1943 г. Варбургом и Кристианом (О. Warburg, W. Christian). Методы выделения А. основаны на способности А. кристаллизоваться из смеси белков при последовательном насыщении сульфатом аммония. Форма кристаллов А. зависит от рН среды.
А. могут быть разделены на два класса.
А. класса II встречаются в бактериях, грибах и сине-зеленых водорослях. Они характеризуются присутствием в активном центре прочно связанного иона цинка. Мол. вес А. класса II около 70000; они состоят из двух субъединиц и характеризуются высокой чувствительностью к сульфгидрильным реагентам, солям тяжелых металлов и комплексообразователям. Активируются ионами К+ и NH+4, обладают узким рН-оптнмумом.
А. класса I встречаются у простейших, зеленых водорослей, у всех высших растений и животных. Мол. вес А. класса I составляет 150—160 тыс. Они построены из четырех субъединиц, не являются металлоферментами, менее чувствительны к сульфгидрильным и комплексообразующим агентам, не активируются ионами К+ или NH+4, характеризуются широким рН-оптимумом (обычно рН 7,5—10,0).
У животных и человека имеется три типа А.: мышечный (А), печеночный (В) и мозговой (С). А. мышц кролика имеют субъединичную структуру ААВВ. Полипептидные цепи А и В гомологичны, структурный ген В возник в результате частичной дупликации (см.) прагена А и последующего независимого мутирования. Для эмбрионов характерен А-тип А., более приспособленный к гликолизу (см.). Отношение скоростей расщепления Фру-1,6-Р2/Фру-1-Р обладает органоспецифичностью, но не видоспецифичностью.
Равновесие реакции сильно сдвинуто в сторону Фру-1,6-Р. А. фруктозоднфосфата проявляет абсолютную специфичность по отношению к диоксиацетон-Р и групповую специфичность ко второму участнику реакции.
Активность А. измеряют обычно спектрофотометрически, сопрягая ее с триозофосфатизомеразой и α-глицерофосфатдегидрогеназой.
Биологическое значение А. фруктозодифосфата определяется ее ролью в гликолизе. Для медицины важно, что с нарушением синтеза А. в печени связана врожденная непереносимость фруктозы, наследуемая по рецессивному типу [одиночный аутосомальный аллель (см. Аллели)]. При этом, по-видимому, не синтезируется В-тип А., а продолжает синтезироваться эмбриональный А-тип, в результате чего накапливается Фру-1-Р, вызывающий общую интоксикацию организма. Наследственная непереносимость фруктозы — довольно частое заболевание, симптомы к-рого обычно проявляются при переводе детей на смешанное питание. При этом наблюдаются судороги, рвота, потеря сознания, тяжелые поражения печени и почек, часто со смертельным исходом. Для диагностики вводят внутривенно фруктозу (до 0,3 г/кг веса); наблюдается развитие гипогликемии (см.), сильное понижение в крови концентрации неорганического фосфата и резкое увеличение концентрации ппрувата и лактата. По-видимому, с возрастом острые явления сглаживаются. Лечение состоит в исключении из пищи фруктозы и сахарозы.
Активность А. в крови повышается при острых психозах, прогрессирующей мышечной дистрофии, поражениях печени, воспалительных процессах и нек-рых новообразованиях, причем при дистрофии и поражениях печени активность А. прямо пропорциональна степени развития заболевания. Это, очевидно, неспецифическая реакция, но она может успешно использоваться для контроля за развитием процесса. Специфическое определение А. типа А, В и С может быть достигнуто иммунологическими методами, т. к. антисыворотки, полученные на введение чистых индивидуальных А., реагируют специфически лишь с вызвавшими их образование антигенами.
См. также Ферменты.
Библиогр.: Horecker В. L. а. о. Aldolase, Enzymes, v. 7, p. 262, N. Y.—L., 1972, bibliogr.
Источники:
- Большая медицинская энциклопедия. Том 1/Главный редактор академик Б. В. Петровский; издательство «Советская энциклопедия»; Москва, 1974.- 576 с.
|
ПОИСК:
|
© Анна Козлова подборка материалов; Алексей Злыгостев оформление, разработка ПО 2001–2019
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'