АЛКОГОЛЬДЕГИДРОГЕНАЗЫ
Расстановка ударений: АЛКОГОЛЬДЕГИДРОГЕНА`ЗЫ
АЛКОГОЛЬДЕГИДРОГЕНАЗЫ — групповое название ферментов, катализирующих обратимую реакцию окисления первичных спиртов в альдегиды. Реакция протекает по следующей схеме:
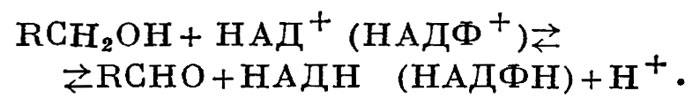
Равновесие реакции сильно сдвинуто в левую сторону.
А. обнаружены во многих животных и растительных тканях и у микроорганизмов. В кристаллическом виде А. выделена впервые из пивных дрожжей Негелейном в 1937 г. В 1948 г. А. удалось выделить из печени лошади. Частично очищенные препараты получены из зародышей пшеницы, из микроорганизмов, печени рыб и крыс. А. является индуцибельным (адаптивным) ферментом: в почках крыс, в рацион к-рых в течение месяца добавляли спирт, содержание А. повышалось.
Коферментом А. (см. Коферменты) является никотинамидадениндинуклеотид (НАД); в растениях найден фермент, требующий для своего действия никотинамидадешшдннуклеотидфосфат (НАДФ). Восстановленный НАД связывается с А. более прочно, чем окисленный.
А. малоспецифичны в отношении структуры субстратов и действуют на большое число нормальных и разветвленных алифатических и ароматических (первичных и вторичных) спиртов (см.), а также карбонильных соединений. Однако А. стереоспецифичны в отношении переноса водорода как отнимаемого от молекулы спирта, так и - присоединяемого к коферменту. А. является сульфгидрильным ферментом. Количество сульфгидрильных групп (SH-групп) зависит от вида А. Напр., максимальное количество SH-групп в алкогольдегидрогеназе дрожжей — 36, печени — 28. Мол. вес алкогольдегидрогеназы дрожжей — 150000, печени — 84000. Первая состоит из 4 субъединиц и имеет 4 активных центра. Вторая — имеет 2 субъединицы и 2 независимых друг от друга активных центра. Каждый из них имеет в своем составе молекулу НАД и ион цинка; последний может быть замещен на кадмий. Удаление иона металла сопровождается потерей ферментативной активности. В состав активного центра А. входят остатки лизина и цистеина. рН-оптимум алкогольдегидрогеназной реакции — ок. 8,0. Изоэлектрическая точка А. дрожжей лежит при рН 5,4, а печени — при рН 6,8. Согласно данным спектрофотометрии А. печени характеризуется низким содержанием ароматических аминокислот.
Ингибиторы А.: ионы тяжелых металлов, п-хлормеркурибензоат, о-фенантролин (его действие конкурентно по отношению к коферменту), дитизон, мочевина, тиомочевина, азиды, цианиды, гидроксиламин (действует на А. печени конкурентно по отношению к субстрату), нек-рые антибиотики (напр., стрептомицин).
А. печени довольно легко денатурируется при сильно кислых и сильно щелочных значениях рН, а также при нагревании. Кофермент оказывает стабилизирующий эффект.
Активность А. определяют спектрофотометрически по увеличению оптической плотности, обусловленному восстановлением НАД, при использовании в качестве окисляемого субстрата этилового спирта.
А. участвует в процессе брожения, обеспечивая образование этилового спирта из уксусного альдегида. В процессе обмена фруктозы А. восстанавливает глицериновый альдегид, образующийся при расщеплении фруктозо-1-фосфата, в глицерин (см. Углеводный обмен). А. играют важную роль в биохимических процессах, лежащих в основе зрения, — высвобождая энергию, используемую в анаэробных условиях (см. Глаз, биохимия; Зрение), а также в процессах окисления этилового спирта, попадающего в организм.
А. находит практическое применение в судебной медицине как специфический реагент для определения содержания спирта в крови. Используется также в качестве аналитического реагента для количественного определения НАД (окисленного и восстановленного) и в качестве вспомогательного фермента при измерении активности ряда других ферментов.
А. в сыворотке крови здорового человека не найдена, однако появляется при нарушении функции и повреждении печени. Особенно много ее обнаруживается при острых гепатитах. В то же время обтурационная желтуха и цирроз печени не сопровождаются появлением А. в крови.
В репаративной стадии острого гепатита А. исчезает из крови раньше чем нормализуются показатели аминотрансфераз (см.).
См. также Ферменты.
Библиогр.: Диксон М. и Уэбб Э. ферменты, пер. с англ., М. , 1966; Sund H. а. Тheorell Н. Alcohol dehydroge-nases в кн.: Enzymes, ed. by P. D. Boyer a o.,' V. 7, p. 25, N. Y. — L., 1963. bibliogr.
Источники:
- Большая медицинская энциклопедия. Том 1/Главный редактор академик Б. В. Петровский; издательство «Советская энциклопедия»; Москва, 1974.- 576 с.
|
ПОИСК:
|
© Анна Козлова подборка материалов; Алексей Злыгостев оформление, разработка ПО 2001–2019
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'