АЗОТ
Расстановка ударений: АЗО`Т
АЗОТ (Nitrogenium, N) — хим. элемент V группы периодической системы элементов Д. И. Менделеева, атом, номер 7, ат. масса 14,0067. Открыт Резерфордом (D. Rutherford) в 1772 г. Известны следующие изотопы А. (табл.).
| Стабильные | Радиоактивные | Содержание в плеяде, в % | Атомная масса по отношению к кислороду (16) | Период полураспада | Тип превращения |
|---|---|---|---|---|---|
| - | N12 | - | 12,0228 | 0,0125 | β+ |
| - | N13 | - | 13,0099 | 9,93 мин. | β+ |
| N14 | - | 99,635 | 14,007530 | - | - |
| N15 | - | 0,365 | 15,004870 | - | - |
| - | N16 | - | 16,0111 | 7,35 сек. | β-, λ |
| - | N17 | - | 17,0138 | 4,14 сек. | β-, η |
В различных соединениях А. обладает переменной валентностью, к-рая может быть равна — 3, +1, +2, +3, +4 и +5.
Распространение в природе. Общее содержание А. в земной коре составляет ок. 0,016 вес. %. Основная его масса находится в воздухе в свободном, молекулярном виде — N2. Сухой воздух содержит в среднем 78,09% по объему (или 75,6% по весу) свободного А. В относительно малых количествах свободный А. находится в растворенном состоянии в водах океанов. А. в виде соединений с другими элементами (связанный А.) входит в состав всех растительных и животных организмов.
Жизнь неразрывно связана со свойствами легко изменяющихся сложных азотистых веществ — белков. В состав белков в среднем входит 15—17% А. При отмирании организмов сложные азотистые соединения их в процессе круговорота А. превращаются в более простые соединения: аммиак, аммонийные соли, нитриты и нитраты. Все соединения А., как органические, так и неорганические, содержащиеся в почве, объединяются под названием «азот почвы».
Получение азота. В лабораториях чистый А. получают обычно нагреванием концентрированного водного раствора азотисто-кислого аммония или раствора смеси хлористого аммония с азотистокислым натрием:
NH4Cl + NaNO2 = N2 + NaCl + 2H2O.
В технике А. с примесью до 3% аргона получают фракционированной перегонкой жидкого воздуха.
Свойства азота. В свободном состоянии А. представляет собой бесцветный газ без запаха и вкуса, состоящий из двухатомных молекул — N2. Вес 1 л его при t° 0° и давлении 760 мм рт. ст. равен 1,2506 г, t°кип - 195,8°, t°пл - 209,86°; плотность жидкого А. 0,808 (при t° — 195,8°), твердого — 1,026 (при t ° — 255°). В 1 мл воды при t° 0°, 20° и 38° и парциальном давлении А., равном 760 мм, растворяется соответственно 0,0235, 0,0154 и 0,0122 мл азота.
Растворимость А. в крови меньше; она составляет при t° 38° 0,0110 мл А. При малых парциальных давлениях А. его растворимость в крови несколько больше, чем в воде.
В обычных условиях А. физиологически инертен, но при вдыхании воздуха, сжатого до 2—21/2атм, наступает состояние, называемое азотным наркозом, сходное с опьянением алкоголем. Это явление может иметь место при водолазных работах (см.) на глубине нескольких десятков метров. Для предупреждения возникновения подобного состояния иногда пользуются искусственными газовыми смесями, в к-рых А. заменен гелием или каким-либо другим инертным газом. При резком и значительном снижении парциального давления А. растворимость его в крови и тканях настолько снижается, что часть его выделяется в виде пузырьков, что является одной из причин возникновения кессонной болезни, наблюдающейся у водолазов при быстром их подъеме на поверхность и у летчиков при больших скоростях взлета самолетов в верхние слои атмосферы (см. Декомпрессионная болезнь).
Применение азота. Свободный А. как химически неактивный газ применяется в лабораторной практике п технике во всех случаях, когда наличие в окружающей атмосфере кислорода недопустимо или нежелательно, напр. при проведении биологического эксперимента в анаэробных условиях, при переливании больших количеств горючих жидкостей (для предотвращения пожаров) и т. д. Основная же масса свободного А. используется в промышленности для синтеза аммиака, цианамида кальция и азотной к-ты, к-рые являются исходными веществами для получения азотных удобрений, взрывчатых веществ, красок, лаков, фармацевтических препаратов и др.
Соединения азота. Свободный А. при обычных температурах химически инертен; при высокой температуре вступает в соединение со многими элементами.
С водородом А. образует ряд соединений, основными из к-рых являются следующие:
1. Аммиак (см.). А., входящий в состав аммиака, принято называть аммиачным азотом. В сан.-гиг. практике определение аммиачного А. производят при исследовании питьевых вод, при изучении процессов гниения белковых веществ (в частности, мяса и рыбы) и т. д.
2. Гидразин (N2H4) — бесцветная, дымящая на воздухе жидкость. С кислотами образует соли гидразина, напр, с соляной к-той — хлористый гидразоний (N2H4-HCl). Применяется как сильный восстановитель. Органические соединения гидразина имеют важное значение для характеристики Сахаров (см. Углеводы).
3. Азотистоводородная кислота (HN3) — бесцветная, кипящая при t° 37° жидкость с резким запахом. Взрывается с большой силой при нагревании. В водных растворах устойчива и проявляет свойства слабой кислоты. Соли ее — азиды — неустойчивы и взрываются при нагревании или ударе. Азид свинца Pb (N3)2 применяется в качестве детонатора. Вдыхание паров HN3 вызывает сильную головную боль и раздражение слизистых оболочек.
С кислородом А. образует пять окислов.
1. Закись азота, или веселящий газ (N2O), — бесцветный газ, получают при нагревании (выше 190°) азотнокислого аммония:
NH4NO3 = N2O + 2H2O.
В смеси с кислородом закись азота применяют как слабый наркотик, вызывающий состояние опьянения, эйфории, притупление болевой чувствительности. Применяется для ингаляционного наркоза (см.).
2. Окись азота (NO) — бесцветный газ, плохо растворимый в воде; в лабораториях получают действием азотной к-ты средней концентрации на медь:
8HNO3 + 3Cu = 2NO + 3Cu (NO3)2 + 4H2O,
в технике — продуванием воздуха через пламя электрической дуги. На воздухе мгновенно окисляется, образуя красно-бурые пары двуокиси азота; вместе с последней вызывает отравления организма (см. ниже — Профессиональные вредности соединений азота).
3. Двуокись азота (NO2) — красно-бурый газ, имеющий характерный запах и состоящий из собственно двуокиси А. и ее бесцветного полимера — четырехокиси азота (N2O4) — азотноватого ангидрида. Двуокись азота легко сгущается в красно-бурую жидкость, кипящую при t° 22,4° и затвердевающую при t° — 11° в бесцветные кристаллы. Растворяется в воде с образованием азотистой и азотной кислот:
2NO2 + H2O = HNO2+HNO3.
Является сильным окислителем и опасным ядом. Двуокись азота образуется при получении азотной кислоты, при реакциях нитрования, травлении металлов и т. п. и поэтому представляет собой профессиональный яд.
4. Трехокись азота, ангидрид азотистой к-ты (N2O3), — темно-синяя жидкость, затвердевающая при t° — 103° в голубые кристаллы. Устойчива лишь при низких температурах. С водой образует слабую и непрочную азотистую к-ту, со щелочами — соли азотистой к-ты — нитриты.
5. Пятиокись азота, ангидрид азотной к-ты (N2O5), — бесцветные призматические кристаллы, имеющие плотность 1,63, плавящиеся при t° 30° в желтую, слегка разлагающуюся жидкость; разложение усиливается при нагревании и при действии света. Температура кипения ок. 50°. С водой образует сильную, довольно устойчивую азотную к-ту, со щелочами — соли этой кислоты — нитраты.
При нагревании А. непосредственно соединяется со многими металлами, образуя нитриды металлов, напр. Li3N, Mg3N2, AlN и др. Многие из них разлагаются водой с образованием аммиака, напр.
Mg3N2 + 6H2O = 2NH3 + 3Mg (OH)2.
А. входит в состав большого числа органических соединений, среди к-рых особое значение имеют алкалоиды, аминокислоты, амины, нитросоединения, цианистые соединения и наиболее сложные природные соединения — белки.
Фиксация атмосферного азота. В течение долгого времени исходными веществами для получения разнообразных соединений А., необходимых для сельского хозяйства, промышленности и военного дела, служили природная чилийская селитра и аммиак, получаемый при сухой перегонке каменного угля. С истощением залежей чилийской селитры человечеству грозил «азотный голод». Проблема азотного голода была разрешена в конце 19 и начале 20 в. путем разработки ряда промышленных методов фиксации атмосферного А. Наиболее важным из них является синтез аммиака по схеме:
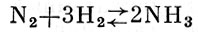
(см. Аммиак).
Определение азота. Для определения свободного А. анализируемый газ приводят в контакт с нагретым магнием; при наличии А. образуется нитрид магния, к-рый с водой дает аммиак.
Содержание А. в его кислородных соединениях определяют, переводя эти соединения в окись А., напр. в нитрометре Лунге. В органических соединениях А. обычно определяют по методу Кьельдаля (см. Кьельдаля метод).
Круговорот азота. А. является важнейшим биогенным элементом, необходимым для построения белков и нуклеиновых кислот. Однако А. атмосферы недоступен для животных и большей части растений. Поэтому в круговороте А. первостепенное значение имеет процесс его биологической фиксации (фиксация молекулярного А.атмосферы). Азотфиксация осуществляется азотфиксирующими микроорганизмами, напр. бактериями из рода Rhizobium, или клубеньковыми бактериями, живущими в симбиозе (см.) с бобовыми растениями (горох, люцерна, соя, люпин и др.), на корнях к-рых образуются клубеньки, содержащие бактерии, способные усваивать молекулярный А. К симбиотическим азотфиксаторам относятся также нек-рые актиномицеты, живущие в корневых клубеньках ольхи, лоха, облепихи и т. д. Активными азотфиксаторами являются также нек-рые свободноживущие микроорганизмы, обитающие в почве, пресных и соленых водоемах. Это анаэробная спороносная бактерия клостридиум (Clostridium pasteurianum), открытая С. Н. Виноградским, аэробная бактерия — азотобактер (см. Azotobacter). Способностью усваивать молекулярный А. обладают, кроме того, микобактерии, нек-рые виды сине-зеленых водорослей (Nostoc, Anabaena и др.), а также фотосинтезирующие бактерии.
Наибольшее значение в обогащении почвы А. имеют клубеньковые бактерии. В результате деятельности этих бактерий в почву вносится 100—250 кг/га за сезон; сине-зеленые водоросли на рисовых полях фиксируют до 200 кг/га А. в год. Свободноживущие азотфиксирующие бактерии связывают несколько десятков килограммов А. на один гектар почвы.
С. Н. Виноградский впервые (1894) высказал предположение о том, что первоначальным продуктом процесса биологической азотфиксации является аммиак. В наст, время это предположение полностью подтверждено. Доказано, что превращение N2 в NH3 представляет собой ферментативный процесс. Фермент, осуществляющий этот процесс (нитрогеназа), состоит из двух белковых компонентов, активен только в отсутствие кислорода, а сам процесс происходит за счет энергии аденозинтрифосфорной к-ты (АТФ). Растения, а также микроорганизмы затем превращают неорганический аммонийный А. в его органические соединения (аминокислоты, белки, нуклеиновые кислоты и т. д.), и в таком виде он становится доступным для животных и человека, включаясь в обменные процессы, протекающие в их организмах. Органический А. животных и растений попадает в почву (с выделениями животных или продуктами их разложения) и перерабатывается обитающими там различными червями, моллюсками, нематодами, насекомыми, а также микроорганизмами. Микроорганизмы почвы — аммонификаторы (гнилостные бактерии, нек-рые актиномицеты и грибы) — минерализуют в свою очередь органический А. почвы (тела животных и растений, органические удобрения, гумус) до аммония. Аммонификация — комплекс ферментативных процессов, протекающих в основном в два этапа: гидролиз белков и нуклеиновых кислот до аминокислот и азотистых оснований и последующее разложение этих соединений до аммиака. Образовавшийся аммиак нейтрализуется, реагируя с содержащимися в почве органическими и неорганическими кислотами. При этом происходит образование аммонийных солей. Аммонийные соли и аммиак в свою очередь подвергаются нитрификации под воздействием нитрифицирующих бактерий (открытых в 1890 г. С. Н. Виноградским) с образованием нитратов и нитритов.
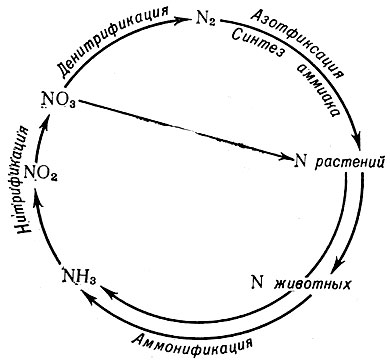
Схема круговорота азота в природе
Процессы нитрификации и аммонификации обеспечивают растения легко усваиваемыми соединениями А. Аммонийные соли и нитраты усваиваются растениями и микроорганизмами, превращаясь в А. органических соединений. Однако часть А. превращается в почве в молекулярный А. в результате процесса денитрификации, осуществляемого живущими в почве микроорганизмами — денитрификаторами (рис.). Денитрифицирующие бактерии широко распространены в природе, встречаясь в большом количестве в почве, навозе и в меньшем — в воде рек, озер и морей. Наиболее типичные денитрификаторы — подвижные, грамотрицательные палочки. К ним относятся Bacterium fluorescens, В. denitrificans, В. pyocyaneum и др.
Процесс денитрификации приводит к потере доступного растениям А., однако постоянно идущий процесс азотфиксации в какой-то степени компенсирует эти потери, а в известных условиях (в частности, при богатстве почвы безазотистыми органическими веществами) и значительно обогащает почву связанным А.
В целом совокупное действие процессов азотфиксации, нитрификации и денитрификации имеет большое биогеохимическое значение, способствуя сохранению динамического равновесия между содержанием молекулярного А. в атмосфере и связанного А. почвы, растительного и животного мира.
Круговорот А., таким образом, играет важнейшую роль в поддержании жизни на Земле.
Профессиональные вредности соединений азота. К числу наиболее вредных в профессиональном отношении соединений А. относятся азотная кислота (см.), аммиак (см.), аминосоединения (см. Амины) и амидосоединения (см. Амиды), а также смеси окислов А., или нитрогазов (N2O, NO, NO2, N2O4 и N2O5). Последние образуются при производстве и применении азотной к-ты (в процессе взаимодействия ее с различными металлами или органическими веществами), в процессе термического окисления А. воздуха при электро- и газосварке, работе дизельных и карбюраторных двигателей, сжигании топлива в мощных котельных, а также при взрывных работах и т. д. Общий характер действия нитрогазов на организм зависит от содержания в газовой смеси различных окислов А. В основном отравление протекает по раздражающему, или нитритному,типу действия. При контакте окислов А. с влажной поверхностью легких образуются азотная и азотистая кислоты, к-рые поражают легочную ткань, вызывая отек легких. Одновременно в крови образуются нитраты (см.) и нитриты (см.), непосредственно действующие на кровеносные сосуды, расширяя их и вызывая снижение кровяного давления. Нитриты, взаимодействуя с оксигемоглобином, превращают его в метгемоглобин, вызывая метгемоглобинемию (см.). Общим следствием действия окислов А. является кислородная недостаточность.
В производственных условиях возможны случаи воздействия отдельных окислов А. (см. ниже).
Закись азота. Большие ее концентрации вызывают шум в ушах, асфиксию, потерю сознания. Смерть наступает от паралича дыхательного центра.
Окись азота действует на ц. н. с., воздействует на гемоглобин (переводит оксигемоглобин в метгемоглобин).
При легком отравлении окисью А. наблюдается общая слабость, сонливость, головокружение (симптомы обратимы).
При более тяжелом отравлении начальные симптомы усиливаются, к ним присоединяется тошнота, иногда рвота, наступает полуобморочное состояние. При отравлениях средней тяжести резкая слабость и головокружение продолжаются много часов, нередко наблюдается синюшность слизистых оболочек и кожи, учащение пульса. При тяжелых отравлениях начальные явления нередко стихают, но после 1—3-дневной ремиссии появляются слабость и головокружение, наблюдаются снижение кровяного давления, серо-синяя окраска слизистых оболочек и кожи, увеличение и болезненность печени; границы сердца расширены, тоны глухие, пульс замедлен. Возникают полиневриты, полиневралгии. Кровь шоколадно-бурого цвета, повышенной вязкости. Последствия тяжелого отравления могут длиться более года: нарушение ассоциативных способностей, ослабление памяти и мышечной силы, общая слабость, головная боль, головокружение, быстрая утомляемость.
Двуокись азота. Острое отравление начинается с легкого кашля, в более тяжелых случаях — с сильного кашля, чувства стеснения в груди, головной боли, иногда рвоты, саливации. Период относительно удовлетворительного состояния длится 2—18 час. Затем появляются признаки нарастающего отека легких: сильная слабость, увеличивающийся кашель, боли в груди, цианоз, в легких много влажных хрипов, учащенное сердцебиение, иногда озноб, повышение температуры. Нередки значительные расстройства со стороны жел.-киш. тракта: тошнота, рвота, понос, сильные боли в верхней части живота. Отек легких характеризуется тяжелым состоянием (резкий цианоз, сильная одышка, учащенный пульс, кашель с пенистой мокротой, иногда с кровью). Кровяное давление в норме, в крови — увеличение количества эритроцитов и гемоглобина, лейкоцитоз, замедленная РОЭ. Рентгенологически — пониженная прозрачность легочных полей, в обоих легких большое количество хлопьевидных затемнений различной величины. Токсический отек легких сопровождается «синим» типом гипоксемии, при осложнении коллапсом наблюдается «серый» тип (см. Гипоксия). Нередки осложнения пневмонией. Возможен смертельный исход. На секции — отек легких, кровоизлияния в них, темная жидкая кровь в сердце и сосудах. Состояние отравленных и прогноз ухудшается, если пострадавшие до отравления страдали заболеваниями сердца или легких.
При хрон. отравлениях — хрон. воспалительные заболевания верхних дыхательных путей, хрон. бронхиты, эмфизема, понижение кровяного давления, зеленоватый налет на зубах, разрушение коронок резцов.
Ангидрид азотистой кислоты действует на организм аналогично окиси азота и другим низшим его окислам.
Первая помощь при отравлениях соединениями азота — перенести пострадавшего на свежий воздух; обеспечить полный покой, вдыхание кислорода. По показаниям — сердечные средства, при остановке дыхания — лобелин. Затем обязательная транспортировка пострадавшего в лежачем положении в стационар. При признаках начинающегося отека легких — внутривенно 10—20 мл 10% раствора хлорида кальция, 20 мл 40% раствора глюкозы с аскорбиновой к-той (500 мг), кислородная терапия.
Лечение развившегося отека легких зависит от типа гипоксемии. При «синем» типе — прерывистое введение кислорода (карбоген противопоказан), кровопускание (200—300 мл), при необходимости — повторение его через 6—8 час.; рекомендуются средства, понижающие кровяное давление, сердечные средства. При «сером» типе аноксемии — стимуляция дыхательного и вазомоторного центра путем прерывистого вдыхания карбогена, кофеин, эфедрин, внутривенно 50—100 мл 40% раствора глюкозы. Кровопускание противопоказано.
В целях профилактики и лечения пневмоний — раннее назначение сульфаниламидов и антибиотиков.
Профилактика: индивидуальная защита — фильтрующие противогазы марок В, М, KB, кислотозащитные перчатки и сапоги, герметичные очки, специальная одежда. Необходима полная герметизация производственного оборудования, где могут образоваться и выделяться нитрогазы, укрытие фиксированных источников выделения этих газов, местная вентиляционная система.
Предельно допустимая концентрация для окислов А. в воздухе рабочих помещений 5 мг/м3 (в пересчете на NО2), в атмосферном воздухе населенных пунктов 0,085 мг/м3 или 0,4 мг/м3 (для азотной к-ты).
Определение в воздухе окислов азота основано на поглощении двуокиси и четырехокиси азота раствором йодида калия и колориметрическом определении образовавшейся азотистой к-ты с реактивом Грисса—Илошваи.
Библиогр.: Некрасов Б. В. Основы общей химии, т. 1, с. 377, М., 1969; Реми Г. Курс неорганической химии, пер. с нем., т. 1, с. 560, М., 1972.
Круговорот А. - Виноградский С. Н. Микробиология почвы, М., 1952; Кретович В. Л. Обмен азота в растениях, М., 1972, библиогр.; Мишустин Е. Н. и Шильникова В. К. Биологическая фиксация атмосферного азота, М., 1968, библиогр.
Профессиональные вредности соединений А. — Вредные вещества в промышленности, под ред. Н. В. Лазарева, ч. 2, с. 136, Л., 1971; Гигиена труда в химической промышленности, под ред. З. А. Волковой и др., с. 373, М., 1967; Гуртовой Ю. А. Отравление парами азотной кислоты, Суд.-мед. экспертиза, т. 12, № 3, с. 45, 1969; Неймарк Е. З. и Зингер Ф. X. Профессиональные отравления рабочих угольных шахт, их лечение и профилактика, с. 34, М., 1961; Перегуд Е. А., Быховская М. С. и Гернет Е. В. Быстрые методы определения вредных веществ в воздухе, с. 67, М., 1970; Сафронов В. А. Особенности клинического течения отека легких при комбинированных поражениях азотной кислотой, Воен.-мед. журн., № 7, с. 32, 1966; Air quality criteria for nitrogen oxides, Washington, 1971, bibliogr.
Источники:
- Большая медицинская энциклопедия. Том 1/Главный редактор академик Б. В. Петровский; издательство «Советская энциклопедия»; Москва, 1974.- 576 с.
|
ПОИСК:
|
© Анна Козлова подборка материалов; Алексей Злыгостев оформление, разработка ПО 2001–2019
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'