АДСОРБЦИЯ
Расстановка ударений: АДСО`РБЦИЯ
АДСОРБЦИЯ (adsorptio; лат. ad — на, при и sorbeo — поглощаю) — поглощение газов, паров или растворенных веществ поверхностью твердого тела или жидкости.Тело, на поверхности к-рого происходит А., называют адсорбентом, адсорбируемое вещество — адсорбтивом или адсорбатом. А. газов твердыми телами (древесным углем) была открыта шведским химиком Шееле (С. W. Scheelе) в 1773 г. и независимо от него итальянцем Фонтаной (F. Foiitana) в 1777 г.; адсорбция веществ из растворов древесным углем — русским химиком академиком Т. Е. Ловицем в 1785 г. Возможность А. на поверхности жидкости и связь этого явления с поверхностным натяжением впервые теоретически были доказаны американским математиком и физиком Гиббсом (J. W. Gibbs) в 1876 г. Впоследствии было показано, что А. относится к чрезвычайно распространенным явлениям и обнаруживается почти всюду, где газы, пары и растворенные вещества находятся в контакте с поверхностью жидкости или твердого тела.
Различают физическую и химическую А. В первом случае адсорбированные молекулы сохраняют свою индивидуальность; при химической А., называемой также хемосорбцией, молекула адсорбируемого вещества вступает в химическую связь с поверхностью адсорбента. Физическая А., к-рую обычно называют просто А., представляет собой обратимый процесс, заканчивающийся установлением адсорбционного равновесия, при к-ром скорость А. равна скорости обратного процесса — десорбции. Хемосорбция, как правило, необратима.
А. часто сопровождается абсорбцией (см.), хемосорбцией и конденсацией паров адсорбтива в порах адсорбента. Во всех этих случаях сложный процесс поглощения называют сорбцией (см.).
Величину А. на поверхности жидкости, граничащей с газом или с другой жидкостью, непосредственно не измеряют, а вычисляют с помощью уравнения Гиббса:
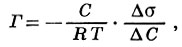
где Г — количество адсорбированного вещества в молях на 1 см2 поверхности жидкости, С — молярная концентрация адсорбтива в жидкости, R — газовая постоянная из уравнения Клапейрона—Менделеева, Т — абсолютная температура, Δσ — изменение поверхностного натяжения, соответствующее изменению концентрации адсорбтива на ΔС.
Величину А. газа или растворенного вещества на твердом адсорбенте измеряют непосредственно и выражают в молях адсорбированного вещества на 1 г адсорбента. Количество адсорбированного газа обычно определяют по привесу адсорбента, поглотившего газ; величину А. растворенного вещества — по уменьшению его концентрации в растворе.
Зависимость величины А. при постоянной температуре от равновесной концентрации адсорбтива, выраженную графически или в виде уравнения, называют изотермой А. На рис. представлена типичная экспериментальная изотерма А. При очень малых концентрациях величина А. пропорциональна концентрации, что находит свое выражение в прямолинейном ходе изотермы А. в области малых концентраций. С дальнейшим ростом концентрации рост величины А. замедляется. При очень больших концентрациях величина А. достигает предельного значения, что объясняется насыщением поверхности адсорбента молекулами адсорбтива, образующими мономолекулярный адсорбционный слой. В тех случаях, когда адсорбционный слой полимолекулярен или А. осложнена капиллярной конденсацией (см. Сорбция), изотерма поглощения имеет более сложный вид.
На практике для аналитического выражения изотермы А. при средних значениях концентраций обычно пользуются уравнением Фрейндлиха:
a = kcn,
где а — величина А. в молях на 1 г адсорбента, с — концентрация в молях на 1 л, k и n — константы. Константа k численно равна величине А. при концентрации, равной 1; величина ее определяет высоту кривой над осью абсцисс и меняется в широких пределах в зависимости от природы адсорбента и адсорбтива. Константа п определяет кривизну изотермы; ее численная величина мало изменяется с природой адсорбента и адсорбтива и колеблется в пределах от 0,1 до 0,6. Уравнение Фрейндлиха графически представляет собой параболическую кривую (рис.).
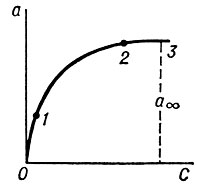
Рис. Изотерма адсорбции : a — величина адсорбции; с — равновесная концентрация; аsub∞/sub — предельная величина адсорбции; 0—1 — область малых концентраций; 1—2 — область средних концентраций; 2—3 — область больших концентраций
Для более широкой области концентраций чаще применяют уравнение Лангмюра:
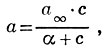
где а и с имеют те же значения, что и в уравнении Фрейндлиха, а∞ и α — константы, численные значения к-рых зависят от природы адсорбента и адсорбтива. Константа ах равна предельной величине А., соответствующей полному насыщению поверхности поглотителя молекулами адсорбтива. Константа α равна отношению константы скорости десорбции к константе скорости А.
Помимо концентрации адсорбтива, величина А. зависит от природы адсорбента и адсорбтива; А. возрастает с увеличением удельной поверхности поглотителя. Для органических веществ одного и того же гомологического ряда величина А. возрастает приблизительно в 3 раза с увеличением углеводородной цепи на одну группу СН2 (правило Дюкло—Траубе). Величина А., как правило, уменьшается с повышением температуры. Величина А. из растворов зависит от природы растворителя: чем лучше вещество растворяется в данном растворителе, тем хуже оно из него адсорбируется.
А. из растворов сильных электролитов подразделяют на следующие виды: эквивалентная А., при к-рой катионы и анионы электролита адсорбируются в эквивалентных количествах; избирательная А. — в этом случае избирательно адсорбируются или катионы, или анионы электролита; поверхность адсорбента при этом приобретает соответственно положительный или отрицательный электрический заряд. Ионообменная адсорбция представляет собой обмен катионов или анионов между адсорбентом и раствором (см. Иониты).
В насыщенном адсорбционном слое молекулы адсорбтива ориентированы, напр, на поверхности водных растворов полярные группы адсорбированных молекул погружены в раствор. Представление об ориентации молекул в насыщенном адсорбционном слое сыграло большую роль при изучении структуры биологических мембран.
Практическое значение адсорбционных явлений очень велико. А. лежит в основе крашения тканей, дубления кож и т. д. А. является начальной стадией процесса поглощения любых веществ клетками и тканями. С А. тесно связаны также процессы взаимодействия ферментов с субстратами, антител с антигенами, поляризации и деполяризации биологических мембран.
А. играет основную роль при протекании многих каталитических реакций (см. Катализ) и в химии коллоидных растворов.
Ряд адсорбентов (уголь, каолин, гидроокись железа, ионообменные смолы и другие) применяют как противоядия (см.) для связывания ядов и токсинов, попавших в жел.-киш. тракт, а также для А. кишечных газов при метеоризме (см.). Активированный древесный уголь используют как адсорбент в военных и промышленных противогазах. В технике А. применяют для очистки веществ, в т. ч. и лекарственных, регенерации ценных летучих растворителей, для разделения и анализа сложных смесей (см. Хроматография).
См. также Поверхностное натяжение.
Библиогр.: Адам Н. К. Физика и химия поверхностей, пер. с англ., М.—Л., 1947; Бладергрён В. Физическая химия в медицине и биологии, пер. с нем., М., 1951; Брунауэр С. Адсорбция газов и паров, пер. с англ., т. 1, М., 1948, библиогр.; Мак Бен Д. В. Сорбция газов и паров твердыми телами, пер. с англ., М.—Л., 1934.
Источники:
- Большая медицинская энциклопедия. Том 1/Главный редактор академик Б. В. Петровский; издательство «Советская энциклопедия»; Москва, 1974.- 576 с.
|
ПОИСК:
|
© Анна Козлова подборка материалов; Алексей Злыгостев оформление, разработка ПО 2001–2019
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'