АБСОРБЦИЯ
Расстановка ударений: АБСО`РБЦИЯ
АБСОРБЦИЯ (absorptio; лат. ab — от, из и sorbeo — поглощаю) в химии — поглощение газа или растворенного вещества жидкостью или твердым телом. Поглощаемое вещество (абсорбтив, или абсорбат) растворяется в поглотителе (абсорбент), равномерно распределяясь по всему его объему. Т. о., абсорбция аналогична растворению, чем отличается от адсорбции (см.) — процесса поглощения газов или растворенных веществ поверхностью поглотителя. Особое значение для медицины имеет А. газов жидкостями, т. к. этот процесс лежит в основе газообмена между организмом и средой (см. Газообмен). Количественной мерой А. газов в жидкостях служит коэффициент А. (коэффициент растворимости). Известно несколько способов выражения коэффициента А., из к-рых наиболее часто используются следующие.
Коэффициент абсорбции Бунзена (α) — объем газа (приведенного к нормальным условиям — t° 0° и 1 атм давления), растворенного в единице объема жидкости при данной температуре и парциальном давлении газа, равном 1 атм.
Коэффициент абсорбции Ван-Слайка (α0) — объем газа (в см3), приведенный к нормальным условиям, растворенный в 1 мл жидкости при данной температуре и парциальном давлении газа, равном 1 атм.
Коэффициент абсорбции Оствальда (β) — объем газа, измеренный в условиях эксперимента (без приведения к нормальным условиям), растворившийся в единице объема жидкости.
В таблице даны коэффициенты абсорбции Бунзена (как наиболее употребительные) для некоторых газов, имеющих физиологическое значение, в воде и плазме крови при t° 38°.
Величина А. газов жидкостями зависит от природы газа и жидкости, давления газа и температуры. Так, в соответствии с законом Генри концентрация (С) газа, растворенного в жидкости, пропорциональна давлению (Р) газа над жидкостью, или C = kP, где k — коэффициент пропорциональности. Если С выражена в объеме газа, приведенного к нормальным условиям, растворяющегося в единице объема жидкости, а давление Р — в атмосферах, то k равен коэффициенту абсорбции. Бунзена.
| Жидкость (растворитель) | Коэффициент абсорбции (по Бунзену) | ||
| Кислород | Азот | Двуокись углерода | |
| Вода | 0,0237 | 0,0122 | 0,555 |
| Плазма крови | 0,0230 | 0,0120 | 0,541 |
Закон Генри применим для малорастворимых газов. А. газа уменьшается с повышением температуры (на этом основан простой способ удаления, газов из жидкостей кипячением).
При А. смеси газов степень растворимости каждого газа в данной жидкости пропорциональна его парциальному давлению над раствором (закон Дальтона). Изменение растворимости газов с изменением давления имеет существенное значение в патогенезе газовой эмболии (см.) и: кессонной болезни (см. Декомпрессионная болезнь).
В растворах солей А. газов меньше, чем в чистой воде. И. М. Сеченов (1892) установил следующее соотношение, характеризующее влияние солей на растворимость газов в водных растворах:
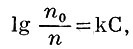
соотношение, характеризующее влияние солей на растворимость газов в водных растворах
где n0 и n — растворимость газа в воде и в растворе соли с концентрацией С моль/л соответственно, k — коэффициент пропорциональности, величина к-рого определяется природой соли.
См. также Диффузия, Сорбция.
Библиогр.: Бродский А. И. Физическая химия, т. 2, с. 497, М.—Л., 1948; Макинтош Р., Машин У. и Энштейн X. Физика для анестезиологов, пер. с англ., М., 1962. библиогр.
Источники:
- Большая медицинская энциклопедия. Том 1/Главный редактор академик Б. В. Петровский; издательство «Советская энциклопедия»; Москва, 1974.- 576 с.
|
ПОИСК:
|
© Анна Козлова подборка материалов; Алексей Злыгостев оформление, разработка ПО 2001–2019
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'
При копировании материалов проекта обязательно ставить активную ссылку на страницу источник:
http://sohmet.ru/ 'Sohmet.ru: Библиотека по медицине'